CXCR4和MMP2在三阴乳腺癌细胞株MDA-MB-231的表达及其相关性
宋艳艳, 缑文斌, 张 巍
(1新疆石河子大学医学院, 新疆 石河子 832000;2新疆医科大学, 乌鲁木齐 8300111;
3新疆医科大学第一附属医院病理科, 乌鲁木齐 830054)
CXCR4和MMP2在三阴乳腺癌细胞株MDA-MB-231的表达及其相关性
宋艳艳1, 缑文斌2, 张巍3
(1新疆石河子大学医学院, 新疆石河子832000;2新疆医科大学, 乌鲁木齐8300111;
3新疆医科大学第一附属医院病理科, 乌鲁木齐830054)
摘要:目的探讨基质金属蛋白酶(MMP2)和趋化因子受体CXCR4在人三阴乳腺癌细胞株MDA-MB-231的表达及其相关性。方法采用过表达质粒CXCR4和干扰SiRNA-CXCR4分别转染人三阴乳腺癌细胞株MDA-MB-231,分为空白转染组、无关转染组和目的转染组,应用RT-PCR和Western blot检测人三阴乳腺癌细胞株MDA-MB-231中基质金属蛋白酶(MMP2)和趋化因子受体CXCR4的 mRNA和蛋白表达水平。结果有效提高CXCR4的表达后,与空白转染组和无关转染组比较,目的转染组CXCR4及MMP2的mRNA及蛋白表达水平升高,差异有统计学意义(P<0.05);有效沉默CXCR4后,与空白转染组和空白转染组比较,目的转染组CXCR4及MMP2的mRNA及蛋白表达水平下降,差异有统计学意义(P<0.05)。结论CXCR4能够调节基质金属蛋白酶(MMP2)的表达,从而调节三阴乳腺癌的侵袭与转移。
关键词:三阴乳腺癌; CXCR4; MMP2
乳腺癌是女性最常见的恶性肿瘤之一,其发病率呈逐年增高趋势。三阴乳腺癌(triple-negative breast cancers,TNBC)是乳癌的特殊亚型[1],占乳癌的10%~24%[2]。林坚等[3]发现,相比与其他类型乳腺癌,TNBC发病年龄早、恶性程度高、死亡率高、转移率高、预后差。Zlotnik等[4]研究表明,趋化因子CXCL12及受体CXCR4在肿瘤的侵袭和转移等过程中发挥重要作用。基质金属蛋白酶-2(MMP-2)在包括乳腺癌在内的多种恶性肿瘤中表达,对细胞外基质进行降解,从而参与肿瘤的浸润、侵袭与转移[5-6]。本研究拟探讨CXCR4和MMP-2在三阴乳腺癌浸润与转移中的作用及其相关性,为临床治疗TNBC奠定基础。
1材料与方法
1.1主要试剂TNBC细胞株MDA-MB-231(上海中科院细胞库),L-15培养基(Sober,14300039),胎牛血清(Gibco,10099141),胰蛋白酶(Gibco,25200056),青链霉素(Hyclone,SV30010),二甲基亚(DMSO),RNA逆转录试剂盒(Thermo公司),凯基全蛋白提取试剂盒(南京凯基公司),凯基BCA蛋白含量检测试剂盒(南京凯基)。目的抗体均购自Abcam公司,一抗包括CXCR4(abcam,ab2074,1/1 000)、MMP2(abcam,ab51125, 1/1 000)、内参抗体(abcam,ab8227,1/1 000)。二抗为碱性磷酸酶标记人抗兔IgG(购自中杉金桥),蛋白显色剂购自invitrogen,PVDF膜购于Thermo公司,过表达质粒购自欧易生物公司,CXCR4-SiRNA购自吉玛基因公司,Lip2000转染试剂盒购置Thermo公司。
1.2主要仪器CO2培养箱(Thermo),荧光倒置显微镜(Thermo),冷冻超速离心机(Bio-Rad公司),全波长酶标仪(美国Bio-tek公司),Western blot及转膜设备(Bio-Rad公司),凝胶成像仪(Bio-Rad公司),PCR仪(Bio-Rad公司)。
1.3方法
1.3.1pcDNA3.1 CXCR4和SiRNA-CXCR4分别转染乳腺癌细胞株MDA-MB-231将MDA-MB-231置于10%FBS、1%青链霉素的L-15完全培养基中培养至对数生长期。取对数生长期细胞计数后,按每孔2×106铺入6孔板中,于37℃、5%CO2细胞培养箱中培养至细胞密度达90%~95%时,完全培养基换成无FBS的L-15培养基,细胞饥饿4 h后,用lip2000进行转染。转染6 h后换成含10%胎牛血清的完全培养基,在荧光倒置显微镜下观察转染效率。本研究共分为空白转染组、无关转染组、目的转染组。
1.3.2qRT-PCR 检测三阴乳腺癌细胞株中CXCR4和MMP-2的mRNA的表达变化转染48 h后,消化离心后收集各组细胞,分别提取总RNA,参照RNA逆转录试剂盒合成cDNA。引物序列如下:CXCR4-F:5′- GGCCCTAGCTTTCTTCCACT-3′,CXCR4-R: 5′-GAGAGGATCTTGAGGCTGGA-3′,产物大小为126 bp。MMP-2-F:5′-ACCTGGATG-CCGTCGTGGAC-3′, MMP2-R:5′-TGTGGCAGCACCAGGGCAAC-3′,产物大小为140 bp。反应体系为20 μL,包括cDNA 2 μL、F 1 μL、R 1 μL、water 6 μL、MIX 10 μL。反应条件按照说明书设置。获取各组标准曲线,计算Ct 值。
1.3.3Western blot 检测CXCR4和MMP-2的蛋白变化转染72 h后,收集3组细胞,分别提取总蛋白,蛋白浓度定量后,按3∶1的比例混匀提取蛋白和4X上样缓冲液,置于PCR仪中100℃变性10 min。每孔蛋白上样量为100 μg。制备10%SDS-PAGE进行电泳。将电泳分离条带转至PVDF膜上,时间为75 min。PBS-Tween20洗膜3次,每次5 min,蒸馏水洗膜5 min后,分别加入一抗(CXCR4、MMP2浓度分别为1∶1 000和1∶1 000)、内参抗体b-actin(浓度1∶1 000),于4℃下孵育过夜;加入人抗兔二抗(浓度1∶1 000),室温孵育90 min,PBS-Tween20洗膜3次,每次5 min,蒸馏水洗膜5 min。加入显色剂显色,待出现条带时在凝胶成像仪上成像并进行灰度分析。
1.4统计学处理采用SPSS17.0软件进行统计学分析,组间采用单因素方差分析(ANOV),P<0.05表示差异具统计学意义。
2结果
2.1qRT-PCR检测质粒转染后CXCR4 的mRNA表达变化与空白转染组和无关转染组比较,目的转染组CXCR4 的mRNA表达水平增高,差异有统计学意义(P<0.05)(图1),可见质粒成功转染了MDA-MB-231。
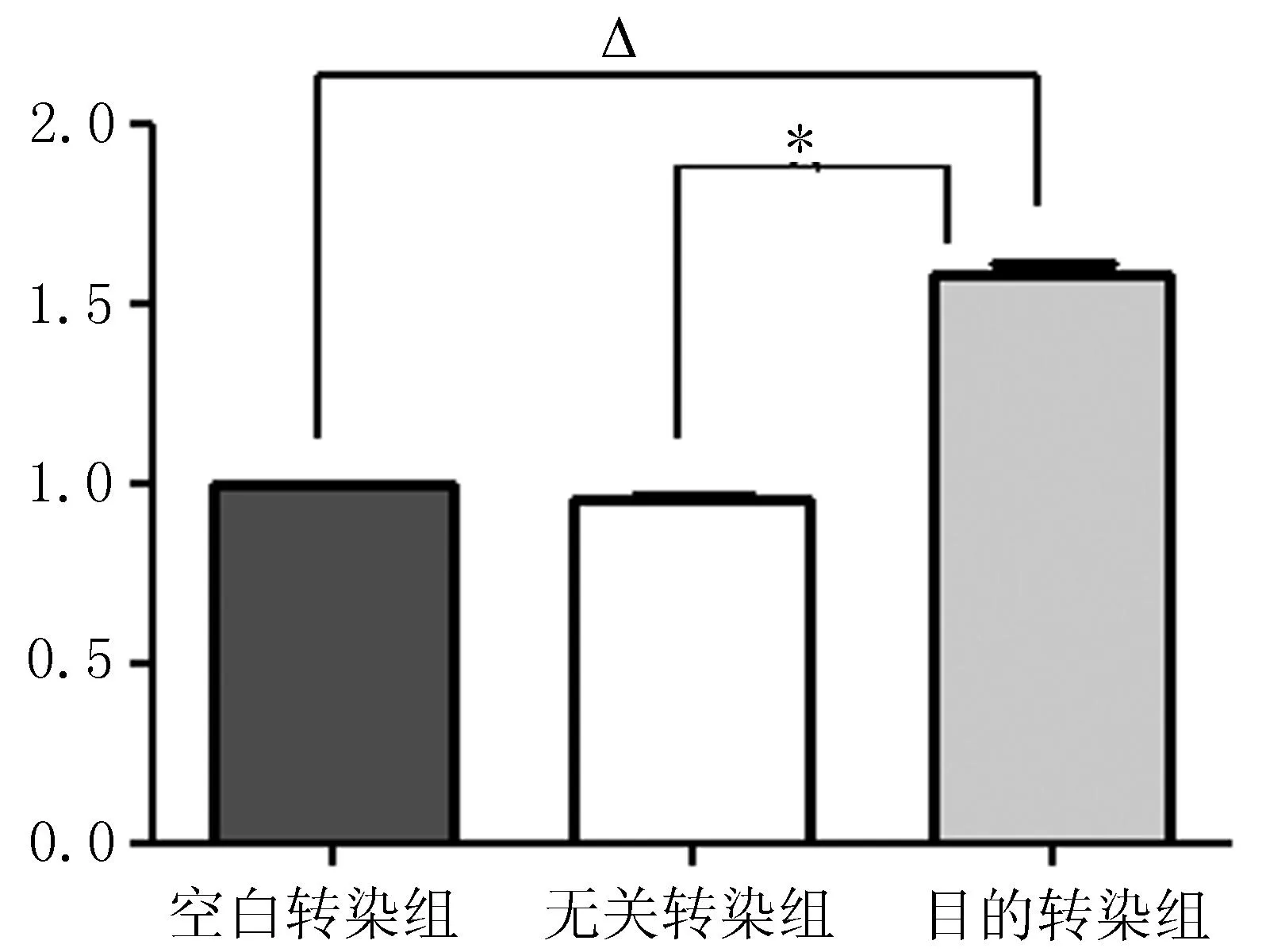
注: 与空白转染组相比,△P<0.05, 与无关转染组相比,*P<0.05。
图1转染质粒后MDA-MB-231的CXCR4的mRNA表达
2.2qRT-PCR检测质粒转染后MMP2的mRNA表达变化与空白转染组和无关转染组比较,目的转染组 MMP2的 mRNA表达水平增高,差异有统计学意义(P<0.05)(图2)。
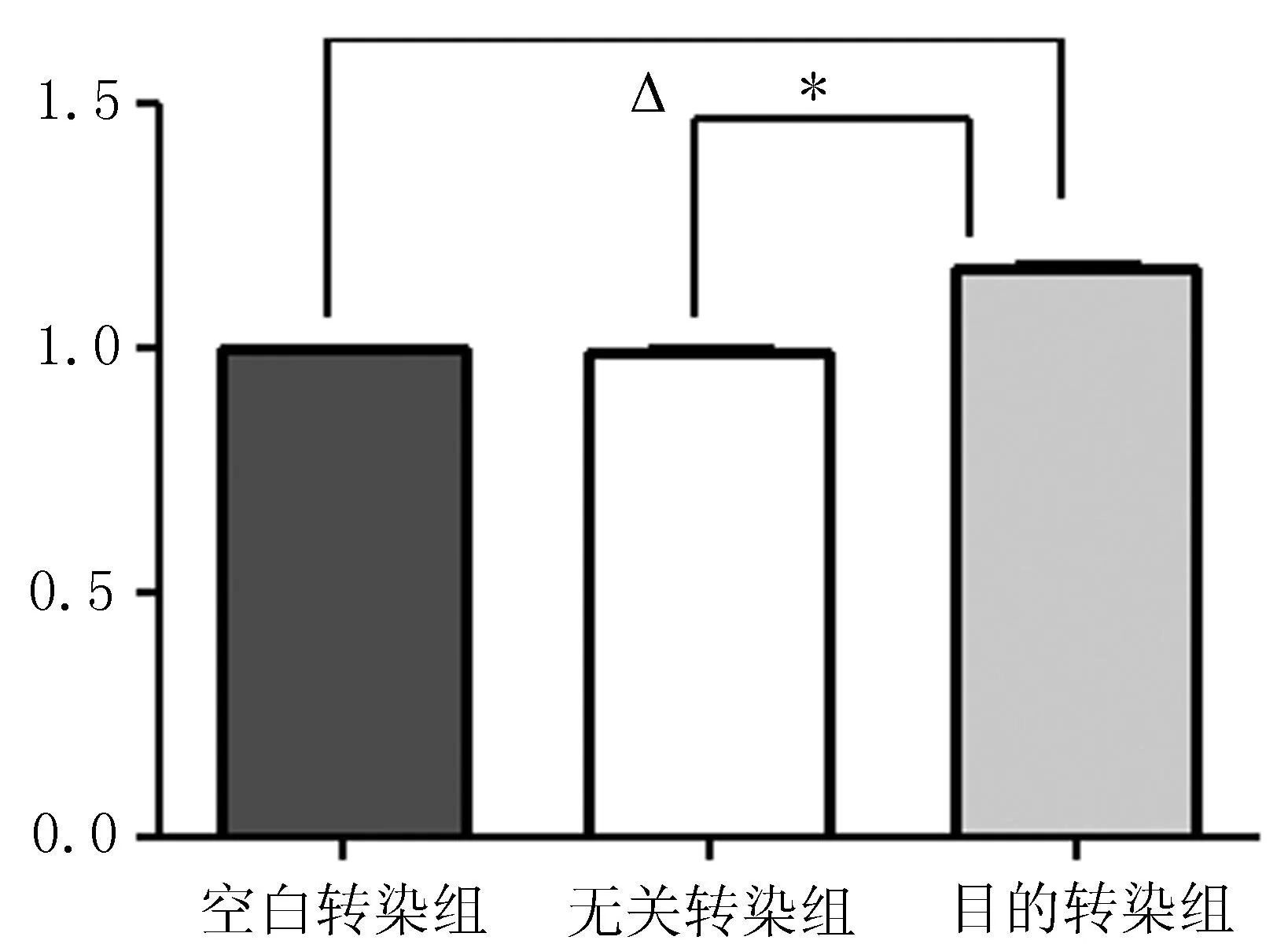
注: 与空白转染组相比,△P<0.05, 与无关转染组相比,*P<0.05。
图2转染质粒后MDA-MB-231的MMP2的mRNA表达
2.3Western blot检测质粒转染后CXCR4的蛋白表达变化与空白转染组和无关转染组比较,目的转染组CXCR4蛋白表达水平增高,差异有统计学意义(P<0.05)(图3),与相应的qRT-PCR结果相一致。

图3 转染质粒后MDA-MB-231中CXCR4蛋白的表达
2.4Western blot检测质粒转染后MMP2的蛋白表达变化相比于空白转染组和无关转染组,目的转染组MMP2蛋白表达水平增高,差异有统计学意义(P<0.05)(图4),与相应的qRT-PCR结果一致。

图4 转染质粒后MDA-MB-231中MMP2蛋白的表达
2.5qRT-PCR检测siRNA沉默后CXCR4 mRNA的表达变化与空白转染组和无关转染组比较,目的转染组 CXCR4 mRNA表达水平下降,差异有统计学意义(P<0.05)(图5),可见siRNA可以成功转染MDA-MB-231。
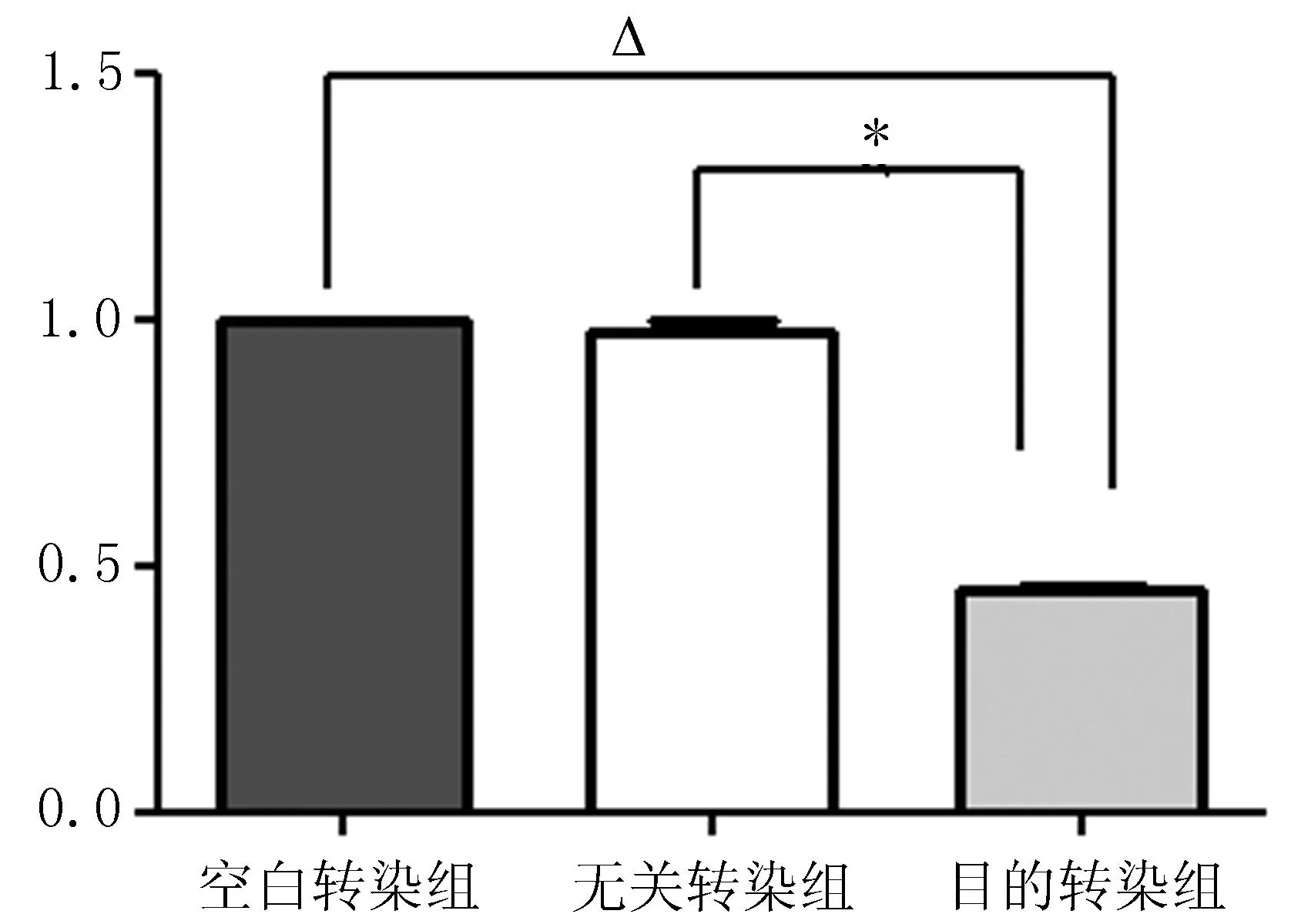
注: 与空白转染组相比,△P<0.05, 与无关转染组相比,*P<0.05。
图5转染SiRNA后MDA-MB-231的CXCR4的mRNA表达
2.6qRT-PCR检测siRNA沉默后MMP2 mRNA的表达变化与空白转染组和无关转染组比较,目的转染组MMP2 mRNA表达水平下降,差异有统计学意义(P<0.05)(图6)。
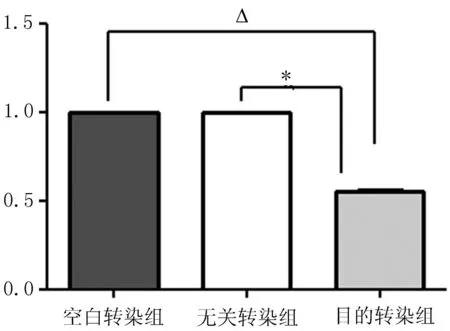
注: 与空白转染组相比,△P<0.05, 与无关转染组相比,*P<0.05。
图6转染SiRNA后MDA-MB-231的MMP2的mRNA表达
2.7Western blot检测siRNA沉默后CXCR4的蛋白表达变化与空白转染组和无关转染组比较,目的转染组CXCR4蛋白表达水平下降,差异有统计学意义(P<0.05)(图7),与相应的RT-PCR结果一致。
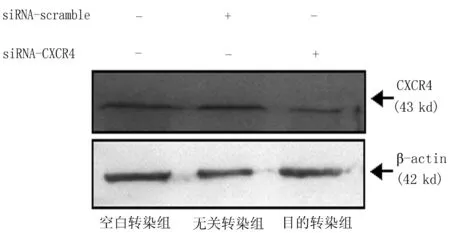
图7 转染siRNA后MDA-MB-231中CXCR4蛋白的表达
2.8Western blot检测siRNA沉默后MMP2的蛋白表达变化与空白转染组和无关转染组比较,目的转染组MMP2蛋白表达水平下降,差异有统计学意义(P<0.05)(图8),与相应的qRT-PCR结果相一致。
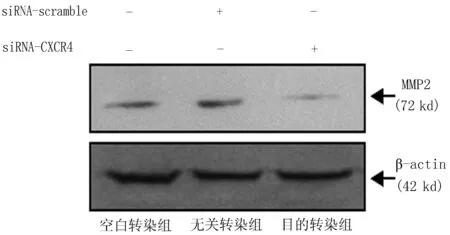
图8 转染siRNA后MDA-MB-231中MMP2蛋白的表达
3讨论
肿瘤的侵袭和转移是常见的致死原因,发生机制相当复杂,相关的分子学机制尚未明确,常涉及细胞外基质(extracellular matrix, ECM)的降解和胞间黏附性的改变。ECM是存在于胞间的动态网状结构[7],由多种成分组成,其主要成分有胶原、蛋白聚糖及糖蛋白等。作为肿瘤细胞浸润扩散的天然屏障,ECM构成细胞生活的微环境。细胞转移的首要环节是ECM的破坏,其降解可加速肿瘤的侵袭与转移。基质金属蛋白酶是锌离子依赖的高度保守的内肽酶,几乎能降解ECM和基底膜的所有蛋白[8]。MMP2(又称明胶酶A或IV型胶原酶)是金属基质蛋白酶中明胶酶的一亚型,可以对细胞外基质和基底膜中的主要成分进行降解,将细胞侵袭和转移的物理屏障破坏,从而进一步促进肿瘤的浸润、侵袭与转移[5,9]。国内外研究表明,MMP2与乳腺癌、卵巢癌、肺癌等的发生及发展密切相关[10-11],且在包括乳腺癌在内的多种肿瘤中过表达,与多种恶性肿瘤的浸润与转移有关[9]。
趋化因子受体CXCR4是趋化因子CXCL12(又称基质细胞衍生因子,SDF-1)的同源性受体,主要分布于淋巴组织、脑、胸腺、脾脏等,其在发育、血细胞的生成、器官发生、血管生成中发挥重要作用。近年来大量研究表明,CXCL12-CXCR4所组成的生物轴在肿瘤的发生、发展、浸润、侵袭及转移中的作用受到广泛的关注[12]。肿瘤转移过程是一个严密、非随机的、器官选择性的过程。大量研究表明,CXCL12与其同源性受体CXCR4在这个过程中发挥至关重要的作用[13-14]。
研究发现,食管鳞癌、胃癌和肾透明细胞癌等恶性肿瘤中,CXCR4在SDF-1的激活下可促进细胞分泌更多的MMP[15-16],降解ECM,促进癌的侵袭与转移。研究表明,在胰腺癌中,CXCL12-CXCR4生物轴可通过上调/激活MMP2的表达促进胰腺癌的浸润[17-18]。Manik等[19]研究发现,在肺泡上皮细胞中抑制CXCR4的表达可降低MMP2的表达水平。本研究结果显示,有效沉默CXCR4后,目的转染组CXCR4及MMP2的蛋白和mRNA的水平明显低于空白转染组和无关转染组,差异有统计学意义(P<0.05),表明抑制CXCR4的表达可以降低MMP2的表达,与Manik等[19]的研究结果相一致;有效提高CXCR4的表达后,CXCR4及MMP2的蛋白和mRNA的水平明显高于空白转染组和无关转染组,差异有统计学意义(P<0.05),说明提高CXCR4表达,可以相应提高MMP2的表达。表明MMP2在TNBC中的表达与CXCR4的表达呈正相关,本研究推测CXCR4可能通过调节MMP2的表达,共同促进TNBC的浸润、侵袭与转移。
本研究通过检测转染前后CXCR4和MMP-2的蛋白及mRNA的表达变化,初步阐明了MMP-2和CXCR4在TNBC的浸润、侵袭与转移中发挥重要的作用,但CXCR4调节MMP2的具体机制有待于进一步实验研究。
参考文献:
[1]Bauer KR, Brown M, Cress RD,et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype:a population-based study from the California Cancer Registry[J]. Cancer,2007,109(9):1721-1728.
[2]Rakha EA,Ellis IO.Triple-negative/basal-like breast cancer:review[J].Pathology,2009,41(1):40.
[3]林坚,胡梅齐,彭炜,等.三阴乳腺癌的临床病理特征及预后[J].中国癌症杂志,2010,20(6):462-465.
[4]Zlotnik A, Burkhardt AM, Homey B, et al. Homeostatic chemokine receptors and organ-specific metastasis[J]. Nat Rev Immunol, 2011, 11(9):597-606.
[5]Jedryka M, Chrobak A, Chelmonsk A,et al. Matrix metalloproteinase MMP-2 and MMP-9 expression in tumor infiltrating CD3 lymphocytes from women with endometrial cancer[J]. Int J Cynecol Cancer, 2012, 22(8):1303-1309.
[6]Pratheeshkumar P, Kuttan G. Nomilin inhibits tumor specific angiogenesis by downregulating VEGF, NO and proinflamatory cytokine profile and also by inhibiting the activation of MMP-2 and MMP-9[J]. Eur J Pharmacol, 2011, 668(3):450-458.
[7]Wieczorek E, Reszka E, Jablonowski Z, et al. Genetic polymorphisms in matrix metalloproteinases (MMPs) and tissues inhibitors of MPs(TIMPs), and bladder cancer susceptibility[J]. BJU Int,2013,112(8):1207-1214.
[8]晋龙,眭玉霞,李燕辉.MMP9、Bcl-2、VEGF在肾细胞癌中的表达及意义[J].现代泌尿外科杂志,2010,115(3):165-167.
[9]Bauvois B. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers:outside-in signaling and relationship to tumor progression[J]. Biochem Biophy Acta, 2012, 1825(1):29-36.
[10]Langers AM, Verspaget HW, Hawinkets LJ, et al.MMP2 and MMP9 in normal mucosa are independently associated with outcome of colorectal cancer patients[J].Br J Cancer, 2012, 106(9):1495-1498.
[11]苏书娟,刑鲁奇,陈登庭,等.MMP2、MMP9和col IV在乳腺导管癌中的表达及其相关性[J].中国肿瘤外科杂志,2010,2(4):201-206.
[12]Hemandez L ,Magalhaes MA ,Conidio SJ ,et al. Opposing roles of CXCR4 and CXCR7 in breast cancer metastasis[J].Breast Cancer Res,2011,13(6):128-144.
[13]Mc Iver SC, Loveland KL, Roman SD, et al. The chemokine CXCL12 and its receptor CXCR4 are implicated in human seminoma metastasis[J]. Andrology, 2013,1(3):517-29.
[14]Xiaowei C, Jia M, Xiaowei W, et al. Overexpression of CXCL12 chemokine up-regulates connexin and integrin expression in mesenchymal stem cells through PI3K/AKT pathway[J]. Cell Commun Adhes,2013,20(3):67-72.
[15]陈友权,于燕妮. 胃癌中SDF-1、CXCR4、MMP-2和 MMP-9的表达及意义.[J]. 临床与实验病理学杂志,2012,22(8):135-139.
[16]李文贤,林晓杰,于磊,等. 肾透明细胞癌中和表达增强[J].基础医学与临床,2014,34(4):499-503.
[17]Durlik M, Gardian K. Metalloproteinase 2 and 9 activity in the development of pancreatic cancer[J].Pol Przegl Chir,2012,84(8):377-382.
[18]Wang H, Rana S, Giese N, et al. Tspan8, CD44v6 and alpha6beta4 are biomarkers of migrating pancreatic cancer-initiating cells[J]. Int J Cancer, 2013,133(2):416-26.
[19]Manik C, Patrudu S, Gorantla V, et al. CXCR4 regulates migration of lung alveolar epithelial cells through activation of Rac1 and matrix metalloproteinase-2[J].Am J Physiol Lung Cell Mol Physiol, 2012,302(9):846-856.
(本文编辑张巧莲)
·药学研究·
The correlation of the expressions of CXCR4 and MMPs on human
triple negative breast cancer cell line MDA-MB-231
SONG Yanyan1, GOU Wenbing2, ZHANG Wei3
(1MedicalCollegeofShiheziUniversity,Shihezi832000,China;2XinjiangMedicalUniversity,
Urumqi830011,China;3DepartmentofPathology,theFirstAffiliatedHospital,
XinjiangMedicalUniversity,Urumqi830054,China)
Abstract:ObjectiveTo explore expressions of chemokine receptor (CXCR4) and matrix metalloproteinase (MMP2) on human triple negative breast cancer cell line MDA-MB-231 and discuss their correlation. MethodsTransfected pcDNA3.1 CXCR4 plasmid and siRNA-CXCR4 into human breast cancer cell line MDA-MB-231 respectively and divided into three groups, including blank control group, negative control group and experiment group. Detected mRNAs and protein expression levers of MMP2 and CXCR4 in MDA-MB-231 cell by RT-PCR and western blotting techniques. ResultsCompared to blank control group and negative control group, after transfecting pcDNA3.1 CXCR4 plasmid, the mRNAs and protein expression levers of MMP2 and CXCR4 enhanced (P<0.05); after effective silenting CXCR4, compared with blank control group and negative control group, the mRNAs and protein expression levels of CXCR4 and MMP2 decreased (P<0.05). ConclusionCXCR4 expression can positively regulate the expression of MMP2, which regulates breast cancer cells MDA-MB-231 invasion and metastasis.
Keywords:triple negative breast cancer; CXCR4; MMP2
通信作者:李新霞,女,博士,教授,博士生导师,研究方向:药物质量标准及药物质量控制研究,E-mail:lxx6668@163.com。 阿吉艾克拜尔·艾萨,男(维吾尔族),博士,研究员,博士生导师,研究方向:民族药学研究,E-mail:Haji@ms.xjb.ac.cn。
作者简介:李金芳(1990-),女,在读硕士,研究方向:药物分析。 迪丽阿热姆·尼加提(1990-),女(维吾尔族),在读硕士,研究方向:天然药物化学研究。
基金项目:国家自然科学基金(81260486) 国家自然科学基金(31110103908)
[收稿日期:2015-09-06]
doi:10.3969/j.issn.1009-5551.2016.01.010
中图分类号:R34
文献标识码:A
文章编号:1009-5551(2016)01-0048-05

