THRSP蛋白在人类乳腺癌组织中的表达及临床意义
徐 虓, 王 霞, 刘志英, 阿力比亚提·艾尼, 刘会岭
(新疆医科大学第五附属医院1教学科研办公室,2药剂科,3病理科, 乌鲁木齐 830011;
4新疆医科大学附属肿瘤医院乳腺甲状腺头颈耳鼻喉外科, 乌鲁木齐 830011)
THRSP蛋白在人类乳腺癌组织中的表达及临床意义
徐虓1, 王霞2, 刘志英3, 阿力比亚提·艾尼4, 刘会岭1
(新疆医科大学第五附属医院1教学科研办公室,2药剂科,3病理科, 乌鲁木齐830011;
4新疆医科大学附属肿瘤医院乳腺甲状腺头颈耳鼻喉外科, 乌鲁木齐830011)
摘要:目的探讨人类乳腺癌组织中THRSP蛋白的表达及其临床意义,方法收集新疆医科大学第五附属医院和新疆医科大学附属肿瘤医院经临床证实乳腺癌患者112例石蜡标本,采用SP法检测乳腺癌组织和癌旁组织中THRSP蛋白的表达,调取112例乳腺癌患者临床及病理资料,分析THRSP蛋白表达与患者雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER-2)的表达及基因分型、临床分期、淋巴结转移率、组织学分级之间的关系。结果THRSP蛋白阳性表达主要定位于细胞核,细胞质少量表达。乳腺癌组织中THRSP蛋白阳性表达率为57.14%(64/112),明显高于癌旁正常组织3.57%(4/112),差异有统计学意义(P<0.01);乳腺癌组织中THRSP蛋白异常高表达与组织学分级(χ2=6.021, P<0.05)有关,与年龄、民族、原发肿瘤大小、ER、PR、Her-2状态、淋巴结转移、基因分型、临床分期无关。结论乳腺癌组织中THRSP阳性表达较正常乳腺组织高;乳腺癌组织学分级高者THRSP阳性表达率高;在乳腺癌组织中THRSP阳性表达与乳腺癌分子分型及预后无关。
关键词:乳腺癌;THRSP;临床意义
全球癌症报告最新版中指出预计2015年全球乳腺癌发病人数达231 840人,约占女性恶性肿瘤的29%[1]。乳腺癌的发病人数、发病率、病死率均处于上升趋势,已经成为影响女性健康的第一杀手[2]。临床工作中发现,多数乳腺癌患者合并甲状腺激素异常,部分合并甲状腺癌[3-4]。有研究表明, 在人体中,有15%~20%的乳腺癌组织存在THRSP(Thyroid hormone responsive spot 14 homolog,THRSP)蛋白表达,其编码基因位于染色体11q13上,此处的基因通常在乳腺癌中高量表达[5]。因此,THRSP被认为可能在这类肿瘤中起着控制代谢和生长的作用。目前研究最多的是编码THRSP蛋白的THRSP基因研究,有关THRSP蛋白与人类乳腺癌临床及病理参数的研究还很少。本研究调取新疆医科大学第五附属医院和新疆医科大学附属肿瘤医院经临床证实乳腺癌患者112例临床及病理资料,系统分析乳腺癌组织中THRSP蛋白表达与患者雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(human epidermal growth factor rec- eptor-2,HER-2)表达及基因分型、临床分期、淋巴结转移率、组织学分级之间的相关关系,为进一步研究乳腺癌分子病理学特征及内分泌相关的治疗提供基础研究依据。
1资料和方法
1.1病例选择调取新疆医科大学第五附属医院和新疆医科大学附属肿瘤医院2012年1月-2015年1月经术后病理证实并接受根治性手术治疗的乳腺浸润性导管癌和小叶癌病例112例的临床及病理资料。112乳腺癌患者均为女性,患者中位年龄47岁(22~88岁)。
1.2方法
1.2.1主要试剂THRSP多克隆抗体(Santa Cruz Biotechnology公司),苏木素染色液(上海博谷生物科技有限公司),中性红染液、枸橼酸钠缓冲液、PBS磷酸盐缓冲液、DAB显色液、二甲苯、无水乙醇(上海伊卡生物技术有限公司)。
1.2.2实验步骤常规制备硅胶石蜡病理切片,按照SP法免疫组化试剂盒实验步骤说明进行操作。用试剂公司提供的阳性对照,PBS代替一抗作为阴性对照。结果判定:采用许良中等[6]提出的免疫组织化学反应结果的判断标准,分别由2名资深病理科医师阅片,当结果不一致时通过协商统一判定。
1.3统计学处理采用SPSS17.0统计软件进行统计学分析,计数资料用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1人类乳腺癌组织中THRSP阳性表达情况在细胞核THRSP阳性表达率为90.62%,其中细胞核为71.88%,细胞核、膜同时表达为18.74%,细胞浆中的阳性表达率为4.69%,其中细胞浆为3.13%,细胞浆细胞膜同时表达为1.56%,细胞膜中的阳性表达率为4.69%。
THRSP蛋白在人类乳腺癌组织病理切片中阴性表达(图1);THRSP蛋白在人类乳腺癌组织中阳性表达为棕黄色颗粒,主要位于细胞核(图2); THRSP蛋白在细胞核中的表达见图3; THRSP蛋白在细胞浆中的表达见图4。
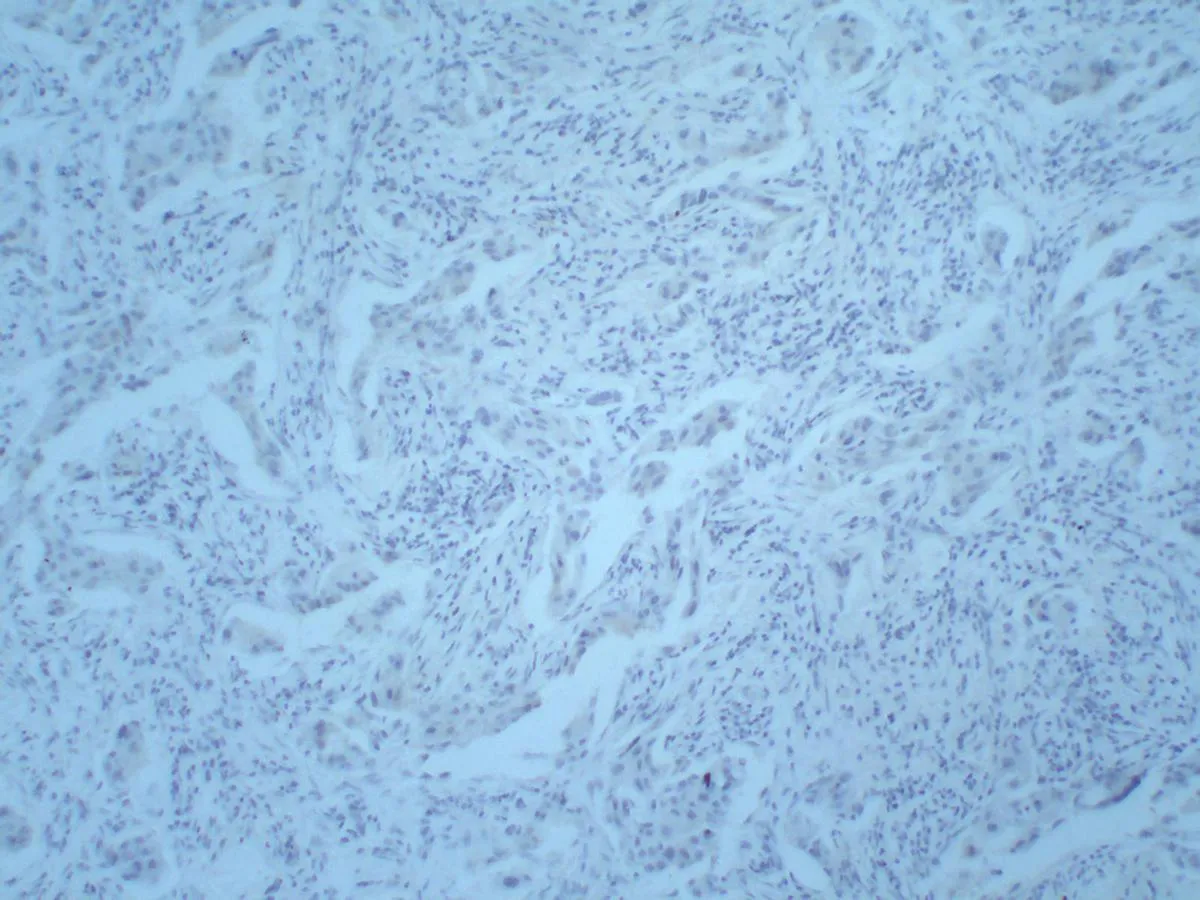
图1THRSP蛋白阴性表达 (×100)
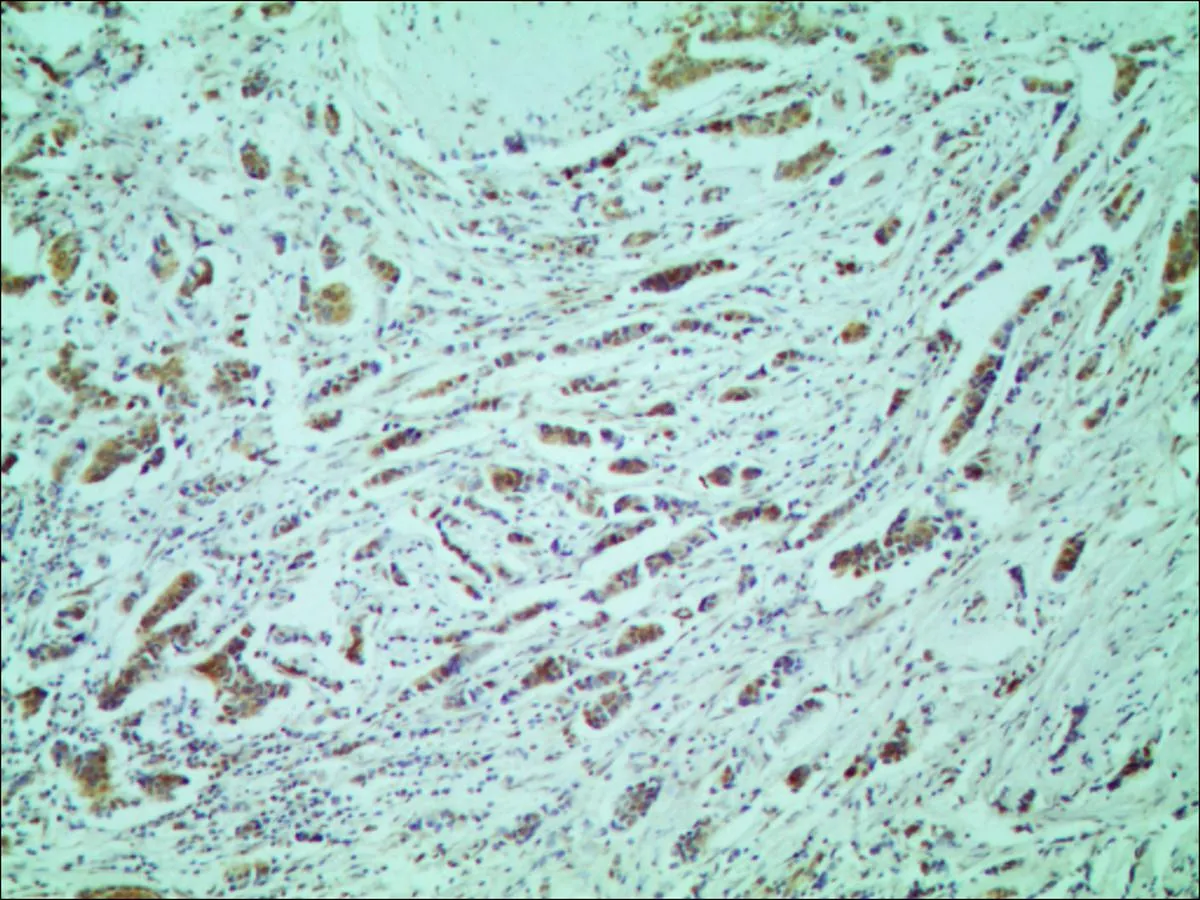
图2THRSP蛋白阳性表达(×100)
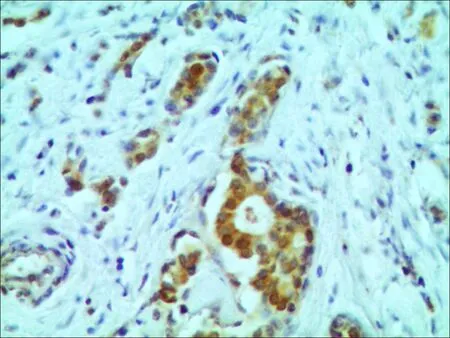
图3THRSP蛋白在胞核中阳性表达 (×400)
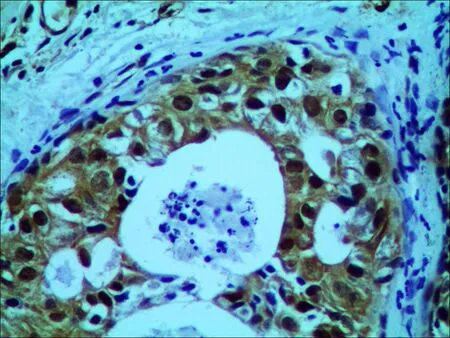
图4THRSP蛋白在胞浆中阳性表达(×400)
2.2人类乳腺癌组织中THRSP蛋白的表达与患者临床病理的关系112例人类乳腺癌组织中THRSP阳性表达率(57.14%,64/112)明显高于癌旁组织(3.57%,4/112),差异有统计学意义(P<0.01)。112例人类乳腺癌组织中,年龄<50岁者49例,其中26例THRSP阳性表达,阳性率为53.06%;年龄≥50岁者63例,其中有38例THRSP阳性表达,阳性率为60.32%(χ2=0.593,P=0.441),差异无统计学意义。
在汉族乳腺癌患者中THRSP蛋白阳性表达(64.70%,22/34)与在维吾尔族患者中的阳性表达(53.85%,42/78)差异无统计学意义(χ2=1.140,P=0.286)。原发灶直径≤2 cm的乳腺癌患者38例,其THRSP蛋白阳性表达率为55.26%(21/38);原发灶直径>2 cm的乳腺癌患者74例,阳性表达率为58.11%(43/74),两者THRSP蛋白阳性表达差异无统计学意义(χ2=0.648,P=0.421)。
肿瘤标记物中,ER阳性组THRSP蛋白阳性表达率为57.65%(49/85),ER阴性组为55.56%(15/27)(χ2=0.037,P=0.848),差异无统计学意义;PR阳性组THRSP蛋白阳性表达率为57.41%(31/54),PR阴性组为56.90%(33/58),差异无统计学意义(χ2=0.003,P=0.956);Her-2阳性组THRSP蛋白阳性表达率为56.00%(28/50),Her-2阴性组为58.06%(36/62),差异无统计学意义(χ2=0.048,P=0.826)。
在淋巴结有转移患者、无转移患者中THRSP蛋白阳性表达率相近,差异无统计学意义(χ2=1.564,P=0.211)。
在LuminalA型乳腺癌中THRSP蛋白阳性表达率为66.67%,LuminalB型乳腺癌中为46.43%,Her-2过表达型中为64.70%,在三阴性乳腺癌患者中为70.83%,差异无统计学意义(χ2=5.414,P=0.144)。
在组织学分级Ⅰ级中THRSP蛋白阳性表达率为33.33%(7/21),Ⅱ级为61.82%(37/55),Ⅲ级为63.89%(23/36),组织学Ⅲ级乳腺癌患者的阳性表达率最高63.89%,其次为组织学Ⅱ级乳腺癌患者,再次为组织学Ⅰ级乳腺癌患者,差异有统计学意义(χ2=6.021,P=0.049)。
Ⅰ+Ⅱ期乳腺癌患者中THRSP蛋白阳性表达率为50.75%(34/67),Ⅲ+Ⅳ期乳腺癌患者中为66.67%(30/45),差异无统计学意义(χ2=2.786,P=0.095)(表1)。
表1乳腺癌组织中THRSP蛋白的表达与患者临床病理的关系/例(%)
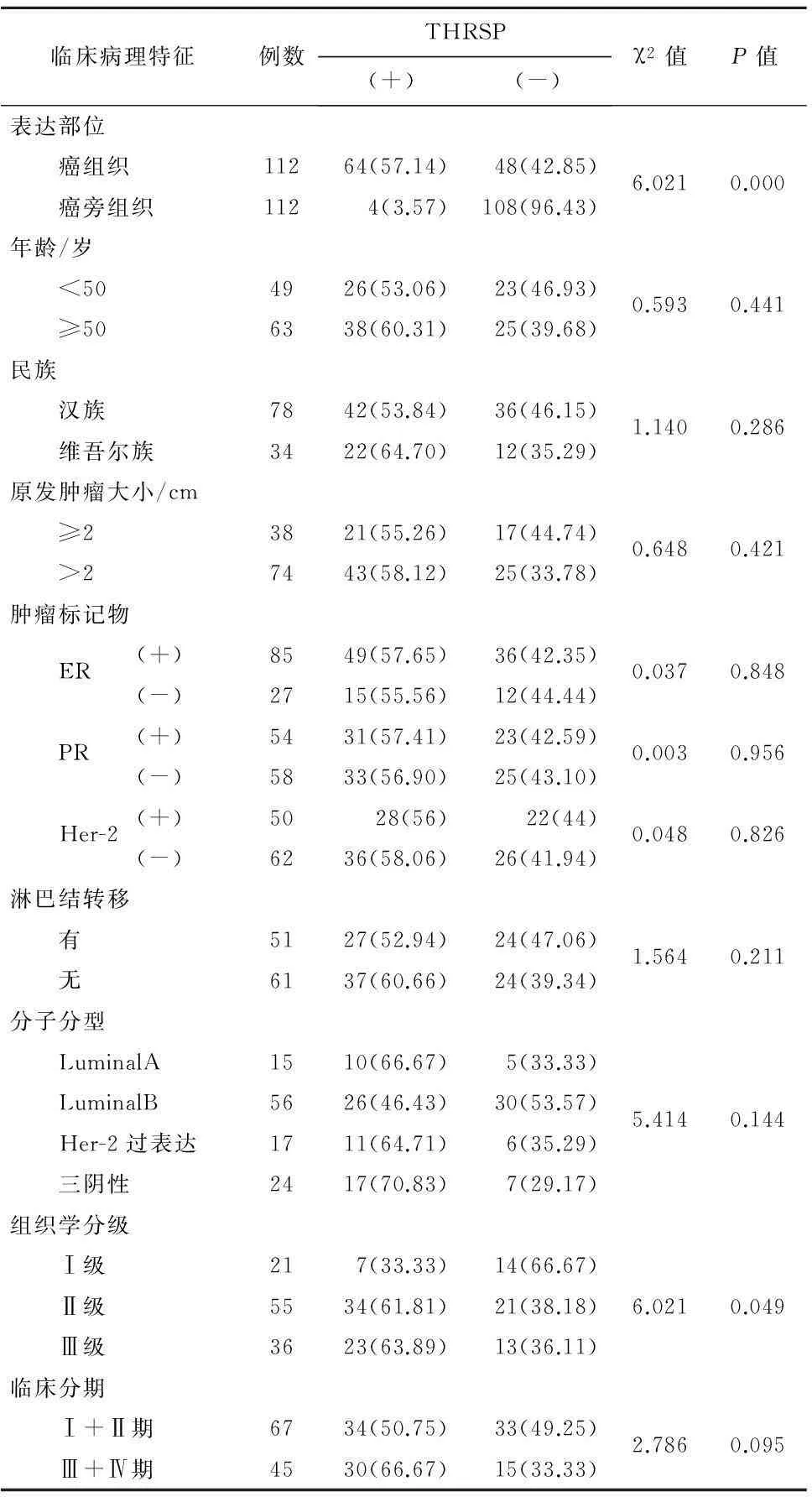
临床病理特征例数THRSP(+)(-)χ2值P值表达部位 癌组织11264(57.14)48(42.85)6.0210.000 癌旁组织1124(3.57)108(96.43)年龄/岁 <504926(53.06)23(46.93)0.5930.441 ≥506338(60.31)25(39.68)民族 汉族7842(53.84)36(46.15)1.1400.286 维吾尔族3422(64.70)12(35.29)原发肿瘤大小/cm ≥23821(55.26)17(44.74)0.6480.421 >27443(58.12)25(33.78)肿瘤标记物 ER(+)8549(57.65)36(42.35)0.0370.848(-)2715(55.56)12(44.44) PR(+)5431(57.41)23(42.59)0.0030.956(-)5833(56.90)25(43.10) Her-2(+)5028(56)22(44)0.0480.826(-)6236(58.06)26(41.94)淋巴结转移 有5127(52.94)24(47.06)1.5640.211 无6137(60.66)24(39.34)分子分型 LuminalA1510(66.67)5(33.33) LuminalB5626(46.43)30(53.57)5.4140.144 Her-2过表达1711(64.71)6(35.29) 三阴性2417(70.83)7(29.17)组织学分级 Ⅰ级217(33.33)14(66.67) Ⅱ级5534(61.81)21(38.18)6.0210.049 Ⅲ级3623(63.89)13(36.11)临床分期 Ⅰ+Ⅱ期6734(50.75)33(49.25)2.7860.095 Ⅲ+Ⅳ期4530(66.67)15(33.33)
3讨论
乳腺癌是一种异质性疾病,不同的分子及机制牵连其发病。信号通路的异常表达在恶性肿瘤的发生及发展过程中起着重要的作用[7]。影响恶性肿瘤不良预后的主要因素是转移,归纳肿瘤本身的分子受体与临床病理参数和预后因素之间的关系是肿瘤个体化治疗的重要方面,认识甲状腺激素相关受体蛋白与肿瘤新陈代谢和增殖转移的相关性对肿瘤个体化治疗及新的治疗理论体系的提出有重要的意义。本研究分析了112例人类乳腺癌组织及癌旁组织中THRSP蛋白的表达情况及其与患者年龄、性别、原发肿瘤大小、ER、PR、Her-2、淋巴结转移、分子分型、组织学分级、临床分期等临床病理参数的关系,分析THRSP与乳腺癌患者不良预后及THRSP在人类乳腺癌组织表达的相关性,进而探讨THRSP在人类乳腺癌发生、发展过程中的作用及机制,为进一步研究乳腺癌分子病理学特征、内分泌相关的通路提供基础研究依据。
3.1THRSP与乳腺癌的关系THRSP最早由Seelig等[8]在研究甲状腺激素的作用时偶然发现,其在调节脂肪酸合成酶基因转录中发挥重要作用[9]。THRSP参与脂质合成,其在调节脂肪酸合酶、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、苹果酸酶、葡萄糖激酶及丙酮酸激酶等脂肪酸合成酶基因转录中发挥重要作用[9]。本研究显示,乳腺癌组织标本中THRSP蛋白的表达明显高于癌旁组织(P<0.05)。其过表达与THRSP基因扩增有关,位置与CCND1 (cyclin D1)基因一样,均位于11q13。CCND1基因是一个明显的下游候选癌基因。许多研究表明其过表达参与乳腺癌的发生与发展[10]。推测CCND1与THRSP基因之间可能存在功能上的相互关系,引起THRSP基因与CCND1基因共表达,从而介导脂质型乳腺癌的发生。
3.2人乳腺癌组织中THRSP蛋白阳性表达率升高及其临床意义目前关于THRSP的研究多集中于家禽类,关于人类乳腺癌的相关研究国内未见有报道,国外研究也少有报道。作为能够对甲状腺激素快速应答的蛋白,对于THRSP是否参与乳腺癌的发生发展,本研究检测了112例人类乳腺癌组织标本及癌旁组织标本中THRSP蛋白的表达情况,结果显示:112例人类乳腺癌组织标本中,THRSP阳性表达64例,阴性表达48例,阳性表达率为57.14%(64/112);相对应于癌旁正常组织中THRSP阳性表达4例,阴性表达108例,阳性表达率为3.57%(4/112),阴性表达率为96.43%(108/112)。结果表明人类乳腺癌组织标本中THRSP蛋白的表达明显高于癌旁正常组织(P<0.05)。推测THRSP可能参与了乳腺癌的发生与发展。有研究表明THRSP表达和脂质合成不仅影响正常乳腺上皮细胞的增殖,也与其异常增生有关[11]。非脂质生成MCF 10A乳腺癌细胞,THRSP和FAS表达非常低;而在脂质合成T47D乳腺癌细胞,THRSP和FAS高表达,同时发现一组伴随THRSP基因过表达的基因,其中包括一些是脂肪细胞所特有,如周脂素(perilipin)、激素敏感脂肪酶(hormone-sensitive lipase)、脂肪细胞脂肪酸结合蛋白4(adipocyte fatty acid binding protein 4)、脂联素(adiponectin)和LPL[11]。THRSP在脂肪合成的人乳腺癌细胞株(T47D)中过表达加速肿瘤细胞生长,其表达缺失会使细胞生长停滞并诱导凋亡[12]。根据本研究结果,结合上述细胞分子水平的研究,说明THRSP基因过表达可能参与了人类乳腺癌的发生与发展过程,THRSP基因参与脂肪酸合成酶基因激活。认为THRSP基因过表达后引起THRSP蛋白表达升高,从而进一步影响乳腺细胞内一系列信号通路的传导,进而导致乳腺癌的发生、发展。对于THRSP基因在乳腺癌发生、发展中的机制尚待进一步研究。
3.3THRSP蛋白过表达部位及与乳腺癌发生、发展的机制关于THRSP蛋白在乳腺癌细胞内表达部位的相关研究[11]多认为其定位于细胞核。有研究表明其在细胞质中也有表达,有研究者通过激光共聚焦显微镜获得其定位[13]。本研究显示112例人类乳腺癌组织标本中,THRSP阳性表达率在细胞核为90.62%(核71.88%+核、膜18.74%),细胞浆为4.69%(浆3.13%+浆、膜1.56%),细胞膜为4.69%。与以往研究者的结果一致。认为THRSP同甲状腺激素受体(TR)一样,在乳腺癌细胞的信号通路全程或各个阶段的不同时刻均有可能参与乳腺癌的发生、发展过程。
THRSP基因扩增被认为是脂质合成表型乳腺癌发生、发展的关键,但具体的作用机制还不明确。Her2/neu基因转染的乳腺细胞cDNA微阵列显示FAS为Her2/neu信号的主要目标[14]。增加Her2/neu阳性细胞中FAS的mRNA的表达,THRSP基因表达亦增加[11]。然而, Hilvo等[15]使用超高效液相色谱/质谱法获取了267例乳腺癌组织的综合脂类组学,并联合免疫组化方法发现FAS与Her2状态间并没有重要联系。孕激素和活性SREBP-1c在乳腺癌细胞中协同诱导S14和FAS[16]。随后,Weels等[13]分析了131例乳腺癌组织中THRSP和FAS表达,发现THRSP高表达不受性类固醇激素受体、Her2/neu或cyclin D1的指定。结合上述基因分子水平的研究,推测CCND1与THRSP基因之间可能存在功能上的相互关系,从而引起THRSP基因与CCND1基因共表达,使得脂质合成明显增加,导致脂质型乳腺癌的发生。由于THRSP与下游大量分子激活有关,具体如何通过分子激活参与乳腺癌进展,有待进一步研究。
3.4THRSP过表达与乳腺癌临床病理参数的关系目前对于THRSP的研究多集中于家禽类,且多处于基因分子水平的阶段。有关THRSP表达与临床病理参数的关系的文献尚未查到。本研究发现乳腺癌组织中THRSP蛋白的异常高表达与组织学分级密切相关(χ2=6.021,P=0.049),而与年龄、民族、原发肿瘤大小、ER、PR、Her-2状态、淋巴结转移、分子分型、临床分期无关。有研究提示增加Her2/neu阳性细胞中FAS的mRNA的表达,THRSP基因表达亦增加[11]。而与本研究中Her2状态存在不一致性,可能与样本量的选择偏倚或混杂因素影响有关,尚需扩大样本验证。
已有研究报道,THRSP高表达标识乳腺癌的高风险,提示预后不良[17]。脂质合成表型乳腺癌细胞的生长和生存取决于脂肪酸的供应。FAS抑制剂可通过减少肿瘤组织中脂肪形成抑制肿瘤生长[18]。乳腺癌中THRSP基因扩增和THRSP蛋白与脂肪生成酶共同过表达提示THRSP可判断乳腺癌恶性脂质合成表型[18]。本研究认为乳腺癌组织中,乳腺癌组织学分级高者THRSP阳性表达率高,但是由于THRSP阳性表达在乳腺癌组织中与乳腺癌分子分型及淋巴结转移、ER、PR、Her-2状态等预后无关,因此认为其不能单独作为评估乳腺癌预后风险的一项指标。鉴于既往研究多处于基因水平,尚无更多文献研究探讨,本课题组将会扩大样本量,进一步验证其在基因水平下的相关作用。
综上所述,推测TH/TRβ1/THRSP有可能与乳腺癌细胞的能量及物质代谢有关,可能影响细胞的有丝分裂过程。TH/TRβ1/THRSP可能影响乳腺癌发生、发展的信号通路,而TRβ1/THRSP有可能是TH/TRβ1/THRSP信号通路的一对开关分子,CCND1则可能是两者信号通路上相互作用的的一个交叉点。目前,THRSP与人类乳腺癌的相关研究甚少,需要大样本及实验室研究进行更进一步的探讨,本研究结果为乳腺癌发生、发展的机制研究提供了一定的基础研究依据以及新的思路。
参考文献:
[1]Rebecca LS, Kimberly DM. Cancer statistics [J]. 2015,Cancer J Clin, 2015, 65(1):25-29.
[2]Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[3]曲建坤, 王焱, 康俊升,等. 乳腺癌患者术后复发及甲状腺多发原发癌1例并文献分析 [J]. 实用医药杂志, 2014, 31(2):119-120.
[4]殷德涛, 唐艺峰, 王勇飞, 等. 甲状腺及乳腺多原发癌的临床分析 [J] .中华内分泌外科杂志, 2014, 8(2):109 -111.
[5]Kuemmerle NB, Kinlaw WB. THRSP (thyroid hormone responsive) [J]. Atlas Genet Cytogenet Oncol Haematol, 2011, 15(6): 480-482.
[6]许良中,杨文涛. 免疫组织化学反应结果的判断标准 [J].中国癌症杂志,1996, 12(6):229-231.
[7]Gerdes MJ, Sood A, Sevinsky C, et al. Emerging understanding of multiscale tumor heterogeneity [J]. Front Oncol, 2014,18(4):364-366.
[8]Seelig S,Liuw C,ToMe HC.Thyroid hormone attenuates and augments hepatic gene expression at pretranslation level[J].Proc Natl Acad Sic USA, 1981, 78(8):4733-4737.
[9]Ortega FJ, Vazquez-Martin A, Moreno-Navarrete JM, et al. Thyroid hormone responsive Spot 14 increases during differentiation of human adipocytes and its expression is down-regulated in obese subjects[J].Int J Obes (Lond), 2010, 34(3):487-499.
[10]Ravikumar, Ananthamurthy A. Cyclin D1 expression in ductal carcinoma of the breast and its correlation with other prognostic parameters [J]. J Cancer Res Ther, 2014, 10(3):671-675.
[11]Kinlaw WB, Quinn JL, Wells WA, et al. Spot 14:A marker of aggressive breast cancer and a potential therapeutic target [J]. Endocrinology, 2006, 147 (9): 4048- 4055.
[12]Martel P, Bingham C, McGraw C, et al.S14 protein in breast cancer cells: direct evidence for regulation by SREBP-1c, superinduction with progestin, and implication in cell growth[J]. Exp Cell Res,2006,312(3):278-288.
[13]Wells W, Schwartz G, Morganelli P, et al. Expression of “Spot 14” (THRSP) predicts disease free survival in invasive breast cancer: immunohistochemical analysis of a new molecular marker[J]. Breast Cancer Res Treat, 2006, 98(2):231-240.
[14]Kumar-Sinha C, Ignatoski K, Lippman M, et al. Transcriptome analysis of Her2 reveals a molecular connection to fatty acid synthesis[J]. Cancer Res, 2003, 63(1):132-139.
[15]Hilvo M, Denkert C, Lehtinen L, et al. Novel theranostic opportunities offered by characterization of altered membrane lipid metabolism in breast cancer progres- sion[J]. Cancer Res, 2011, 71(9):3236-3245.
[16]Alli P, Pinn M, Jaffee E, et al. Fatty acid synthesis inhibitors are chemopreventive for mammary cancer in neu-N transgenic mice[J]. Oncogene, 2005, 24(1):39-46.
[17]Menendez JA, R.Lupu.Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J].Nat Rev Cancer, 2007, 7(10):763-777.
[18]Sanchez-Rodriguez J, Kanininda-Tshilumbu J, Santos A, et al.The spot 14 protein inhibits growth and induces differentiation and cell death of human MCF-7 breast cancer cells[J]. Biochem J, 2005,390(Pt1):57-65.
(本文编辑杨晨晨)
Expression and clinical significance of THRSP protein in human breast carcinoma
XU Xiao1, WANG Xia2, LIU ZHiying3, Alibiyati Aini4, LIU Huiling1
(1DepartmentofTeachingandResearch,Urumqi, 830011,China,2TheDepartmentofPharmacy,
3TheDepartmentofPathology,theFifthAffiliatedHospitalofXinjiangMedicalUniversity,
Urumqi830011,China;4DepartmentofBreast&NeckOncologySurgeryoftheAffiliated
TumourHospitalofXinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo investigate THRSP protein expression in human breast cancer tissues to reveal the molecular pathological characteristics of breast cancer, and to provide the basic research basis for the endocrine related targeted therapy pathway. MethodsRandomly selected paraffin of 112 cases of clinical proved breast cancer patients from the Fifth Affiliated Hospital and the Affiliated Tumor Hospital of Xinjiang Medical University to measure expression of THRSP protein in breast cancer tissues and adjacent tissues by SP (streptavidin-peroxidase) method of immunohistochemical. Retrieved clinical and pathological document of 112 cases of breast cancer patients and analyzed the correlations of THRSP protein expression and ER, PR, HER-2; and their expression, genotype, clinical stage, lymph node metastasis rate, histological grading. ResultsThe positive expression of THRSP protein was mainly localized in the nucleus and little was in cytoplasm. And expression of THRSP in human breast cancer tissues was significantly higher than that in normal breast tissues. The positive expression rate of THRSP protein in breast cancer was significantly higher than that expression in adjacent breast cancer tissues (57.14% vs 3.57%, P<0.01). The abnormal high expression of THRSP protein in breast cancer tissues was closely related to histological grade (P<0.05). There was no correlation to age, nationality, primary tumor size, PR, Her-2, ER status, lymph node metastasis, gene typing and clinical stages (P>0.05). ConclusionThe higher of histological grading in breast cancer, the most THRSP positive expression rate. The positive expression of THRSP in breast cancer was not correlated to the molecular classification and prognosis of breast cancer.
Keywords:breast carcinoma; THRSP; clinical significance
通信作者:于文燕,女,博士,副教授,研究方向:细胞信号转导,E-mail:ywy8085@126.com。
作者简介:周宁(1980-),女,主治医师,研究方向:肿瘤内科治疗。
基金项目:自治区高校科研计划(青年培育项目XJEDU2013S21); 新疆医科大学科研创新基金项目(XJC2012-40)
[收稿日期:2015-08-08]
doi:10.3969/j.issn.1009-5551.2016.01.008
中图分类号:R73-31; R73-37
文献标识码:A
文章编号:1009-5551(2016)01-0037-05

