凋亡大肠癌CT26细胞对小鼠血清免疫因子水平以及免疫细胞增殖、活性的影响▲
孙朝文 张广钰 赵 辰 成怀福 钟 漓 戴 凌
(桂林医学院附属医院胃肠外科,桂林市 541001,E-mail:sunchaowen20081010@163.com)
论著·基础研究
凋亡大肠癌CT26细胞对小鼠血清免疫因子水平以及免疫细胞增殖、活性的影响▲
孙朝文 张广钰 赵 辰 成怀福 钟 漓 戴 凌
(桂林医学院附属医院胃肠外科,桂林市 541001,E-mail:sunchaowen20081010@163.com)
目的 探讨凋亡大肠癌CT26细胞对小鼠血清免疫因子水平以及免疫细胞增殖、活性的影响。方法 取对数生长期大肠癌CT26细胞制备凋亡、坏死肿瘤细胞。取Balb/c小鼠20只,分离T淋巴细胞亚群及自然杀伤(NK)细胞、获取巨噬细胞,并制备细胞毒性T淋巴细胞(CTL)。将小鼠CTL、NK细胞、巨噬细胞分别经相应肿瘤细胞处理后,均分为凋亡肿瘤细胞组、坏死肿瘤细胞组、肿瘤细胞对照组,应用51Cr释放实验测定各组CTL、NK细胞、巨噬细胞的活性,细胞计数(CCK-8)法检测各组CTL、NK细胞和巨噬细胞的增殖情况。另选取Balb/c小鼠分为凋亡肿瘤细胞组、坏死肿瘤细胞组、肿瘤细胞对照组各10只,分别将凋亡、坏死、对数生长期CT26细胞按通过皮下及静脉输注小鼠,采用酶联免疫吸附试验(ELISA)检测各组小鼠血清可溶性Fas(sFas)、γ干扰素(IFN-γ)、白细胞介素(IL)-4、IL-10、IL-12、转化生长因子-β(TGF-β)的表达水平。结果 与坏死肿瘤细胞组及肿瘤细胞对照组比较,凋亡肿瘤细胞组中不同效靶比的CTL、NK细胞及巨噬细胞活性均降低(P<0.05)。CCK-8法检测结果显示,凋亡肿瘤细胞组的CTL、NK细胞及巨噬细胞的A450值均低于坏死肿瘤细胞组、肿瘤细胞对照组(P<0.05)。ELISA检测显示凋亡肿瘤细胞组sFas相对表达量低于坏死肿瘤细胞组和肿瘤细胞对照组(P<0.05)。凋亡肿瘤细胞组IL-4表达水平高于肿瘤细胞对照组(P<0.05),IL-10、TGF-β表达水平则高于其他两组(P<0.05),IL-12表达水平低于其他两组(P<0.05)。结论 凋亡大肠癌CT26细胞能够抑制小鼠特异性CTL、NK细胞、巨噬细胞增殖及其活性,影响大肠癌小鼠正常免疫功能。
大肠癌;CT26细胞;细胞毒性T细胞;自然杀伤细胞;巨噬细胞;可溶性Fas
大肠癌是最为常见的消化道恶性肿瘤之一,其发病率位居全球恶性肿瘤第3位[1]。我国结直肠癌的发病率近年来持续上升,现已分别位居男性恶性肿瘤发病第5位和女性恶性肿瘤发病第3位[2]。过去几十年中,在大肠癌治疗方面上取得巨大进步,且已形成手术治疗加术后辅助化疗的标准方案[3],同时近年来部分指南对不能耐受手术或者术后预期较差的患者,推荐使用西妥昔单抗单一疗法或者联合伊立替康(或铂类)的联合治疗方案[4]。然而结直肠癌仍是全球癌症死因的主要原因之一[5],特别是由于我国居民饮食结构向西方转变、肥胖及缺乏运动等因素,大肠癌的发病率和死亡率进一步上升[6]。目前认为影响大肠癌发生的主要因素是遗传因素和环境因素[7],而大肠癌患者机体的免疫功能改变主要包括调节性T细胞(regulatory T cell,Treg)数量增高、肿瘤应答的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)活性降低及对肿瘤细胞的免疫耐受,机体免疫监视功能的降低与丧失被认为是结直肠癌发生的主要表现。机体发生免疫监视功能的降低与丧失的原因众多,有学者发现凋亡肿瘤细胞也可诱导机体对肿瘤的免疫耐受[8],而近期又有学者提示通过阻断在细胞凋亡中起关键作用的转录活化因子3磷酸化可帮助肿瘤细胞免受机体自身免疫系统的清除[9]。但目前凋亡肿瘤细胞导致机体对肿瘤免疫耐受的机制未明。因此,本研究通过分析凋亡大肠癌CT26细胞对小鼠血清免疫因子水平以及免疫细胞增殖、活性的影响,以探讨凋亡肿瘤细胞与肿瘤免疫耐受的关系及其可能机制。
1 材料和方法
1.1 试验药物 放线菌素D(美国Sigma公司,生产批号:1102C035);6%可溶性淀粉肉汤:在100 ml肉汤培养基[北京海淀中海动物保健科技公司,090216(PT-1)]中加入可溶性淀粉6 g,经煮沸灭菌30 min,置4℃冰箱保存备用。
1.2 实验动物 清洁级6~8周龄Balb/c小鼠50只,雄性,体重(240±30)g,动物许可证号:SCXK(湘)2014-0015,由湖南斯莱克景达实验动物有限公司提供。所有小鼠均按无特定病原体级饲养,且所有实验均通过动物伦理委员会认证。
1.3 细胞株及主要试剂 小鼠结肠癌细胞株CT26.WT(购于中国科学院细胞库)。膜联蛋白V-异硫氰酸荧光素(Annexin V-fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒(美国BD公司,生产批号:20140331)、胰酶(美国Gibco公司,生产批号:1220087)、二甲基亚砜(dimethyl sulfoxide,DMSO;美国Sigma公司,生产批号:141215);酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(武汉伊莱瑞特生物科技有限公司,生产批号:130422)等。
1.4 仪器 CO2培养箱(Thermo Fisher Scientific公司,型号:311),双人超净工作台(苏州净化设备有限公司,型号:BCM-1000),倒置荧光显微镜(日本Olympus,型号:CKX-31);离心机(德国Eppendorf,型号:Centrifuge 5415R);移液枪(芬兰百得公司,型号:Genex,规格:20~200 μl);BL-420生物机能实验系统(成都泰盟科技有限公司,型号:BL-420S)等。
1.5 方法
1.5.1 CT26细胞的培养及凋亡、坏死肿瘤细胞的制备: 将CT26细胞用含10%胎牛血清(美国Gibco公司,生产批号:14000-044)的RPMI-1640培养基(美国Gibco公司,生产批号:120917)培养于5% CO2、37℃饱和湿度培养箱中培养,取对数生长期细胞用于实验。另取对数生长期CT26细胞接种于6孔板中,调整密度为1×106细胞/孔。待细胞贴壁后加入含放线菌素D(200 ng/ml)的培养基培养12 h诱导凋亡,用胰酶消化,收集悬液并依次加入5 μl的Annexin V-FITC和10 μl的碘化丙啶(美国Sigma公司,生产批号:20120811),混匀后室温避光孵育15 min后使用流式细胞仪检测细胞凋亡,富集,按不同浓度稀释备用。另外取对数生长期CT26细胞用加热法(肿瘤细胞株56℃水浴1h)制备坏死肿瘤细胞,显微镜下观察细胞的坏死形态改变并确定,台盼蓝拒染法检测细胞死亡率,按不同浓度稀释备用。
1.5.2 动物分组及CTL细胞、NK细胞及巨噬细胞的制备: 适应性喂养Balb/c小鼠5~6 d后,取6~8周龄雄性Balb/c小鼠20只,采用随机数字表法将其分为单个核细胞制备组及腹腔巨噬细胞制备组,每组10只。单个核细胞制备组的小鼠正常喂养,3 d后脱颈椎处死,取脾脏,去被膜,于200目不锈钢网过滤,800 r/min离心4 min后收集待分离细胞,将细胞悬浮于磷酸缓冲盐溶液(phosphate buffer saline,PBS),采用免疫磁珠分选法分别分离T细胞亚群与自然杀伤(natural killer,NK)细胞,通过流式细胞仪鉴定其表型,分选出的阳性细胞用荧光标记的相应抗体通过荧光激活细胞分离法(fluorescence-activated cell sorting,FACS)鉴定纯度。将T淋巴细胞与凋亡肿瘤细胞按25 ∶1比例混匀,静置于培养箱中共培养,4 d后半量换液,继续培养3 d。第2周起,每周加比例为10 ∶1的凋亡细胞1次,共3次。其中在第2次的第3天加入白细胞介素(interleukin,IL)-2(终浓度20 U/ml),并每隔3~4 d更换1次培养基。在第3次结束后,2 000 r/min离心5~10 min后收集细胞,即特异性CTL,计数、调整至合适浓度。给予腹腔巨噬细胞制备组的小鼠腹腔注射无菌的6% 淀粉肉汤1.0 ml,通过引发腹腔的非感染性炎症而诱导腹腔外巨噬细胞移动并聚集于腹腔。48 h后,被巨噬细胞吞噬的淀粉等微粒已消化殆尽,诱导后巨噬细胞尚属于正常巨噬细胞,并具有活跃的吞噬功能。诱导2~3 d后处死,仰卧固定,常规消毒皮肤,开腹,用毛细吸管收集腹腔液,其中含丰富的巨噬细胞。计数、调整巨噬细胞浓度。
1.5.3 免疫细胞的分组:将不同免疫细胞(CTL、NK细胞、巨噬细胞)分别经相应肿瘤细胞处理后,CTL、NK细胞、巨噬细胞均分为凋亡肿瘤细胞组、坏死肿瘤细胞组、肿瘤细胞对照组3个亚组:(1)凋亡肿瘤细胞组:先将不同的免疫细胞各自与凋亡肿瘤细胞在96孔培养板内共孵育2 h,后以两组不同的效靶比(25 ∶1、50 ∶1)加入靶细胞继续孵育至4 h。(2)坏死肿瘤细胞组:先将不同的免疫细胞各自与坏死肿瘤细胞在96孔培养板内共孵育2 h,后以不同的效靶比(25 ∶1、50 ∶1)加入靶细胞继续孵育至4 h。(3)肿瘤细胞对照组:不同的免疫细胞各自与靶细胞以不同的效靶比(25 ∶1、50 ∶1)在96孔培养板内孵育至4 h。
1.5.4 免疫细胞活性检测:采用51Cr释放实验测定各组的CTL、NK细胞、巨噬细胞活性,其中以相应肿瘤细胞为靶细胞并预先以Na251CrO4标记,免疫细胞为效应细胞。以上各组同时设自然释放对照孔及最大释放对照孔。分别取每组各孔上清,用γ计数仪测量放射活性值(单位:cpm)。免疫细胞活性根据下式计算51Cr自然释放率和免疫细胞活性:
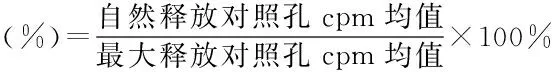
1.5.5 免疫细胞增殖检测:采用细胞计数(cell counting kit-8,CCK-8)法检测鼠的NK、CTL、巨噬细胞增殖。分别将各组CTL、NK细胞、巨噬细胞与对数生长期的CT26细胞按25 ∶1比例混匀铺96孔板,细胞重悬成单细胞悬液,每孔1×103个细胞,100 μl培基,每组3个复孔,96孔板边上一圈的孔不铺细胞,只加PBS用于调零。将培养板静置于37 ℃、5% CO2培养箱内共培养72 h,终止培养前2 h加入每孔加入10 μl的CCK-8试剂(上海碧云天生物技术有限公司,生产批号:20120503),继续将培养板在培养箱内孵育2 h,用酶标仪测定在450 nm处的吸光度(A值),计算细胞增殖活性。
1.5.6 ELISA检测细胞因子表达水平:选取6~8周龄雄性Balb/c小鼠30只,采用随机数字表法将其分为凋亡肿瘤细胞组、坏死肿瘤细胞组、肿瘤坏死对照组各10只,各组通过皮下及静脉注射相应不同状态(凋亡、坏死、对数生长期)的CT26细胞,皮下注射采用1×107/ml密度、0.05 ml的注射量,静脉注射采用1~3 ml的注射量。分别经尾静脉采血约500 μl,待血自然凝固后,5 963 r/min离心10 min,吸取血清分装冻存于-70℃冰箱内,避免反复冻融。采用ELISA严格按照操作说明书进行检测血清可溶性Fas(soluble Fas,sFas)、γ干扰素(interferon-γ,IFN-γ)、IL-4、IL-10、IL-12、转化生长因子-β(transforming growth factor beta,TGF-β)水平。测定标本A450值,以标准品浓度作横坐标,A值作纵坐标,以平滑线连接各标准品的坐标点,通过标本的A值可在标准曲线上查出其浓度。
1.6 统计学分析 应用SPSS 18.0软件进行统计学处理。计量资料以(x±s)表示,比较采用单因素方差分析,两两比较采用LSD-t检验或q检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同状态肿瘤细胞对小鼠体外CTL、NK细胞及巨噬细胞活性的抑制作用 3组的CTL、NK细胞及巨噬细胞51Cr自然释放率比较,差异无统计学意义(P>0.05)。与坏死细胞组及肿瘤细胞对照组比较,凋亡肿瘤细胞组的CTL、NK细胞及巨噬细胞不同效靶比的CTL、NK细胞及巨噬细胞活性均降低(P<0.05)。见表1~3。
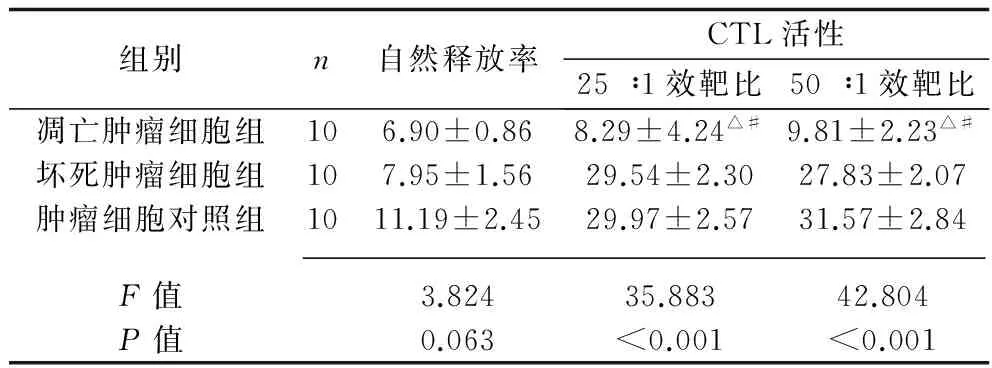
表1 不同状态肿瘤细胞对 小鼠体外CTL活性的影响(x±s,%)
注:与坏死肿瘤细胞组比较,△P<0.05;与肿瘤细胞对照组比较,#P<0.05。
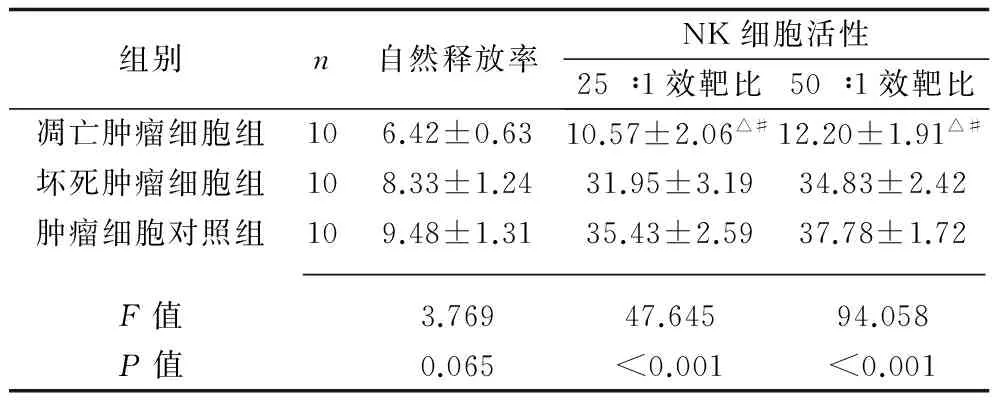
表2 不同状态肿瘤细胞对 小鼠体外NK细胞活性的影响(x±s,%)
注:与坏死肿瘤细胞组比较,△P<0.05;与肿瘤细胞对照组比较,#P<0.05。
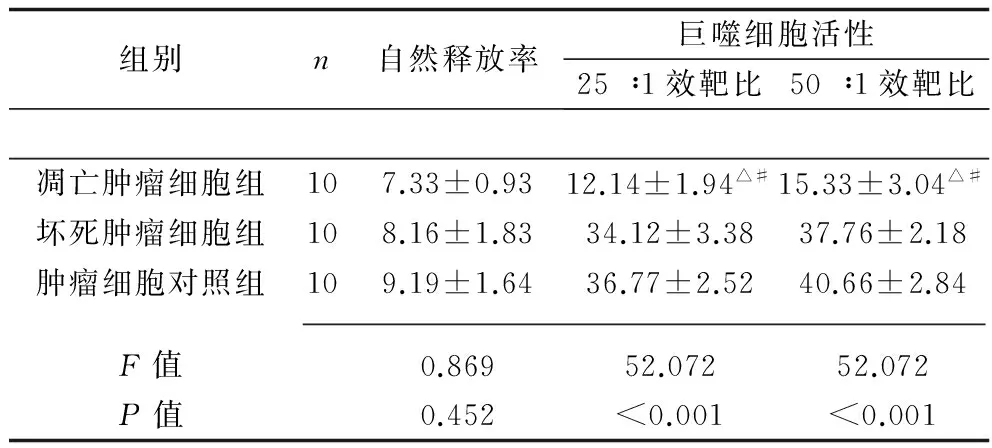
表3 不同状态肿瘤细胞对 小鼠体外巨噬细胞活性的影响(x±s,%)
注:与坏死肿瘤细胞组比较,△P<0.05;与肿瘤细胞对照组比较,#P<0.05。
2.2 不同状态肿瘤细胞对小鼠NK细胞、CD8+T淋巴细胞和巨噬细胞增殖的影响 凋亡肿瘤细胞组的NK细胞、CD8+T淋巴细胞、巨噬细胞的A450值均低于坏死肿瘤细胞组、肿瘤细胞对照组(P<0.05),见表4。
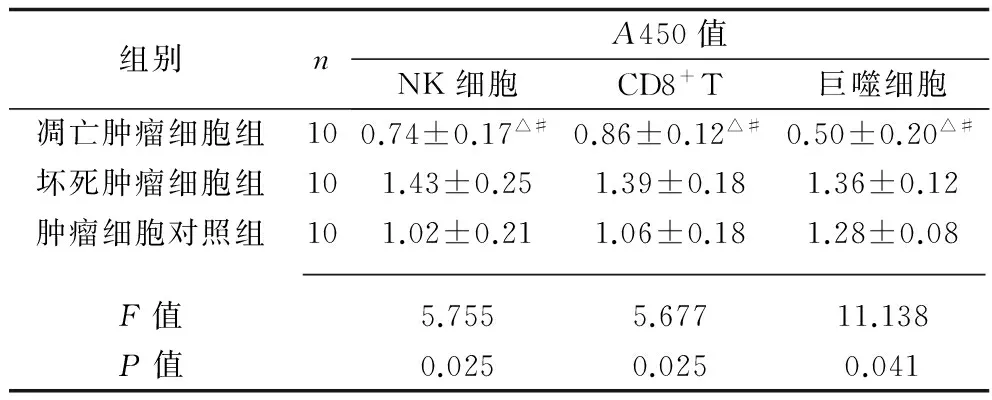
表4 不同状态肿瘤细胞对 小鼠免疫细胞增殖活性的影响(x±s)
注:与坏死肿瘤细胞组比较,△P<0.05;与肿瘤细胞对照组比较,#P<0.05。
2.3 不同状态肿瘤细胞对小鼠血清sFas表达以及小鼠血清IL-12、IFN-γ、IL-4、IL-10、TGF-β水平的影响 凋亡肿瘤细胞组sFas相对表达量低于坏死肿瘤细胞组和肿瘤细胞对照组(P<0.05),而坏死肿瘤细胞组的sFas相对表达量则高于正常肿瘤细胞组(P<0.05)。凋亡肿瘤细胞组抗炎因子IL-4表达水平高于肿瘤细胞对照组而小于坏死肿瘤细胞组(P<0.05),抗炎因子IL-10、TGF-β表达水平则高于其他两组(P<0.05),促炎因子IL-12表达水平低于其他两组(P<0.05),IFN-γ表达水平亦低于其他两组,但差异无统计学意义(P>0.05)。见表5。
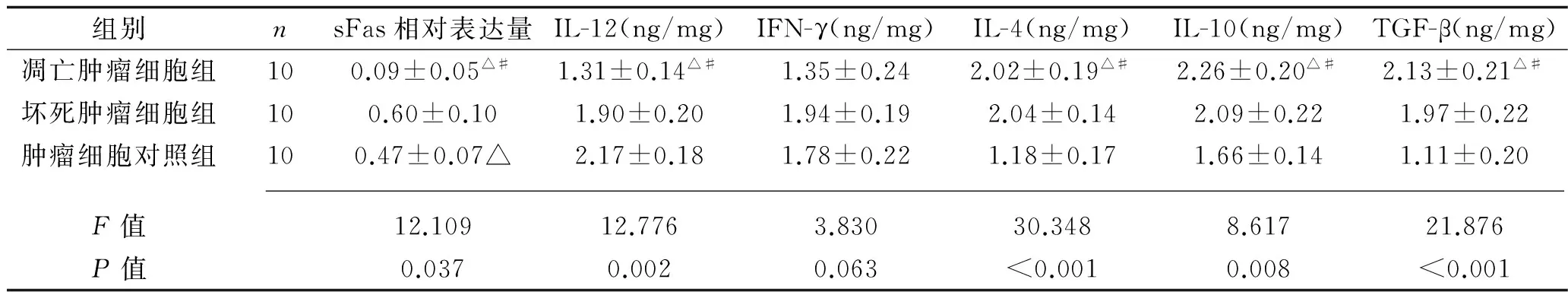
表5 不同状态肿瘤细胞对小鼠血清sFas表达量及IL-12、IFN-γ、IL-4、IL-10、TGF-β含量的影响(x±s)
注:与坏死肿瘤细胞组比较,△P<0.05;与肿瘤细胞对照组比较,#P<0.05。
3 讨 论
近年来,细胞凋亡与机体免疫的关系,特别是细胞凋亡参与免疫系统的调节成为研究热点。Feig等[8]发现凋亡除了与机体免疫系统保持平衡和稳定有密切的关系外,其更是机体主动调节免疫系统的一种重要方式,即凋亡具有免疫调节作用。Ravishankar等[9]发现凋亡细胞可以调节机体先天免疫系统,使得二级淋巴器官的哨兵吞噬细胞减少和免疫抑制通路被阻断,从而达到减轻局部炎症、产生自身耐受的效果,其将凋亡细胞调节的固有免疫抑制与凋亡细胞的免疫耐受形容为“上下文”般的依赖关系。Hassan等[10]则提出,传统意义上认为正常的细胞凋亡可以减少基因层面的肿瘤发生,但往往肿瘤细胞诱导正常的细胞凋亡变异,进而可以导致肿瘤细胞逃脱免疫系统监视。陈建锋等[11]认为细胞死亡的不同方式对机体的免疫应答可能有着不同的影响,如细胞的凋亡可能抑制局部的炎症反应,诱导免疫耐受,而细胞的坏死则启动了适应性免疫反应,加强免疫应答。
本研究分别采用51Cr释放实验、CCK-8方法检测凋亡大肠癌CT26细胞培养的免疫细胞活性及增殖情况,结果显示,与坏死细胞组及肿瘤细胞对照组比较,凋亡肿瘤细胞组中不同效靶比的CTL、NK细胞及巨噬细胞活性及A450值均降低(P<0.05),这提示与凋亡大肠癌CT26细胞培养的免疫细胞活性及增殖受到抑制。因此,可以初步认为不仅是正常细胞凋亡可以抑制机体免疫调节,凋亡的大肠癌CT26细胞也可抑制T淋巴细胞、巨噬细胞、NK细胞的增殖和活性,这意味着凋亡肿瘤细胞也可以像正常细胞凋亡时那样诱导机体发生免疫耐受。多年来一直认为这些凋亡细胞对免疫系统的影响极小,而肿瘤细胞往往会抑制细胞凋亡特别是对肿瘤细胞自身的凋亡刺激[12]。树突状细胞(dendritic cell,DC)通过吞噬负载抗原的凋亡细胞而诱导了免疫耐受,未成熟的DC细胞能递呈凋亡信号至抗原特异性T细胞,从而抑制了T细胞的增殖,这表明在体内凋亡的诱导能导致抗原特异性耐受,很有可能通过DC和Treg介导[13]。凋亡细胞导致免疫耐受已在一些器官移植的实验中得到证实[14-15]。此外,陈建峰等[11]以大鼠心脏移植作为动物模型,将紫外线照射后培养8 h的供者凋亡脾细胞注入受鼠体内,分别在输注后0、3、7、14 d将供鼠心脏移植至受鼠腹腔内,结果提示紫外线能有效诱导大鼠脾细胞凋亡,预输注供者凋亡脾细胞组移植心脏存活期明显延长,而输注相同活细胞或死细胞组则无此效应,表明凋亡细胞能主动抑制受者淋巴细胞活性,延长同种移植物存活时间。Sun[16]将人白血病细胞株K560和HL-60用细胞凋亡诱导剂芬戈莫德和放线菌酮诱导凋亡后,与小鼠脾源性淋巴细共培养,发现其能抑制CD3+小鼠T淋巴细胞的早期活化因子CD69的表达,表明凋亡肿瘤细胞在抑制T细胞的活化、调节T细胞的免疫方面起重要的作用。而我们也发现凋亡大肠癌CT26细胞可抑制T淋巴细胞、巨噬细胞及NK细胞的增殖和活性。这提示当机体固有免疫系统功能受到抑制时,炎性因子的活性受到影响,可能成为诱导机体对肿瘤细胞产生免疫耐受的重要环节。但也有学者报告凋亡细胞对免疫系统有相反的作用,Wang等[17]从C57/B1/6小鼠脾分离的活化T细胞,并用30 Gy的放射线照射以使T细胞凋亡,然后将凋亡T细胞注射同基因小鼠腹腔,结果显示免疫小鼠体内CD8+T细胞和CD62L+T细胞的比例明显增多,对小鼠的肿瘤生长具有抑制作用。
然而,目前仍未完全明确细胞凋亡是如何对机体免疫系统进行精细调节。既往学者认为Fas及其配体可以促进细胞凋亡,但是它们在炎症反应及免疫调节方面的作用尚未明确[18]。而目前的观点认为已凋亡细胞提供了丰富的抗原,从而使机体建立起外周免疫耐受[19]。Dupont等[20]在总结前人的基础上提出,Fas配体之所以在免疫赦免中扮演重要角色,是因为由Fas配体(Fas ligand,FasL)等肿瘤坏死因子家族通过诱导浸润性淋巴细胞凋亡达到抑制免疫应答的目的;其对比经鼠源Fas配体(mouse Fas ligand,mFasL)和可溶性Fas配体(soluble Fas ligand,sFasL)激活的T淋巴细胞和中性粒细胞后发现,在体外暴露于细胞表面的mFasL高度表达于DAP-3小鼠的成纤维细胞并激活T淋巴细胞的凋亡,而sFasL是一种较低效的T淋巴细胞凋亡诱导剂,可是通过分子交联可以大大提升sFasL的效率;同时发现虽然sFasL在激活T淋巴细胞的凋亡方面相当低效,可是却可以强力促进中性粒细胞的趋化。少量的研究表明缺乏sFasL可能导致无法激活中性粒细胞招募[21]。然而目前sFasL诱导中性粒细胞招募现象的机制尚不明确。Lloyd等[22]认为经Fas介导的凋亡可能不是一个被动的过程,而是凋亡细胞主动释放高水平的细胞因子IL-1和IL-10。Miwa等[23]则认为FasL引起中性粒细胞浸润的进一步机制是FasL可以诱导靶细胞产生IL-1β。而目前被广泛接受的机制则是由Chen等[24]提出的,其认为FasL诱导了可以产生激活中性粒细胞增殖作用的蛋白激酶。本研究针对sFas的表达水平及相关免疫因子的水平进行了探讨,结果显示,凋亡肿瘤细胞组sFas相对表达量低于坏死肿瘤细胞组和肿瘤细胞对照组(P<0.05),且凋亡肿瘤细胞组抗炎因子IL-4表达水平高于肿瘤细胞对照组(P<0.05),抗炎因子IL-10、TGF-β表达水平则高于其他两组(P<0.05),促炎因子IL-12表达水平低于其他两组(P<0.05)。这提示相对于正常生长的肿瘤细胞及已经发生死亡的肿瘤细胞,凋亡中或者即将启动凋亡的肿瘤细胞中sFas及相关抗炎免疫因子表达水平上升。这从另一角度反映炎症反应得到抑制,同时也提示即使Fas配体能够抑制细胞凋亡,但在已经发生凋亡的肿瘤细胞中却能发挥抑制T淋巴细胞等免疫细胞的活性甚至低效诱导T淋巴细胞凋亡,在此基础上可能联合产生诱导中性粒细胞趋化,进而达到产生机体免疫耐受。所以当机体固有免疫系统功能受到抑制时,炎性因子的活性受到影响,可能成为诱导机体对肿瘤细胞产生免疫耐受的重要环节。
综上所述,凋亡小鼠大肠癌CT26细胞能够抑制小鼠特异性CTL、NK细胞、巨噬细胞增殖及其活性,影响了大肠癌小鼠正常免疫功能。凋亡大肠癌CT26细胞sFas表达降低影响其自身免疫系统产生的部分炎症因子及其活性,缓解局部炎症反应,进而抑制小鼠免疫系统,产生免疫抑制或免疫耐受。本次实验对于凋亡CT26细胞抑制小鼠特异性CTL、NK细胞、巨噬细胞增殖及其活性的具体机制没有展开具体研究,实验中部分实验结果无统计学意义可能是样本数不足、重复性不够、测量误差等原因引起,应当进一步实验论证。
[1] Siegel R,Desantis C,Jemal A.Colorectal cancer statistics,2014[J].CA Cancer J Clin,2014,64(2):104-117.
[2] Jemal A,Center MM,Desantis C,et al.Global patterns of cancer incidence and mortality rates and trends[J].Cancer Epidemiol Biomarkers Prev,2010,19(8):1 893-1 907.
[3] Binefa G,Rodríguez-Moranta F,Teule A,et al.Colorectal cancer:from prevention to personalized medicine[J].World J Gastroenterol,2014,20(22):6 786-6 808.
[4] Seo JY,Lee CW,Choi DJ,et al.Ginseng marc-derived low-molecular weight oligosaccharide inhibits the growth of skin melanoma cells via activation of RAW264.7 cells[J].Int Immunopharmacol,2015,29(2):344-353.
[5] Fan TF,Bu LL,Wang WM,et al.Tumor growth suppression by inhibiting both autophagy and STAT3 signaling in HNSCC[J].Oncotarget,2015,6(41):43 581-43 593.
[6] Kerr JF,Wyllie AH,Currie AR.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].Br J Cancer,1972,26(4):239-257.
[7] Liu G,Wu C,Wu Y,et al.Phagocytosis of apoptotic cells and immune regulation[J].Scand J Immunol,2006,64(1):1-9.
[8] Feig C,Peter ME.How apoptosis got the immune system in shape[J].Eur J Immunol,2007,37(Suppl 1):S61-S70.
[9] Ravishankar B,McGaha TL.O death where is thy sting? Immunologic tolerance to apoptotic self[J].Cell Mol Life Sci,2013,70(19):3 571-3 589.
[10]Hassan M,Watari H,Abualmaaty A,et al.Apoptosis and molecular targeting therapy in cancer[J].Biomed Res Int,2014(2):150 845-150 845.
[11]陈建锋,高 毅,孙尔维,等.供者凋亡细胞预输注诱导同种器官移植免疫抑制的研究[J].中华实验外科杂志,2003,20(7):608-610.
[12]King KL,Cidlowski JA.Cell cycle regulation and apoptosis[J].Annu Rev Physiol,1998,60:601-617.
[13]Albert ML,Sauter B,Bhardwaj N.Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs[J].Nature,1998,392(6 671):86-89.
[14]Wang Y,Gao Y,Yuan X,et al.The liver mediates apoptotic cell-induced immune regulation[J].Scand J Immunol,2008,68(3):297-305.
[15]Wang Z,Larregina AT,Shufesky WJ,et al.Use of the inhibitory effect of apoptotic cells on dendritic cells for graft survival via T-cell deletion and regulatory T cells[J].Am J Transplant,2006,6(6):1 297-1 311.
[16]Sun E.Cell death recognition model for the immune system[J].Med Hypotheses,2008,70(3):585-596.
[17]Wang L,Du F,Cao Q,et al.Immunization with autologous T cells enhances in vivo anti-tumor immune responses accompanied by up-regulation of GADD45beta[J].Cell Res,2006,16(8):702-712.
[18]郝京生.通过Fas(CD95)下调CD28对T细胞凋亡的影响[J].国际免疫学杂志,2000,23(3):192-193.
[19]Tanaka M,Miyake Y,Asano K.Maintenance of self-tolerance by apoptotic cell clearance[J].Front Biosci,2008,13(5):6 043-6 049.
[20]Dupont PJ,Warrens AN.Fas ligand exerts its pro-inflammatory effects via neutrophil recruitment but not activation[J].Immunology,2007,120(1):133-139.
[21]刘怡萍,毕枚荣,赵 红.细胞因子sFas、IL-6、TNF-α与病毒性心肌炎的预后[J].中华现代儿科学杂志,2005,2(10):97-98.
[22]Lloyd AR,Oppenheim JJ.Poly′s lament:the neglected role of the polymorphonuclear neutrophil in the afferent limb of the immune response[J].Immunol Today,1992,13(5):169-172.
[23]Miwa K,Asano M,Horai R,et al.Caspase 1-independent IL-1beta release and inflammation induced by the apoptosis inducer Fas ligand[J].Nat Med,1998,4(11):1 287-1 292.
[24]Chen JJ,Sun Y,Nabel GJ.Regulation of the proinflammatory effects of Fas ligand(CD95L)[J].Science,1998,282(5 394):1 714-1 717.
Effects of apoptotic colorectal cancer CT26 cells on serum levels of immunological factors,proliferation and activity of immunological cells in mice
SUNChao-wen,ZHANGGuang-yu,ZHAOChen,CHENGHuai-fu,ZHONGLi,DAILing
(DepartmentofGastrointestinalSurgery,AffiliatedHospitalofGuilinMedicalUniversity,Guilin541001,China)
Objective To investigate the effects of apoptotic colorectal cancer CT26 cells on the serum immunological factors levels,the proliferation and activity of immunological cells in mice.Methods Colorectal cancer CT26 cells during logarithmic growth phase were used to prepare the apoptotic and necrotic tumor cells.T lymphocyte subsets and natural killer(NK) cells were isolated and macrophages were obtained from 20 Balb/c mice,and then cytotoxic T lymphocytes(CTL) were prepared.CTL,NK cells and macrophages were divided into apoptotic tumor cell group,necrotic tumor cell group and tumor cell control group after treated with corresponding tumor cells.51Cr release assay was used to detect the activities of CTL,NK cells and macrophages in each group.Cell counting kit-8(CCK-8) assay was used to detect the proliferation of CTL,NK cells and macrophages.Another Balb/c mice were selected and divided into apoptotic tumor cell group,necrotic tumor cell group and tumor cell control group,with 10 rats in each group.Apoptotic CT26 cells,necrotic CT26 cells and CT26 cells during logarithmic growth phase were subcutaneously and intravenously infused into mice in corresponding groups.The enzyme-linked immunosorbent assay(ELISA) was used to detect the expression levels of serum soluble Fas(sFas),interference gamma(IFN-γ),interleukin(IL)-4,IL-10,IL-12 and transforming growth factor-β(TGF-β).Results Compared to the necrotic tumor cell group or the tumor cell control group,the activities of CTL,NK cells and macrophages with different effect-or-target ratios decreased in the apoptotic tumor cell group(P<0.05).The results of CCK-8 assay showed that theA450 values of CTL,NK cells and macrophages in the apoptotic tumor cell group were lower than those in either the necrotic tumor cell group or the tumor cell control group(P<0.05).ELISA assay showed that the relative expression of sFas in the apoptotic tumor cell group was lower than that in either the necrotic tumor cell group or the tumor cell control group(P<0.05).Expression level of IL-4 in the apoptotic tumor cell group was higher than that in the tumor cell control group(P<0.05).Expression levels of IL-10 and TGF-β were higher and expression level of IL-12 was lower in the apoptotic tumor cell group compared to the other two groups(P<0.05).Conclusion Apoptotic colorectal cancer CT26 cells can inhibit the proliferation and activities of specific CTL,NK cells and macrophages in mice,and affect the normal immune function of mice with colorectal cancer. 【Key words】 Colorectal cancer,CT26 cells,Cytotoxic T lymphocyte,Nature killer cell,Macrophages,Soluble Fas
广西自然科学基金(2012GXNSFAA276035);广西桂林市科学研究与技术开发计划(20120121-1-13)
孙朝文(1988~),男,在读硕士研究生,研究方向:消化道恶性肿瘤的诊治,微创外科。
张广钰(1966~), 男,硕士,主任医师,教授,研究方向:消化道恶性肿瘤的诊治,微创外科,E-mail:acrosssky@126.com。
R 735.3
A
0253-4304(2016)10-1337-06
10.11675/j.issn.0253-4304.2016.10.01
2016-05-20
2016-07-22)

