细胞色素氧化酶P450基因多态性对心脏机械瓣膜置换患者术后华法林抗凝剂量的影响▲
马宪鲁 张 申 郑宝石 冯 旭 谢晓勇 黄柳柳
(1 山东省济宁市第一人民医院心外科,济宁市 272011,E-mail:ma.xianlu@163.com;2 广西医科大学第一附属医院心脏外科,南宁市 530021)
论著·临床研究
细胞色素氧化酶P450基因多态性对心脏机械瓣膜置换患者术后华法林抗凝剂量的影响▲
马宪鲁1张 申1郑宝石2冯 旭2谢晓勇2黄柳柳2
(1 山东省济宁市第一人民医院心外科,济宁市 272011,E-mail:ma.xianlu@163.com;2 广西医科大学第一附属医院心脏外科,南宁市 530021)
目的 探讨细胞色素氧化酶P450(CYP2C9)基因多态性对心脏机械瓣膜置换患者术后华法林抗凝剂量的影响。方法 择期行心脏瓣膜置换术的瓣膜性病变患者522例,采用聚合酶链反应-限制性内切酶片段长度多态性技术检测患者CYP2C9基因型,根据CYP2C9基因型进行分组,CYP2C9*1/*1为强代谢(EM)组,含有CYP2C9*2或*3为弱代谢(PM)组,记录患者术后连续6 d华法林用量、凝血酶原时间(PT)值及国际标准化比值(INR),比较两组华法林初始治疗抗凝过量的情况。结果 CYP2C9*1/*1共466例(89.3%);CYP2C9*1/*2共6例(1.15%);CYP2C9*1/*3共42例(8.05%);CYP2C9*2/*3共8例(1.53%),EM组466例,PM组56例。各组不同时间点的华法林用量比较,差异有统计学意义(P<0.05),EM组的华法林用量在术后4 d较首次剂量明显减少,PM组的华法林用量在术后3 d较首次剂量明显减少,术后4、5、6 d持续减少;术后4、5、6 d PM组华法林用量明显低于EM组(P<0.05)。两组不同时间点的PT值及INR比较,差异均有统计学意义(P<0.05),两组PT值及INR于术后2 d开始增高,术后4 d上升到最高水平;术后3、4、5 d PM组的PT值及INR高于EM组(P<0.05)。PM组出现华法林抗凝过量者比例为62.5%,高于EM组的6.0%(P<0.05)。结论 CYP2C9基因多态性检测结合临床检验对心脏机械瓣膜置换术后华法林抗凝剂量的确定具有重要指导意义。
心脏瓣膜置换术;细胞色素氧化酶P450;华法林;基因多态性;抗凝
心脏瓣膜病变常用的外科治疗方法为心脏瓣膜置换术,金属机械瓣为常用的瓣膜材料,为避免术后血栓形成的风险,术后抗凝治疗尤为重要,术后因抗凝不足导致的血栓栓塞和抗凝过度所致的出血是影响患者生存质量甚至死亡的主要原因[1]。华法林是一种香豆素类口服抗凝血药物,临床上广泛用于血栓栓塞性疾病的治疗,如深静脉血栓、心脏瓣膜置换、脑栓塞、肺栓塞、心房纤颤等[2-3]。但华法林安全治疗范围窄,剂量个体差异较大,遗传因素是造成其维持剂量以及个体差异的主要原因[4]。华法林是由S-华法林对映体和R-华法林对映体组成的消旋体,并且具有构象选择性,抗凝作用更强的S-对映体约有85%经由肝脏中肝微粒体的细胞色素氧化酶P450(cytochrome P450 2C9,CYP2C9)代谢降解[5]。CYP2C9具有多种基因型,不同基因型患者使用华法林的效果及安全性具有差异,基因型为CYP2C9*1/*1为野生型纯合子,含有CYP2C9*2、CYP2C9*3是最常见的突变型为杂合子[6],两种突变型酶活性较野生型分别降低了30%和80%[7],术后抗凝服用剂量减少。临床中检测华法林用量的常用指标为凝血酶原时间(prothrombin time,PT)以及国际标准化比值(international normalized ratio,INR)[8]。本文旨在研究CYP2C9基因多态性对临床心脏机械瓣膜置换术患者术后华法林初始使用的影响。
1 资料与方法
1.1 临床资料 选取2014年9月至2016年5月在我院心脏外科择期行心脏机械瓣膜置换术患者,入选标准:瓣膜性病变患者;术前肝功能正常;在我院行金属机械瓣膜置换术;术后24 h开始口服华法林片抗凝治疗。排除标准:年龄<18岁;三尖瓣置换术患者;先天性心脏病患者;A型主动脉夹层患者;升主动脉扩张动脉瘤患者;瓣膜置换合并冠状动脉旁路移植术患者;同期服用能与华法林产生协同或拮抗的药物(如阿司匹林肠溶片、胺碘酮片、苯妥英钠片等)者;女性怀孕者;高血压病患者;近3个月内颅内出血或颅内动脉瘤者;胃肠道出血者;出现重症肺部炎症、低心排综合征、重要脏器衰竭等严重并发症者。共纳入522例患者,男268例、女254例,年龄(43.5±5.8)岁,体质量(54.4±4.7)kg,血压(127.3±6.6)/(62.4±5.5)mmHg;二尖瓣狭窄患者129例,二尖瓣关闭不去患者88例,二尖瓣狭窄并关闭不全患者80例,主动脉瓣狭窄患者95例,主动脉瓣关闭不全患者60例,主动脉瓣狭窄并关闭不全患者35例,二尖瓣合并主动脉瓣病变患者35例。本次研究获得广西医科大学第一附属医院伦理委员会批准,入选患者均签订知情同意书。
1.2 实验材料 华法林(芬兰Orion药厂,规格:3 mg/片,批号:H20110108),总RNA小量制备试剂盒(美国Axygen公司,批号:FAB 2015004),反转录试剂盒(大连宝生物工程有限公司,批号:DRR047A),定量PCR试剂盒(美国Roche公司,批号:4913914001),高速冷冻离心机(德国Eppendorf公司,型号:5810R),定量PCR仪(美国Stratagene公司,型号:MX 3000),JY电泳仪(北京六一仪器厂,型号:JY-ECPT 3000),凝胶成像仪(美国BioRad公司,型号:170-8170),微量紫外分光光度计(美国Thermo Fisher Scientific公司,型号:NanoDrop 2000)。
1.3 研究方法
1.3.1 血液标本采集:患者于术前1 d采集肘正中静脉血4 ml,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝,3 000 r/min离心5 min,分离血浆,吸取中间层白细胞,血浆置入含有RNAstore保存液的冻存管中,放置-60℃冰箱中冻存,用于测定CYP2C9基因型。
1.3.2 CYP2C9基因型检测及分组:提取患者外周血基因组RNA,按照试剂盒步骤进行操作。通过对样品分离、RNA沉淀、RNA清洗后,取5 μl总RNA在2%的琼脂糖凝胶中电泳,电压80 V,电泳20 min,判断总RNA的完整性,见图1。采用聚合酶链反应-限制性内切酶片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)技术检测CYP2C9基因型。从NCBI GenBank数据库(http://www.ncbi.nlm.nih.gov/)中下载人CYP2C9*1、CYP2C9*2和CYP2C9*3基因序列,应用Oligo 6.0引物评估软件,Primer Premier 5.0设计一下引物CYP2C9*1、CYP2C9*2和CYP2C9*3为特异性序列,引物由北京六合华大基因科技股份有限公司合成。引物系列如下:CYP2C9*1:上游5′-GTGAATGACACACACAAACTAACAG-3′,下游5′-TCACACCCTATTCACACATTCCTTC-3′;CYP2C9*2:上游5′-TAACAGAGGATTTGGTAGGTG-3′,下游5′-AGTTCAGGAGAACATGGGAT-3′;CYP2C9*3:上游5′-CCAGGTCAGTAACAGGTCAG-3′,下游5′-ATGGAGTTGCAGTGTAGGAG-3′。依照试剂盒指示建立反应体系,反应条件:95℃预变性10 min,95℃变性15 s,60℃退火30 s,72℃延伸15 s共40个循环。反应结束后,按仪器默认条件收集荧光,把离心管迅速放入PCR扩增仪,按扩增程序进行PCR扩增,扩增完成后收集熔解曲线,见图2。根据CYP2C9基因型进行分组,基因型为*1/*1野生型纯合子为强代谢(extensive metabolizer,EM)组;基因型为含有*2或*3的突变型为弱代谢(poor metabolizer,PM)组。
图1 CYP2C9*1、CYP2C9*2和*3 PCR产物电泳图
注:标志物分别为100、200、300、400、500、600、800、1 000、1 500 bp;“1”代表CYP2C9*1酶切产物,“2”代表CYP2C9*2酶切产物,“3”代表CYP2C9*3酶切产物,“4”代表标记位点,“5”代表产物阳性对照。
图2 CYP2C9*1、CYP2C9*2和*3基因扩增曲线与溶解曲线
注:A1 为CYP2C9*1基因扩增曲线;A2为CYP2C9*1基因熔解曲线;B1为CYP2C9*2基因扩增曲线;B2为CYP2C9*2基因熔解曲线;C1 为CYP2C9*3基因扩增曲线;C2为CYP2C9*3基因熔解曲线。
1.3.3 PT值、INR值测定及术后华法林治疗:(1)PT值测定结果由广西医科大学第一附属医院检验科生化室提供,应用美国Pacific Hemostasis公司生产凝血质控品、美国Instrument Laboratory公司生产PT检测试剂及美国Instrument Laboratory公司生产ACL 9000全自动凝血分析仪、采用Quick湿化学法[9]监测PT值。根据公式INR=(PTtest/PTnormal)ISI得出INR值[10]。(2)患者入院时即检测PT值与INR值,以术后24 h开始口服华法林为第1天,给予的华法林剂量为首次剂量,连续监测6 d。根据中华医学会制定的华法林抗凝指南[11],由于心脏机械瓣膜置换术患者术后PT值超出40 s、INR超出4出血并发症发生率高,因此本次研究将PT值≥40 s以及INR≥4.0作为抗凝过量。依据每日的PT值与INR调整华法林用量,记录患者术后口服华法林首次剂量以及连续6 d的剂量。
1.4 统计学分析 采用SPSS 17.0软件进行统计学分析。Pearson χ2检验用于检查基因型频率是否符合Hardy-Weinberg遗传平衡定律[12];计数资料采用χ2检验或Fisher精确检验;计量资料以(x±s)表示,重复测量的资料采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 CYP2C9基因检测结果及分组 采用PCR-RFLP检测技术检测基因型:CYP2C9*1/*1共466例(89.3%),CYP2C9*1/*2共6例(1.15%),CYP2C9*1/*3共42例(8.05%),CYP2C9*2/*3共8例(1.53%),未发现*2和*3的纯合体。经Hardy-Weinberg平衡检验,该人群符合群体基因遗传平衡(P>0.05)。根据CYP2C9基因型进行分组:无基因突变的*1/*1基因型为EM组,共466例,携带*2或*3杂合等位基因的为PM组共56例。两组患者在年龄、性别、体质量以及瓣膜置换手术类型比较,差异无统计学意义(P>0.05)。见表1。
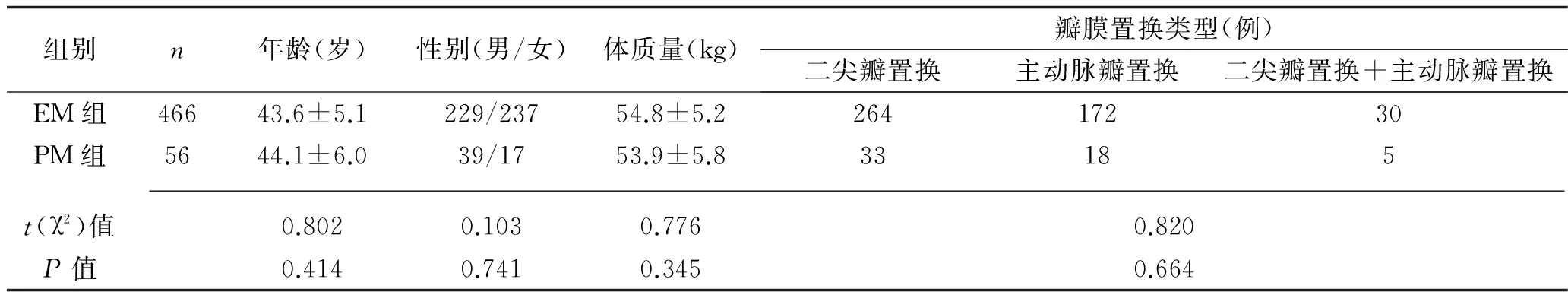
表1 不同基因型患者一般情况比较
2.2 两组患者连续6 d华法林用量比较 在EM组与PM组,不同时间点的华法林用量比较,差异具有统计学意义(F时间=6.132,P时间=0.022),其中EM组在术后4 d的华法林用量较首次剂量明显减少,PM组在术后3 d华法林用量较首次剂量明显减少,术后4、5、6 d持续显著减少;两组华法林用量比较,差异具有统计学意义(F分组=6.804,P分组=0.015),其中术后4、5、6 d PM组华法林用量显著低于EM组;分组与时间无交互作用(F交互=1.592,P交互=0.201)。见表2。

表2 EM组与PM组患者术后6 d华法林用量比较(x±s,mg)
2.3 两组患者术后PT值与INR值比较 EM组与PM组,不同时间点PT值比较,差异有统计学意义(F时间=8.134,P时间=0.016),其中两组PT值均于术后2 d开始增高,术后4 d上升到最高水平;两组PT比较,差异有统计学意义(F分组=7.112,P分组=0.013),其中PM组术后3、4、5d 的PT值明显高于EM组;分组与时间无交互作用(F交互=1.661,P交互=0.191)。EM组与PM组不同时间点INR值比较,差异有统计学意义(F时间=8.439,P时间=0.011),其中两组INR值于术后2 d开始增高,术后4 d上升到最高;两组INR比较,差异有统计学意义(F分组=6.414,P分组=0.022),其中PM组术后3、4、5 d INR值明显高于EM组;分组与时间无交互作用(F交互=1.575,P交互=0.221)。见表3。
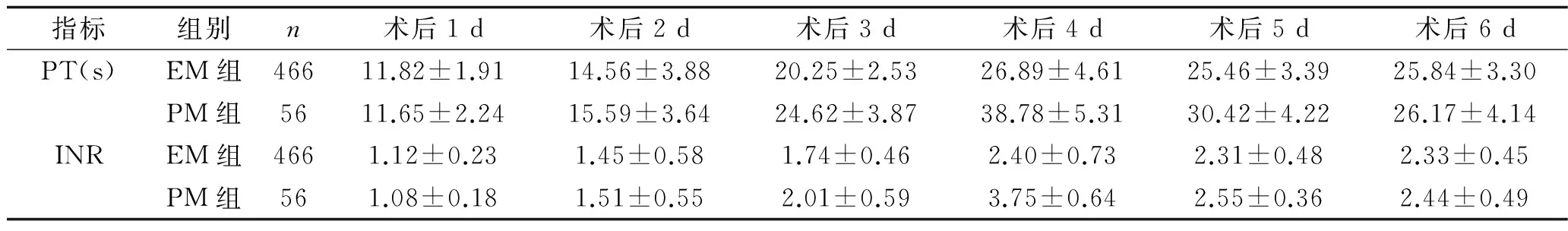
表3 EM组与PM组患者术后PT值及INR值比较(x±s)
2.4 两组华法林初始治疗抗凝过量的比较 全组522例患者中,出现抗凝过量63例,占12.1%(63/522);EM组出现抗凝过量28例,占6.0%(28/466);PM组出现抗凝过量35例,占62.5%(35/56);PM组出现抗凝过量者的比例高于EM组,差异具有统计学意义(χ2=6.98,P=0.016)。
3 讨 论
华法林是心脏瓣膜置换术后抗凝治疗的常用药物,金属机械瓣置换术后患者需要终生抗凝,但不同患者使用华法林剂量差异明显,需要个体化治疗,其中遗传因素是影响患者华法林用量的主要因素[4]。CYP2C9基因是位于人染色体10q24.2,全长约50.71 kb,目前研究发现CYP2C9存在CYP2C9*2~*35多种突变等位基因,以野生型纯合子*1/*1和含有突变型杂合子*2、*3最为常见[6]。CYP2C9*2突变是3号外显子上发生C430>T的突变,造成精氨酸144>半胱氨酸144氨基酸置换,CYP2C9*3是在7号外显子上发生A1075>C突变,造成异亮氨酸359>亮氨酸359氨基酸置换[13]。CYP2C9参与人机体中多种药物的代谢,其中包括抗凝血药华法林、双香豆素、硝苄香豆素、苯丙香豆素等[14]。由于不同CYP2C9基因型对华法林代谢程度的影响不同,所以参考CYP2C9基因型多态性来指导华法林个体用量具有较高的临床指导意义。Ghozlan等[15]研究发现,结合CYP2C9基因型的多态性来进行华法林抗凝治疗指导能够更准确地达到INR治疗窗的时间。Poopak等[16]发现对华法林抗凝治疗的患者提前2周进行CYP2C9基因多态性检测指导治疗可以减少血栓栓塞与出血的风险。
对于瓣膜置换术后的患者,术后定期检测PT值和INR来决定华法林的用量。对于抗凝治疗范围,结合中华医学会制定的华法林抗凝指南[11]以及我院心脏外科诊疗规范,应以PT值作为抗凝标准、INR作为参考标准,合理的抗凝治疗是维持PT值在20~30 s为宜,INR控制在2.0~3.0为宜。而华法林的用量调整,若PT值<20 s,表示抗凝不足,需要增加用量;而>30 s表示抗凝过度,需要减少用量,每次增减0.75 mg药量;而PT值>40 s且对应的INR>4.0则表示抗凝过度,需要停用华法林,而这一标准与2008年美国胸科医师协会建议的指南[17]相符合。本研究中,绝大多数研究对象的基因型为CYP2C9*1/*1,符合Hardy-Weinberg定律。术后连续观察6 d,EM组华法林抗凝用量在第4天较首次剂量明显降低,于第5天、第6天上升且趋于平稳,提示该组患者术后使用华法林抗凝用量相对较稳定;而术后第4天EM组PT值与INR增高至最高水平,可能与华法林使用前3 d的用量积累有关。华法林的半衰期为36~42 h,口服40 h后血药浓度趋于稳定[18]。含有*2和*3突变型杂合子的基因型占少数,且该突变型杂合子属于对华法林的慢代谢基因[6]。术后连续观察6 d,PM组华法林抗凝用量在术后第3天华法林用量较首次剂量明显减少,且术后4 d、5 d、6 d用量持续显著降低,可能与*2和*3基因导致对华法林代谢降低,从而引起术后华法林抗凝用量变化幅度大且维持量减少有关。含有*2和*3的PM组在术后4、5、6 d的华法林用量较EM组显著下降,且术后3、4、5 d的PT值与INR高于EM组,提示含有*2和*3的突变型杂合子对华法林代谢能力低于*1/*1的野生型纯合子,CYP2C9基因多态性能够影响华法林代谢及抗凝效果。此外,含有*2和*3突变型杂合子的PM组患者术后出现抗凝过度的几率明显高于基因型为*1/*1野生型纯合子的EM组患者(P<0.05),提示可通过CYP2C9基因多态来进行换瓣术后华法林抗凝指导,有效减少抗凝过度甚至出血的风险。
华法林抗凝治疗的效果受多种因素的影响,基因多态性是导致个体差异最主要的原因。基因导向的给药方式与能够有效缩短达到稳定剂量的时间,减少因机体内剂量原因引起的出血或栓塞风险,为临床更安全有效用药提供了依据。但CYP2C9的*2和*3基因只是影响华法林稳定剂量基因突变中的2个有代表性基因,仅解释40%~74%的个体剂量差异[19]。此外,华法林的影响因素还来自于其他基因的影响、拮抗或者协同药物的作用、胃肠道的吸收、肝脏的代谢、民族差异、饮食习惯以及其他疾病状态的干预等[20]。
[1] 郁 喆,陈 柯,丁英龙,等.华法林剂量调整策略的研究[J].中华胸心血管外科杂志,2015,31(5):304-305,312.
[2] Chuai JB,Shi L,Ma XY,et al.Curative effect of mechanical heart valve replacement and anticoagulant therapy after surgery[J].J Biol Regul Homeost Agents,2016,30(1):141-146.
[3] Riaz H,Alansari SA,Khan MS,et al.Safety and use of anticoagulation after aortic valve replacement with bioprostheses:a meta-analysis[J].Circ Cardiovasc Qual Outcomes,2016,9(3):294-302.
[4] 侯江龙,董 鑫,王玉庆,等.非遗传因素与基因多态性对华法林临床用药稳定维持剂量的影响[J].中华医学遗传学杂志,2015,32(5):629-634.
[5] Kumana CR,Cheung BM,Siu DC,et al.Non-vitamin K oral anticoagulants versus warfarin for patients with atrial fibrillation:absolute benefit and harm assessments yield novel insights[J].Cardiovasc Ther,2016,34(2):100-106.
[6] Yang L,Ge W,Yu F,et al Impact of VKORC1 gene polymorphism on interindividual and interethnic warfarin dosage requirement--a systematic review and meta analysis[J].Thromb Res,2010,125(4):e159-e166.
[7] 季闽春,沈晓英,徐 琳,等.口服抗凝药华法林的药物基因组学研究进展[J].中国临床药理学杂志,2010,26(9):696-700.
[8] Wittkowsky AK,Devine EB.Frequency and causes of overanticoagulation and underanticoagulation in patients treated with warfarin[J].Pharmacotherapy,2004,24(10):1 311-1 316.
[9] van Geest-Daalderop JH,Péquériaux NC,van den Besselaar AM.Variability of INR in patients on stable long-term treatment with phenprocoumon and acenocoumarol and implications for analytical quality requirements [J].Thromb Haemost,2009,102(3):588-592.
[10]郑 均,黄宇烽,随桂美,等.标准曲线法测定凝血酶原时间国际标准化比值[J].临床检验杂志,2001,19(1):21-23.
[11]中华医学会心血管病学分会,中国老年学学会心脑血管病专业委员会.华法林抗凝治疗的中国专家共识[J].中华内科杂志,2013,52(1):76-82.
[12]张宏礼,张鸿雁.关于最大信息熵原理与群体遗传平衡一致性的探讨[J].遗传,2006,28(3):324-328.
[13]吴 薇,李 艳,童永清,等.DNA测序法检测华法林用药剂量相关基因多态性的应用价值[J].中华检验医学杂志,2012(11):1 016-1 020.
[14]Tabrizi AR,Zehnbauer BA,Borecki IB,et al.The frequency and effects of cytochrome P450(CYP) 2C9 polymorphisms in patients receiving warfarin[J].J Am Coll Surg,2002,194(3):267-273.
[15]Ghozlan MF,Foad DA,Darwish YW,et al.Impact of CYP2C9 and VKORC1 genetic polymorphisms upon warfarin dose requirements in Egyptian patients with acute coronary syndrome[J].Blood Coagul Fibrinolysis,2015,26(5):499-504.
[16]Poopak B,Rabieipoor S,Safari N,et al.Identification of CYP2C9 and VKORC1 polymorphisms in Iranian patients who are under warfarin therapy[J].Int J Hematol Oncol Stem Cell Res,2015,9(4):185-192.
[17]Bonow RO,Carabello BA,Chatterjee K,et al.2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease-a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines(Writing Committee to revise the 1998 guidelines for the management of patients with valvular heart disease).Endorsed by the Society of Cardiovascular Anesthesiologists,Society for Cardiovascular Angiography and Interventions,and Society of Thoracic Surgeons[J].J Am Coll Cardiol,2008,52(13):e1-e142.
[18]董 力,石应康,刘小菁,等.心脏机械瓣膜置换术后抗凝监测的方法学研究及临床意义[J].中华胸心血管外科杂志,2001,17(5):260-262.
[19]Ye C,Jin H,Zhang R,et al.Variability of warfarin dose response associated with CYP2C9 and VKORC1 gene polymorphisms in Chinese patients[J].J Int Med Res,2014,42(1):67-76.
[20]彭 娟,谭胜蓝,周宏灏,等.华法林药物基因组学和个体化用药[J].中国药理学通报,2013,29(2):169-172.
Effect of cytochrome oxidase P450 gene polymorphism on postoperative anticoagulant dosage of warfarin in patients undergoing mechanical heart valve replacement
MAXian-lu1,ZHANGShen1,ZHENGBao-shi2,FENGXu2,XIEXiao-yong2,HUANGLiu-liu2
(1DepartmentofCardiothoracicSurgery,theFirstPeople′sHospitalofJining,Jining272011,China;2DepartmentofCardiothoracicSurgery,theFiristAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the effect of cytochrome oxidase P450(CYP2C9) gene polymorphism on postoperative anticoagulant dosage of warfarin in patients undergoing mechanical heart valve replacement.Methods A total of 522 patients with valvular disease undergoing selective heart valve replacement were selected.Polymerase chain reaction-restriction fragment length polymorphism was used to detect the CYP2C9 genotype in the patients.Then the patients were grouped according to the CYP2C9 genotypes.The patients with CYP2C9*1/*1 were enrolled as extensive metabolizer(EM) group,and the patients with CYP2C9*2 or *3 as poor metabolizer(PM) group.The dosages of warfarin,prothrombin time(PT) and international normalized ratio(INR) were recorded for 6 consecutive days after surgery.The incidences of overdose of warfarin for initial anticogulation were compared between the two groups.Results CYP2C9*1/*1,CYP2C9*1/*2,CYP2C9*1/*3 and CYP2C9*2/*3 were found in 466 patients(89.3%),6 patients(1.15%),42 patients(8.05%) and 8 patients(1.53%) respectively.And 466 cases were included in EM group and 56 cases in PM group.There was significant difference in the dosage of warfarin among different time points in each group(P<0.05).The dosage of warfarin in EM group reduced significantly on the postoperative 4th day compared to the initial dosage,while the dosage in PM group reduced significantly on the postoperative 3rd day compared to the initial dosage and continued to reduce on the postoperative 4th,5th and 6th day.The dosages of warfarin in PM group were less than those in EM group on the postoperative 4th,5th and 6th day(P<0.05).There were significant differences in PT and INR among different time points in each group(P<0.05).PT and INR in both groups began to increase on the postoperative 2nd day and reached the highest level on the postoperative 4th day.The levels of PT and INR in PM group were higher than those in EM group on the postoperative 3rd,4th and 5th day(P<0.05).The proportion of patients with overdose of warfarin for anticoagulation in PM group was higher than that in EM group(62.5%vs. 6.0%,P<0.05).Conclusion The detection of CYP2C9 gene polymorphism in combination with clinical laboratory is significant for determining the anticogulation dosage of warfarin after mechanical heart valve replacement. 【Key words】 Heart valve replacement,Cytochrome oxidase P450,Warfarin,Gene polymorphism,Anticoagulant
广西科学研究与技术开发计划(桂科攻1355005-2-3);广西自然科学基金(2013GXNSFAA019152)
马宪鲁(1990~),男,硕士,研究方向:心脏大血管外科诊疗。
郑宝石(1969~),男,博士,主任医师,硕士研究生导师,研究方向心脏大血管外科诊疗,E-mail:zhengbs25@vip.sina.com。
R 654.27
A
0253-4304(2016)10-1350-05
10.11675/j.issn.0253-4304.2016.10.04
2016-05-20
2016-07-07)

