姜黄素通过阻滞MAPK/ERK通路抑制人子宫内膜癌HEC-1-B细胞的侵袭转移
陈 茜,陈丽娟,党媛媛,李 牧,吴晓玲(西安交通大学第二附属医院妇产科,西安 710004;通讯作者,E-mail:wxlxjtu07@sina.com)
子宫内膜癌是女性生殖系统三大恶性肿瘤之一,仅次于卵巢癌和宫颈癌,约占20%-30%,发病率近年来呈上升趋势。姜黄素(curcumin)是姜黄的主要有效成分,因其具有抗肿瘤的作用而日益引起人们的关注[1]。近年来大量研究表明,姜黄素对肺癌、膀胱癌、宫颈癌、卵巢癌及直肠癌等均有抗肿瘤作用[2-4]。前期研究表明,姜黄素有抑制子宫内膜癌细胞侵袭的作用,但其作用及机制尚不明确,国内外也鲜有报道。肿瘤侵袭和转移过程是多步骤、多基因参与的过程,涉及多条细胞信号传导通路的异常。MAPK信号通路是真核细胞介导细胞外信号到细胞内反应的重要信号传导系统,受刺激后发生磷酸化而活化,调节细胞的生长、分化、分裂、死亡以及细胞间功能同步化过程[5],包括ERK细胞外信号调节激酶(extracellular signal regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38分裂原激活蛋白激酶(p38 mitogen activated protein kinase,p38MAPK)、细胞外信号调节蛋白激酶5(extracellular regulated kinase 5,ERK5)。其中 ERK通路是MAPK经典的通路,参与调节细胞增殖、肿瘤的侵袭转移过程而倍受关注。EMT是肿瘤侵袭和迁移过程中的重要环节,涉及一系列的上皮标记[上皮钙黏蛋白E-cadhrein(CDH1)],纤维粘连蛋白Fibronectin-1(FN 1)),间质相关分子[神经钙黏蛋白N-cadhrein(CDH2),波纹蛋白 Vimentin]及一些重要的转录因子[Twist、Snail、锌指E-盒结合同源异形盒-1/2(Zinc finger E-box binding homeobox 1/2,Zeb 1/2)]表达改变。因此,本研究将探讨姜黄素在抑制子宫内膜癌HEC-1-B细胞侵袭转移过程中对ERK/MAPK信号转导通路的作用,并分析该过程是否影响EMT发生,为临床子宫内膜癌转移和复发的治疗提供理论依据。
1 材料和方法
1.1 细胞株及主要试剂
人子宫内膜癌HEC-1-B细胞为本实验室保存。DMEM培养基、胎牛血清、姜黄素及 ERK抑制剂(U0126)购自美国Sigma公司,LipofectamineTM2000转染试剂盒购自Invitrogen公司,人工重构基底膜胶(Matrigel)购自美国BD公司,Transwell小室购自美国Corning公司,TaKaRa BCA蛋白定量试剂盒购自大连宝生物公司,real-time PCR引物由TAKARA公司合成。抗ERK1/2、p-ERK1/2、抗体购于美国Cell signal公司,抗 E-cadhrein、Vimentin、Twist、Snail和β-actin抗体购于Santa Cruz。
1.2 细胞培养
人子宫内膜癌HEC-1-B细胞株购于中国医学科学院细胞中心。细胞常规培养于含10%灭活胎牛血清的DMEM培养基中,青霉素浓度100 U/ml、链霉素浓度100 U/ml,静置于37℃、5%CO2的饱和湿度细胞培养箱中培养。细胞定期换液,融合率约到70%-80%时进行传代培养,取对数生长期细胞用于实验,实验前1 d洗涤细胞换液。
1.3 实验设计及分组
1.3.1 姜黄素对ERK1/2的影响 为研究姜黄素对HEC-1-B细胞中ERK1/2的影响,我们将各处理组分为两组:不加药组(0 μmol/L)设为空白对照组;不同浓度(10,20和 30 μmol/L)姜黄素预处理组为实验组即curcumin组。
1.3.2 姜黄素对ERK通路的作用 为研究姜黄素对ERK通路的特异性作用,我们构建质粒pcDNA 3.1(+)-MEK1稳定转染至HEC-1B细胞,将未转染的细胞设为空白对照组;转染空载体pcDNA3.1组为阴性对照组;转染真核表达载体pcDNA3.1(+)-MEK1组设为实验组。在此基础上,依据是否加药,分别设为 pcDNA3.1 不加药组(0 μmol/L),pcDNA3.1 加药组(20 μmol/L curcumin);pcDNA3.1(+)-MEK1 不加药组(0 μmol/L)及 pcDNA3.1 加药组(20 μmol/L curcumin)。
1.3.3 姜黄素对肿瘤细胞侵袭的作用 为了研究姜黄素对肿瘤细胞侵袭的抑制作用是否与ERK通路的抑制有关,我们将各组分为:细胞未加药组为对照组(control组);单独使用20 μmol/L姜黄素组为curcumin组;单独使用10 μmol/L U0126处理组为U0126组;姜黄素及U0126联合使用为curcumin+U0126组。
1.4 Western blot实验
为研究curcumin对各蛋白(ERK1/2、p-ERK1/2、E-cadhrein、Vimentin、Twist和 Snail)的影响,用Western blot法检测这些指标的表达。收集1.3中所述的各组细胞,PBS洗2次,离心,2×106个细胞重悬于 200 μl裂解缓冲液(1 mmol/L EDTA,40 mmol/L Tris-HCl,150 mmol/L KCl,1%Triton X-100,100 mmol/L NaVO3,1 mmol/L PMSF,pH 7.5)中裂解、离心,收集上清,采用BCA法测定蛋白浓度。各组蛋白样品各取80 μg经10%或12%SDS聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜上。该PVDF膜经37℃、5%脱脂牛奶封闭1 h后,于摇床上用TBST缓冲液漂洗10 min×3次,然后用特异性抗体4℃冰箱孵育过夜。次日取出,室温条件下用相应的二抗再次孵育1 h。暗室中加入ECL发光,显色成像,并用Image J软件对电泳条带进行灰度分析,每个实验至少重复三次,计算各蛋白的相对表达率=(目的条带的灰度值/相对应的内参条带的灰度值)×100%。
1.5 表达质粒的构建和转染
用KOD®DNA聚合酶克隆MEK1的全长PCR产物,以制备全长pcDNA3.1MEK1载体。采用DNA测序法测定质粒序列。在转染前24 h将细胞接种于6孔板,密度为每孔2×105个细胞。严格按照Invitrogen公司LipofectamineTM2000转染试剂盒说明,将pcDNA3.1(+)-MEK1表达载体(实验组)和pcDNA3.1(+)空载体(阴性对照组)稳定转染至HEC-1-B细胞中,通过添加G418筛选获得稳定表达MEK1的阳性克隆。每组至少为3个阳性克隆,共试验三次。
1.6 Transwell侵袭实验
通过体外Transwell小室实验来评估HEC-1-B细胞的侵袭能力。首先,在超净工作台中用Matrigel覆盖Transwell小室的上室,铺胶时尽可能保证胶面平整,风干待用。取对数生长期的细胞,用无血清培养基调整浓度为1×106个细胞/ml,每个小室上室中加入 200 μl的细胞悬液,按上述 1.3.2 和 1.3.3试验分组进行加药,下室中加入400 μl含20%胎牛血清的DMEM条件培养基,设空白对照组,即不做任何干预。每组平行3个复孔,置于细胞培养箱中培养24 h。实验结束后,对小室底端的细胞用95%乙醇固定10 min后、结晶紫染色15 min,在倒置显微镜下(×200)观察并计数穿膜细胞,每膜随机计算5个视野,取均值。
1.7 real-time PCR
收集上述1.3中1.3.3实验分组的细胞,TRIzol法提取细胞总RNA,按照TaKaRa公司PrimeScriptTMRT reagent Kit(Perfect Real-time)反转录试剂盒说明书进行反转录反应得到cDNA。然后,以cDNA为模板,利用表1中所合成的引物进行real-time PCR,检测相应基因的表达情况,采用Bio-Rad IQ5软件进行结果分析。各基因mRNA的相对达量为2-ΔCt,不同组别各基因mRNA表达量之间的倍数关系计算公式为:fold changes=实验组的平均 2-ΔCt值/对照组的平均 2-ΔCt值[6]。
1.8 统计分析
2 结果
2.1 姜黄素抑制子宫内膜癌细胞中的p-ERK1/2的表达
我们首先将子宫内膜癌HEC-1-B细胞用不同浓度(10,20和30 μmol/L)姜黄素处理24 h后,采用Westernblot检测姜黄素对HEC-1-B细胞中ERK1/2的影响。Western blot结果表明,随着姜黄素浓度的增加(0-30 μmol/L),HEC-1-B 细胞中的 ERK1/2的磷酸化水平显著降低(见图1A)。各处理组(10,20和30 μmol/L)的表达率分别为(68±21)%,(37±13)%,(19±2)%;与空白对照组相比,除了10 μmol/L姜黄素预处理组ERK磷酸化程度无显著性差异外,20 μmol/L和30 μmol/L姜黄素处理组均可显著抑制细胞p-ERK1/2表达,差异具有统计学意义(P<0.01,见图1B)。为了排除细胞毒性对实验结果的影响,我们选择20 μmol/L姜黄素进行后续研究。以上结果提示,姜黄素抑制HEC-1-B细胞中p-ERK1/2的表达,且呈浓度依赖性。
2.2 MEK1的异位表达可以逆转姜黄素对HEC-1-B细胞侵袭的抑制作用
为了进一步证实姜黄素对ERK通路的特异性作用,我们构建质粒pcDNA3.1(+)-MEK1稳定转染至HEC-1B 细胞。Western blot结果显示,pcDNA3.1(+)-MEK1转染后,HEC-1B细胞中p-MEK1和p-ERK1/2的表达增加,说明MEK/ERK通路的活性增加(见图2A)。同时我们发现,用20 μmol/L姜黄素处理pcDNA3.1(+)和 pcDNA3.1(+)-MEK1 组24 h后,与 pcDNA3.1(+)空载体组相比较,MEK1过表达后可以削弱姜黄素对肿瘤细胞侵袭力的抑制作用,pcDNA3.1(+)组和pcDNA3.1(+)-MEK1组的侵袭能力抑制率分别为(78.4 ±3.5)%和(64.92 ±5.1)%,二者间差异具有统计学意义(P<0.05,见图2B和图3)。
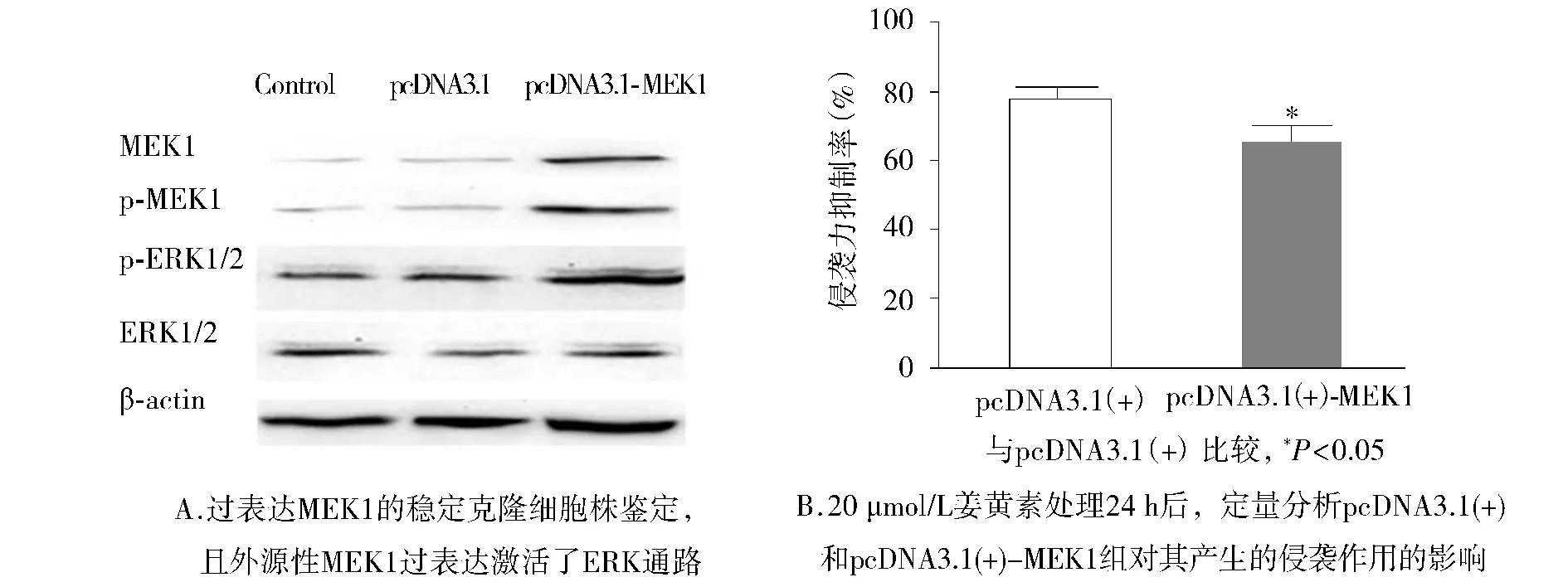
图2 MEK1的异位表达对姜黄素引起的HEC-1-B细胞侵袭作用的影响Figure 2 Effect of ectopic MEK1 expression on the invasion inhibition caused by curcumin in HEC-1-B cells

图3 Transwell体外侵袭实验证实过表达MEK1减弱了姜黄素引起的HEC-1-B细胞侵袭抑制作用Figure 3 The invasion assay in vitro demonstrated MEK1 overexpression significantly relieved the inhibitory effect of curcumin on HEC-1-B cell invasion
2.3 姜黄素通过阻滞ERK信号通路抑制HEC-1-B细胞的侵袭转移
为了进一步研究姜黄素对肿瘤细胞侵袭的抑制作用是否与ERK通路的抑制有关,我们引入ERK抑制剂(U0126,10 μmol/L),将其预处理 HEC-1B细胞30 min后,分别在有或无姜黄素(20 μmol/L)的培养基中孵育24 h后进行体外侵袭实验。结果表明,单独使用 U0126或姜黄素均可显著降低HEC-1-B细胞侵袭力(P <0.01或 P <0.05,见图4A)。与单独使用姜黄素或U0126相比,两者联用后侵袭抑制作用增强(P<0.05,见图4B),说明ERK抑制剂U0126可明显增强姜黄素的侵袭抑制作用。
2.4 姜黄素对子宫内膜癌HEC-1-B细胞EMT的影响

图4 姜黄素通过阻滞ERK信号通路抑制HEC-1-B细胞的侵袭转移Figure 4 Curcumin inhibited the invasion of HEC-1-B through blocking the ERK pathway
为了研究姜黄素是否影响EMT发生来发挥其侵袭抑制作用,我们采用Western blot和real-time PCR方法检测EMT相关分子的表达。按Western blot结果显示,与对照组相比,单独使用姜黄素(20 μmol/L),或 UO126(10 μmol/L)处理 HEC-1-B 细胞后,上皮标记E-cadhrein表达上调,而间质标记Vimentin及上皮间质转化诱导因子 Twist、Snail、表达均有所下调(见图5A)。两者联合使用可增强分别单独用药所产生的效应。我们进一步采用realtime PCR检测姜黄素对细胞中EMT相关基因mRNA水平的变化倍数。姜黄素组与不加药组相比,上皮标记CDH1、FN1的相对表达量分别平均增加了约2.5 倍、1.5 倍,而间质标记 CDH2、Vimentin 及各转录因子Twist、Snail的表达量则均有所下降,差异有统计学意义(P<0.05,见图5B),这些结果说明姜黄素(20 μmol/L)明显抑制EMT发生。
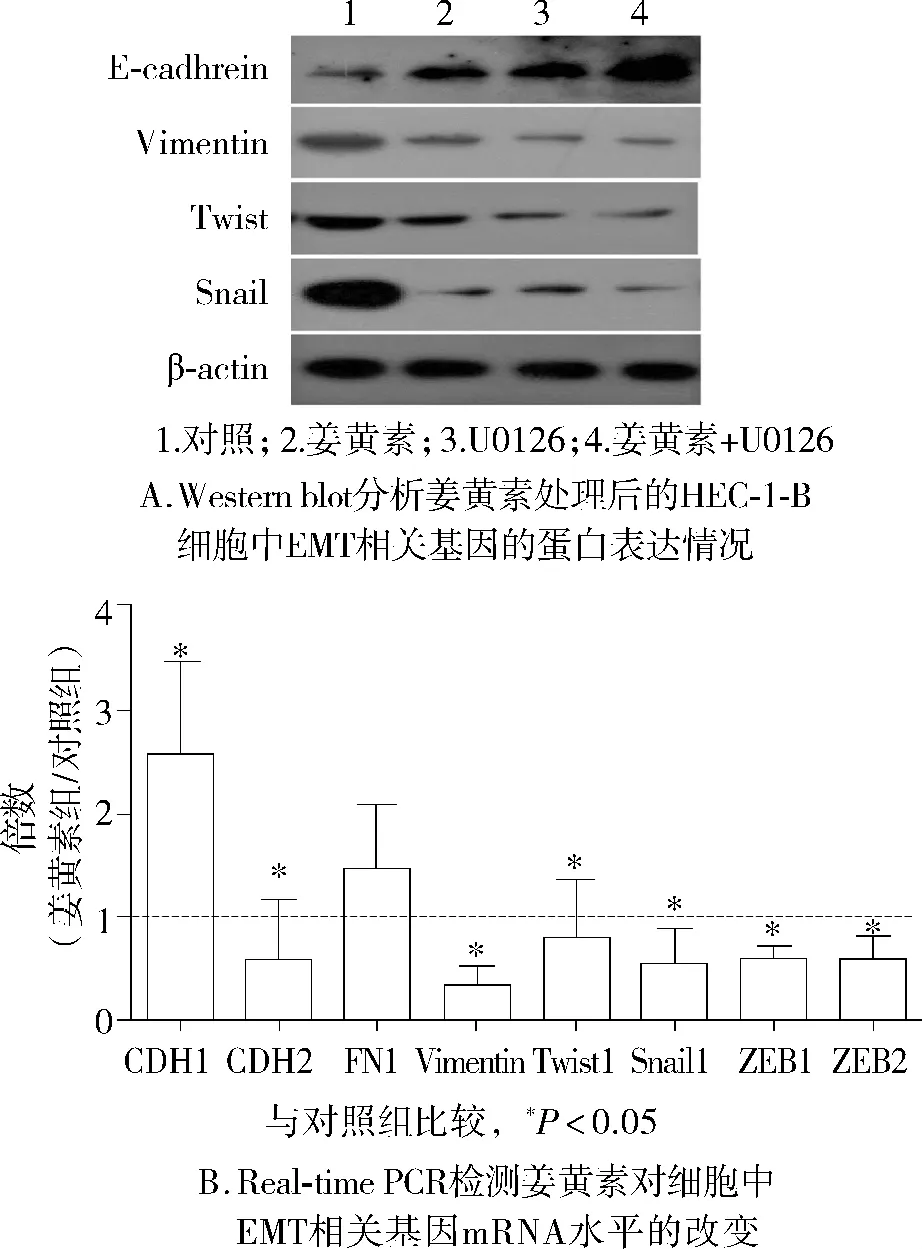
图5 姜黄素对子宫内膜癌HEC-1-B细胞EMT的影响Figure 5 Effects of curcumin on the EMT process of endometrial carcinoma HEC-1-B cells
3 讨论
丝裂原活化蛋白激酶(MAPK)通路是介导细胞外刺激到细胞内反应的重要信号转导系统,调节着细胞的增殖、分化和凋亡等,参与细胞的生长、发育等过程的调控,在恶性肿瘤细胞的发生、浸润等方面发挥重要作用[5]。大量研究表明,该通路在肿瘤进展和抗肿瘤治疗过程中发挥着重要作用[5,7]。目前已发现4条MAPK信号通路,其中ERK,即Ras-Raf-MEK-ERK途径在信号传递过程中起重要作用,同时也是与人类癌症关系最为密切的途径[8,9]。p-ERK是ERK的活化形式,只有磷酸化的ERK(p-ERK)才具有活性。ERK通过磷酸化反应可以促进多种癌基因相关基因的转录与表达,并破坏细胞外基质、促进肿瘤血管的生成,进而利于肿瘤细胞运动而发生转移[10]。在很多肿瘤中,ERK信号通路通常是被过度激活的[11]。研究证实,ERK信号通路在调节子宫内膜癌细胞的增殖、存活及侵袭力中发挥重要作用[12,13]。姜黄素可以抑制 ERK信号通路的活性[14]。Shin等发现姜黄素可能通过对ERK信号通路的调节来抑制子宫内膜癌细胞的侵袭[15]。本研究证实,姜黄素可以抑制ERK信号通路的活性,且与U0126联合应用可增强对子宫内膜癌细胞侵袭的抑制作用,然而其具体的作用机制尚需进一步研究。
MEK1基因位于人第15号染色体上,其编码序列长度为1 182 bp,该基因编码的蛋白属于丝氨酸/苏氨酸蛋白激酶家族,具有丝裂原激活蛋白激酶的活性。属于ERKs的激酶有MEK1和MEK2,MEK1是导致ERK磷酸化的主要激酶。多种激酶作用于MEK时,活化的MEK通过其N端区域与ERKs直接连接,催化ERK的亚功能区的Tyr/Thr残基双特异性磷酸化,从而激活ERK。同时,MEKs还可能是ERK在胞质中的锚定器,当信号通路无活性时,它就将ERK固定在胞质中,一旦有信号刺激ERKs磷酸化,它就激活ERKs并将其转移至胞核或其他活化位点,再进一步磷酸化下游底物。MEK2的作用只是降低ERK1/2对MEK1的反馈性抑制。基于此,我们将MEK1作为激活ERK信号通路的切入点。如图2所示,我们构建了pcDNA3.1(+)-MEK1过表达载体,将其稳定转染至HEC-1-B细胞中,采用Western blot鉴定并筛选出稳定表达细胞株,发现外源性MEK1过表达后,显著增加MEK/ERK信号通路的活性。进一步的侵袭实验证实,MEK1的异位表达可以逆转姜黄素对细胞侵袭的抑制作用,再次证实了姜黄素对HEC-1-B细胞的侵袭转移抑制作用是通过抑制ERK信号通路实现的。
EMT是肿瘤细胞获得迁移和侵袭能力的过程,指上皮细胞在形态上发生向成纤维细胞或间充质细胞表型的转变并获得迁移的能力,在胚胎发育、组织发生中起重要作用,并存在于多种慢性疾病的发病过程及肿瘤的浸润转移过程中,受许多转录因子(Snail,Twist,Zeb1 等)、细胞信号转导通路(NF-κB、MAPK、PI3K/AKT等)及微环境各种病理、生理性刺激的调节[16,17]。细胞经历EMT功能改变的过程是:与相邻的细胞分离;迁移到邻近的组织。其主要分子特征为:上皮标记物(E-cadhrein、FN 1)表达的下调和间质标记物(N-cadhrein、vimentin)表达的上调[18]。目前已发现EMT存在于多种上皮来源的肿瘤中,如卵巢癌、乳腺癌、口腔癌、食管癌、鼻咽癌、直结肠癌等,EMT与肿瘤细胞的原位浸润和远处转移有密切关系[19]。Huang等[20]研究发现姜黄素可以抑制体外培养的乳腺癌细胞的迁移性和侵袭力,降低波形蛋白表达和增加E-cadherin表达,其分子机制可能与EMT进程受破坏相关。在本研究中,单独使用姜黄素可抑制ERK1/2,下调其下游的EMT诱导基因的表达,进而阻碍肿瘤细胞发生EMT,从而抑制子宫内膜癌的侵袭转移,这与单独使用ERK抑制剂U0126得到相似的结果,且两者联合使用可增强单独使用的效应。此外,在本研究中,为了进一步证实我们研究结果的可靠性,我们同时采用了Western blot及real-time PCR两种方法证实了姜黄素作用后EMT各相关分子的蛋白及mRNA水平均发生了改变。以上结果提示ERK1/2通路在子宫内膜癌发生EMT的过程中起到了关键的调控作用。总之,我们的研究结果表明,姜黄素通过抑制上游ERK1/2信号通路来影响EMT过程发生,进而抑制子宫内膜癌细胞的侵袭转移,希望这一发现可以为临床恶性肿瘤包括子宫内膜癌的靶向治疗提供一个新的途径。
[1]Lin JK,Pan MH,Lin-Shiau SY.Recent studies on the biofunctions and biotransformations of curcumin[J].Biofactors,2000,13(1-4):153-158.
[2]王清,贾雪梅,王淑玉,等.姜黄素对人卵巢癌裸鼠皮下移植瘤生长的影响[J].江苏医药,2005,31(3):217-218.
[3]徐昉,牟晓玲,赵敬.姜黄素对人宫颈癌细胞Caski侵袭转移的影响[J].中山大学学报:医学科学版,2009,30(1):92-95.
[4]Anand P,Sundaram C,Jhurani S,et al.Curcumin and cancer:an“old-age”disease with an“age-old”solution[J].Cancer Lett,2008,267(1):133-164.
[5]Kohno M,Pouyssegur J.Targeting the ERK signaling pathway in cancer therapy[J].Ann Med,2006,38(3):200-211.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402- 408.
[7]Hilger RA,Scheulen ME,Strumberg D.The Ras-Raf-MEK-ERK pathway in the treatment of cancer[J].Onkologie,2002,25(6):511-518.
[8]韦淑琴,隋丽华,魏丽惠.丝裂原活化蛋白激酶通路在妇科肿瘤中的研究进展[J].国外医学妇产科学分册,2004,31(1):51-53.
[9]鲍伟,蔡斌,杨懿霞,等.子宫内膜癌中ERK1/2信号转导通路与雌、孕激素受体的相关性[J].上海交通大学学报:医学版,2009,29(1):5-8.
[10]孔卫平,孙冬霞,时志民,等.p-ERK-1及相关因子在子宫内膜癌中的表达及意义[J].中国热带医学,2013,13(3):270-272.
[11]Hoshino R,Chatani Y,Yamori T,et al.Constitutive activation of the 41-/43-kDa mitogen-activated protein kinase signaling pathway in human tumors[J].Oncogene,1999,18:813-822.
[12]Tong JS,Zhang QH,Wang ZB,et al.ER-alpha36,a novel variant of ER-alpha,mediates estrogen-stimulated proliferation of endometrial carcinoma cells via the PKCdelta/ERK pathway[J].PLoS One,2010,5:e15408.
[13]Wang Y,Zhu Y,Zhang L,et al.Insulin promotes proliferation,survival,and invasion in endometrial carcinoma by activating the MEK/ERK pathway[J].Cancer Lett,2012,322:223-231.
[14]Guo Y,Shan Q,Gong Y,et al.Curcumin induces apoptosis via simultaneously targeting AKT/mTOR and RAF/MEK/ERK survival signaling pathways in human leukemia THP-1 cells[J].Pharmazie,2014,69:229-233.
[15]Shin HK,Kim J,Lee EJ,et al.Inhibitory effect of curcumin on motility of human oral squamous carcinoma YD-10B cells via suppression of ERK and NF-kappaB activations[J].Phytother Res,2010,24:577-582.
[16]Ishikawa T,Shimizu T,Ueki A,et al.Twist2 functions as a tumor suppressor in murine osteosarcoma cells[J].Cancer Sci,2013,104(7):880-888.
[17]Jing Y,Han Z,Zhang S,et al.Epithelial-mesenchymal transition in tumor microenvironment[J].Cell Biosci,2011,29(1):1-7.
[18]Guarino M.EMT and tumour invasion[J].Int J Biochem Cell Biol,2007,39(12):2153-2160.
[19]Thiery JP.Epithelial-mesenchymal transitions in tumour progression[J].Nat Rev Cancer,2002,2(6):442-454.
[20]Huang T,Chen Z,Fang L.Curcumin inhibits LPS-induced EMT through downregulation of NF-κB-Snail signaling in breast cancer cells[J].Oncol Rep,2013,29(1):117-124.

