两种裸鼠胰腺癌模型肾上腺髓质素的表达和建模效果比较
刘 娜,杨文彬,曹 罡,王 磊(西安交通大学第二附属医院超声研究室,西安 70004;西安交通大学医学院第二附属医院普外科;通讯作者,E-mail:fanfanfriday@63.com)
根据流行病学调查,全世界范围内,胰腺癌在最常见的导致死亡的肿瘤中排第8位[1],如果不治疗,胰腺癌的平均生存时间为3-4个月[2],即使经过手术及放化疗等治疗,5年生存率也小于5%。胰腺癌术后死亡的原因主要是转移和复发,晚期腹腔种植转移极为常见,约占胰腺癌患者术后死亡人数的50%。一旦发生腹腔种植,其治疗效果不佳。如何有效预防、治疗腹腔种植转移是提高胰腺癌患者生存率的关键。胰腺癌的严重性以及对其病因学所知甚少的事实迫切需要我们开展更深入的研究。胰腺癌治疗进展缓慢的原因之一是缺乏一个适宜的动物模型。本实验目的在于通过观察皮下移植和原位移植胰腺癌裸鼠模型成功率,以及模型癌细胞中ADM和CD34的表达,比较两种建模方法的优劣,探讨构建胰腺癌异种裸鼠移植的适宜方法,并通过观察ADM以及CD34的表达,探讨ADM与血管生成的关系,力图对胰腺癌深入研究提供帮助。
1 材料与方法
1.1 材料
1.1.1 细胞株 人胰腺癌低分化癌细胞株(BXPC-3)由上海中科院细胞库提供。
1.1.2 实验动物 Balb/c-nu/nu小鼠购于中科院上海动物实验中心,周龄3-4周,体重10-20 g,雌雄各半,实验裸鼠及实验条件均达到SPF级标准,恒温25℃,空气相对湿度45%-50%,自由进食高压灭菌食物,饮用高压灭菌水。试验裸鼠总共40只,雌雄各半,按照随机、对照、配对原则分为三组:第一组15只构建皮下瘤模型;第二组15只建立原位移植瘤模型;第三组10只未做任何处理为阴性对照。
1.1.3 试剂 多克隆抗体ADM、CD34及 SP免疫组化试剂盒均购自北京博奥森生物技术有限公司。
1.2 方法
1.2.1 建立皮下移植瘤模型 人胰腺癌细胞株BXPC-3常规传代培养至一定数量,取体外培养的细胞处于对数生长密集期时,用0.25%胰酶消化细胞,制成细胞悬液。用细胞计数板进行细胞计数,并用台盼蓝染色检测细胞活力>95%,调整浓度至1×107个/ml[3],用规格为 1 ml的注射器抽取 0.2 ml(1 ×107个活细胞/ml)在裸鼠右背部皮肤皮下注射。
1.2.2 建立原位移植瘤模型 打开腹腔,分开胃与脾之间的薄膜,暴露胰腺,取50 μl瘤细胞悬液,将其注入胰腺被膜下,关闭腹腔。
1.2.3 观察指标及病理学观察 实验裸鼠没有死亡,长出移植瘤则模型构建成功。游标卡尺测量皮下移植瘤模型肿瘤大小,长径(L)和横径(W),并按公式V=L×W2/2求得肿瘤的近似体积,每5 d测量一次计算生长率,生长率=平均肿瘤体积(mm3)/宿主裸鼠带瘤时间(d),并绘制生长曲线图。移植30 d后,观察实验动物胸腹腔转移情况。所有移植瘤均进行常规取材,石蜡切片,HE染色,光镜观察组织学特点。
1.2.4 免疫组化结果判定 ADM表达判定:阳性结果以细胞质和/或细胞膜中出现棕色颗粒为准。在400倍高倍视野下选取3个视野,计数阳性细胞百分比后取平均值。阳性细胞数<5%为阴性(-),阳性细胞数5%-25%为阳性(+),26%-50%为中度阳性(++),>50%为强阳性(+++),取平均值。其中-、+、++即<50%为ADM低表达组,+++为ADM高表达组[4]。微血管密度(MVD)判定:参照Weidner微血管计数法[5],血管内皮细胞胞质呈棕黄色或棕褐色者为CD34阳性细胞。具体方法是低倍镜(×100)下选取高血管密度区,在×200下计数3个视野的MVD,取其平均值作为该切片的MVD值,结果以3张片中的MVD的平均值表示。
1.3 统计学方法
2 结果
2.1 移植成功率
各种模型构建的成功率分别为:皮下移植瘤模型47%(7/15),原位移植瘤模型100%(14/14),利用细胞注射法建立原位移植瘤模型成功率较高(见图1)。
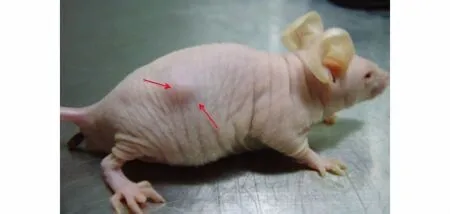
图1 移植后30 d时皮下移植瘤模型Figure 1 Subcutaneous tumors in nude mice at 30 d after transplantation
2.2 移植30 d后的转移情况
胰腺癌皮下移植瘤模型中无1例发生远处转移。原位移植模型胰腺处长出不规则肿瘤组织,并向周边胃壁组织浸润,发生腹腔种植转移,在肠系膜上、腹膜上和肝脏均发现转移结节(见图2-4)。
2.3 移植瘤形态及组织形态观察
皮下瘤模型瘤体与皮肤无粘连,瘤体基底与肌肉及后腹膜粘连,完整切除瘤体,质地稍硬,表面凹凸不平,切开后,切面呈灰白色鱼肉状,打开胸腹腔,未见胸腹腔内有远处转移。原位转移模型在胰腺处形成不规则的肿瘤组织,并与周围胃壁组织、肠管浸润粘连,部分在腹膜、肠系膜及肝脏形成转移结节,切开肿瘤后切面呈灰白色鱼肉状。HE染色:肿瘤细胞大小形态不一,可见多角形细胞,梭形细胞,细胞异型性大,周围有大量纤维间质,看不到腺腔分化,可见弥漫分布的癌巢,细胞核大、核异型性明显,极性消失,可见核仁和较多核分裂,符合低分化腺癌病理特点,肝转移结节中可见正常肝细胞旁边的肿瘤细胞(见图5-7)。
2.4 ADM和CD34在移植瘤中的表达
ADM蛋白染色主要位于细胞质内和细胞膜上,呈棕褐色颗粒状(见图8)。CD34主要在肿瘤组织的微小血管上表达,特别是在肿瘤的边缘部位较为集中,微血管被染成褐色(见图9)。
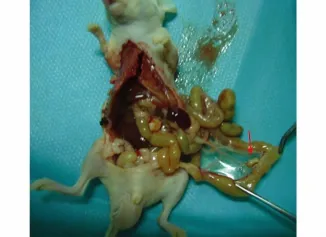
图2 胰腺癌原位移植模型肠系膜种植结节Figure 2 Metastatic node in the mesenterium of orthotopic transplanted pancreatic tumor mice

图3 胰腺癌原位移植模型腹膜种植结节Figure 3 Metastatic node in the peritoneum of orthotopic transplanted pancreatic tumor mice

图4 胰腺癌原位移植模型肝种植结节Figure 4 Metastatic node in the liver of orthotopic transplanted pancreatic tumor mice
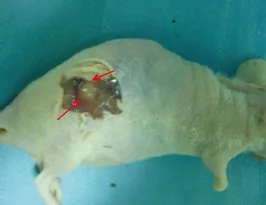
图5 皮下瘤模型大体标本Figure 5 Gross of pancreatic carcinoma subcutaneous tumor
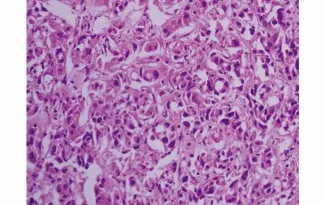
图6 移植瘤HE染色(×200)Figure 6 Morphological changes of pancreatic carcinoma subcutaneous tumor by HE(×200)
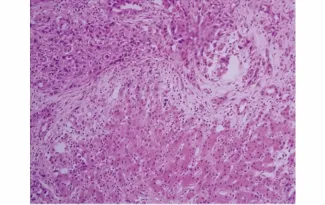
图7 肝转移结节HE染色(×200)Figure 7 HE staining of metastatic node in the liver of pancreatic carcinoma subcutaneous tumor(×200)
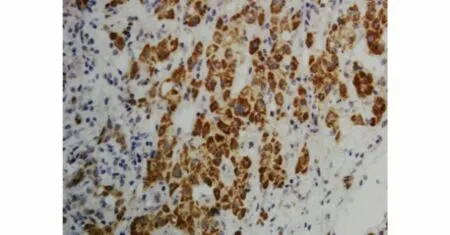
图8 原位移植模型转移瘤ADM表达(×200)Figure 8 ADM expression in metastasis models of orthotopic transplantation tumor(×200)
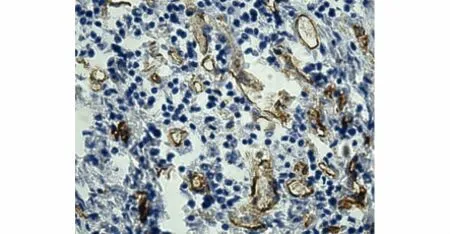
图9 原位移植模型转移瘤CD34表达(×200)Figure 9 CD34 expression in metastasis models of orthotopic transplantation tumor(×200)
对裸鼠胰腺癌原位移植模型和皮下瘤模型肿瘤组织中ADM表达阳性率和MVD值进行统计学检验(见表1、表2)。①采用两独立样本率卡方检验,两者之间ADM阳性表达率差异无统计学意义(P>0.05)。②采用两独立样本t检验,MVD值在两者之间差异有统计学意义,原位移植模型转移瘤明显高于皮下瘤模型(P<0.01)。③两组之间ADM表达差异无统计学意义(P>0.05),MVD 差异有统计学意义(P <0.01)。④采用两独立样本t检验,结果显示ADM高表达者MVD相应增多,其差异有统计学意义(P<0.05)。

表1 ADM、CD34在皮下移植瘤和原位移植模型转移瘤中的表达Table 1 ADM,CD34 expression in metastasis models

表2 移植瘤中不同ADM表达中MVD的变化Table 2 Comparison of mean MVD in metastasis models of different ADM expression
3 讨论
导致胰腺癌预后极差的原因除了胰腺癌患者就诊时已属中晚期外,其侵袭和转移的能力仍是制约和影响胰腺癌治疗的关键。腹腔转移在腹部恶性肿瘤的治疗中往往预后很差,占肿瘤术后死亡人数的50%[6],现在常用的治疗方法是腹腔化疗和腹膜切除的方法,疗效大都不理想,腹腔转移过程的机制尚不明确,如何有效预防、治疗肿瘤腹腔转移是提高肿瘤患者生存率的关键,其转移机制也成为肿瘤治疗领域的热点。而是否能建立一种完善的动物胰腺癌模型是进行相关领域研究的前提和关键。
自从Rygaard和Povlsen首次报道在裸鼠上成功移植入人结肠癌后[7],许多研究者开始使用这种模型研究胰腺癌生物学机制和对治疗的反应。这种无胸腺小鼠又称裸鼠,因为T细胞功能缺陷,所以不排斥外来组织移植物。裸鼠技术促进了人类肿瘤细胞库的建立,细胞系种类包括高-低分化肿瘤,本实验所采用的胰腺癌BXPC-3细胞系属于胰腺低分化腺癌,侵袭力较强,容易制造移植模型。最常用的方法是将细胞株传代培养后以一定量接种于裸鼠皮下,模型重复性好,技术操作简单,长出的肿瘤肉眼可以观察,肿瘤大小,生长速度等均可以量化,比较适合评估一种新的抗肿瘤药物,或某种化学物质甚至放射治疗对肿瘤产生的影响。但在本研究中我们发现,异位移植模型几乎不发生远处转移,虽然可用于治疗药物的筛选评估,但容易出现药物的假阳性,即对皮下移植瘤有效的治疗方法不一定对转移灶有效,而治疗胰腺癌消除转移灶是非常关键的一步[8]。相对的,原位移植模型模拟了人胰腺癌的常见发病部位及组织学类型,移植癌生长在胰腺原位、局部微环境、血液循环及淋巴引流特征与人类胰腺癌十分相似,在形态、生长、浸润转移方面与其来源肿瘤保持一致,而且成瘤潜伏期短,成瘤率可达到100%,有利于对干预效果进行全面、长期追踪观察,为更深入地研究胰腺癌提供了良好的实验平台。
此外,本研究中我们发现ADM在两种模型肿瘤组织中均有表达,ADM表达高者MVD相应增多,其差异有统计学意义。肾上腺髓质素(ADM)广泛分布于人体内的各个组织器官,发挥多种生物效应。其中以肾上腺髓质、腺垂体、脑、肾、心脏中的浓度较高[9]。其生理作用主要是参与调节循环系统功能。有研究表明胰腺癌ADM4 mRNA水平比正常胰腺组织和慢性胰腺炎高4倍,胰腺癌细胞本身可以生产和分泌ADM,并与由胰腺星状细胞和内皮细胞分泌的处于微环境中的受体相互作用,提高胰腺癌细胞增殖、侵袭活动[10]。CD34主要表达于处于活跃增生状态的血管内皮细胞,是内皮细胞增殖的相关标志,与新生血管密切相关。肿瘤组织的内皮增殖是正常组织的20-2 000倍,内皮细胞快速增殖形成血管为肿瘤细胞增殖和浸润转移提供了基础。肿瘤组织中的微血管密度(MVD)与癌症患者的预后相关[11]。本实验采用免疫组织化学法测定移植瘤体中ADM和CD34表达,通过计数微血管密度,发现ADM表达高者MVD相应增多,其差异有统计学意义。这在基因与分子层面上证明了原位移植瘤模型在胰腺癌相关方面的研究利用效果要优于皮下移植瘤模型,并可推测ADM有调节胰腺癌血管生成的作用,那么抗ADM的药物如果有相反的作用,就可以为临床上胰腺癌的治疗提供一个新的肿瘤抗血管靶点。
[1]Tawada K,Yamaguchi T,Kobayashi A,et al.Changes in tumor vaseularity depicted by contrast-onhanced ultrasonography as a predietor of chemotherapeutic effect in patients with unresectable pancreatic cancer[J].Pancreas,2009,38(1):30-35.
[2]Tang Y,Liu F,Zheng C,et al.Knockdown of clusterin sensitizes pancreatic cancer cells to gemcitabine chemotherapy by ERK1/2 inactivation[J].Exp Clin Cancer Res,2012,31:73-75.
[3]张宾,王予辉.常用动物实验操作指南[M].上海:上海中医药大学出版社,2007:52-67.
[4]屈振,徐明,卢明柱,等.肾上腺髓质素在肝癌组织中的表达及其与肿瘤组织微血管密度的关系[J].胃肠病学和肝病学杂志,2014,23(5):489-491.
[5]Weidner N,Semple JP,Welch WR,et al.Tumor angiogenesis and metastasis correlation in invasive breast carcinoma[J].N Engl J Med,1991,324(1):1-8.
[6]Kozarek R.Role of preoperative palliation of jaundice in pancreatic cancer[J].J Hepatobiliary Pancreat Sci,2013,20:573- 575.
[7]Rygaard J,Povlsen CO.Heterotransplantation of a human malignant tumor to nude mice[J].APMIS,1969,77:758- 770.
[8]刘斌.人胆管癌组织原发灶和转移灶裸鼠种植模型建立的比较研究[D].新疆:石河子大学,2006.
[9]Wang DB,Cai WQ,Yang SW,et al.The study of the relationship between the expression of adrenomedullin and the microvessel density in renal cell[J].Chin J Exp Surg,2011,28(6):854-856.
[10]汪理,刘涛,勾善森,等.RNA干扰糖原合成激酶-3β对人胰腺癌裸鼠移植瘤生长及血管生成的影响[J].中华实验外科杂志,2014,31(1):16-18.
[11]Tang Yong,Liu Fenghua.Correction:Knockdown of culsterin sensitizes pancreatic cancer cells to gemcitabine chemotherapy by ERK1/2 inactivation[J].J Exp Cancer Res,2013,32:42.

