电针对SAMP8小鼠海马Beclin-1表达的影响
王 丰,吕 东,李长征,陈 跃,陈 晔,谢永财,董卫国(福建中医药大学中西医结合学院,福州350;福建中医药大学针灸学院;通讯作者,E-mail:fjdwg60@63.com)
阿尔茨海默病(Alzheimer’s disease,AD)是一种年龄相关的以进行性认知功能障碍和记忆损害为特征的中枢神经系统退行性疾病,其致残率和致死率高,病因及发病机制尚不清楚,目前没有特效药物。近年来的临床报道及实验研究表明,电针治疗AD有较好疗效[1]。研究证实,自噬功能失调与AD关系密切[2],自噬相关蛋白Beclin-1在自噬调节中起重要作用。本实验通过观察电针对老年痴呆模型SAMP8(senescence accelerated mouse/prone 8,SAMP8)小鼠海马Beclin-1表达的影响,从自噬角度揭示针灸治疗AD的作用机制。
1 材料与方法
1.1 实验动物
8月龄SAMP8小鼠16只,8月龄抗快速老化小鼠亚系(senescence accelerated mouse/resistance 1,SAMR1)8只,雄性,体重20-25 g,北京大学医学部实验动物科学部提供,合格证质量号:SCXK(京)2011-0012。
1.2 主要仪器及试剂
华佗牌无菌针灸针、G6805型电针治疗仪(上海医疗仪器厂);Morris水迷宫系统(中国医学科学院药物研究所);解剖显微镜(日本 Olympus公司);Beclin-1兔多克隆抗体(美国Santa Cruz Biotechnology公司);SP免疫组化试剂盒(北京中杉金桥公司)。
1.3 动物分组及治疗
实验前适应性喂养1周。16只SAM8小鼠按计算机安全随机法分为模型组、电针组,每组8只;SAMR1小鼠8只作为正常老化对照组。
1.4 实验方法
电针组采用自制网兜固定小鼠,选择百会、大椎、肾俞(双侧)、足三里(双侧)。具体操作:直刺进针后,接G6805型电针治疗仪,连续波,频率2 Hz,电流强度以引起大鼠后肢肌肉轻微抖动而不嘶叫为宜,每日1次,每次20 min,10 d为1个疗程,疗程间隔1 d进行下1个疗程,共3个疗程。模型组和对照组不作治疗,只进行相同方式、时间、程度的抓取和自制网兜固定。
1.5 Morris水迷宫试验
采用Morris水迷宫试验检测小鼠的空间学习记忆能力,测试内容包括定位航行试验和空间探索试验两部分。定位航行实验中,平台位于第3象限,没于水下1 cm,每天分上、下午2个时间段,每个时间段每只小鼠训练4次,将小鼠分别从4个入水点(各象限池壁中点)面向桶壁放入水中,记录小鼠爬上平台所需时间,即逃避潜伏期,如果120 s内未找到平台则将其引至平台并在平台停留10 s,记录逃避潜伏期为120 s,连续进行5 d。第6天撤离平台,进行空间探索试验,将小鼠从平台所在象限的对侧象限放入池中,自由游泳120 s后结束试验,记录小鼠在原平台象限停留的时间。
1.6 动物处理
水迷宫检测结束后,以10%水合氯醛(400 mg/kg)腹腔麻醉,仰卧位固定于手术台上,剪开胸腔,暴露心脏,从心尖插入灌注针至左心室,同时剪开右心耳,快速注入37℃生理盐水80 ml,无血污后改为注入4%多聚甲醛80 ml。待小鼠尾巴完全僵直时迅速取出脑组织,固定于4%多聚甲醛溶液中12-24 h,进行脱水透明浸蜡及石蜡包埋。
1.7 免疫组化SP法检测小鼠海马Beclin-1的表达
石蜡切片,片厚4 μm,经二甲苯酒精脱蜡水化后,3%过氧化氢灭活内源性过氧化酶活性,置pH 6.0的0.01 mol/L柠檬酸缓冲液中,微波炉加热修复抗原,PBS洗3次,每次5 min。滴加羊血清工作液,封闭非特异性抗原。滴加Beclin-1多克隆抗体,浓度1∶100,4℃湿盒内过夜,37℃复温1 h,滴加生物素化二抗,滴加辣根过氧化物酶标记链霉卵白素工作液,DAB显色5-10 min,适时终止。梯度酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察。每批实验均设有阴性对照。以磷酸盐缓冲液PBS代替一抗作为阴性对照。染色阳性结果为细胞膜或细胞质呈棕黄色。每只小鼠重复观察2张切片,每张切片随机选取5个视野,用Image Pro Plus 5.0图像分析系统计数每个高倍视野下阳性细胞数,取平均值作为每只小鼠的阳性染色强度。
1.8 统计学处理
2 结果
2.1 Morris水迷宫实验
结果显示,电针组平均潜伏期较模型组缩短,原平台象限停留时间增加(P<0.05,见表1,2)。
表1 三组小鼠平均逃避潜伏期比较(±s,s)Table 1 Comparison of average escape latency among three groups(±s,s)
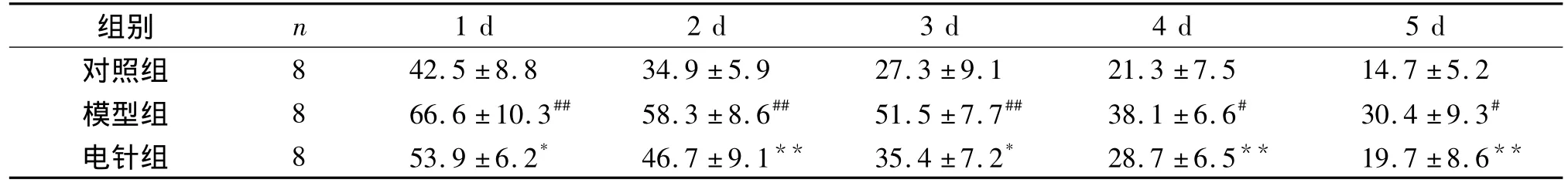
表1 三组小鼠平均逃避潜伏期比较(±s,s)Table 1 Comparison of average escape latency among three groups(±s,s)
与对照组比较,#P <0.05,##P<0.01;与模型组比较,*P <0.05,**P<0.01
组别 n 1 d 2 d 3 d 4 d 5 d对照组 8 42.5 ±8.8 34.9 ±5.9 27.3 ±9.1 21.3 ±7.5 14.7 ±5.2模型组 8 66.6 ±10.3## 58.3 ±8.6## 51.5 ±7.7## 38.1 ±6.6# 30.4 ±9.3#电针组 8 53.9±6.2* 46.7±9.1** 35.4 ±7.2* 28.7 ±6.5** 19.7 ±8.6**
表2 三组小鼠在原平台象限停留时间的比较(±s)Table 2 Comparison of plateau phase among three groups(±s)

表2 三组小鼠在原平台象限停留时间的比较(±s)Table 2 Comparison of plateau phase among three groups(±s)
与对照组比较,#P <0.01;与模型组比较,*P <0.05
组别 n 停留时间(s)36.5 ±5.3模型组 8 19.4 ±4.4#电针组 8 27.3 ±6.8对照组8*
2.2 海马Beclin-1表达
结果显示,SAMP8小鼠较同龄SAMR1小鼠Beclin-1表达明显降低,电针刺激能提高SAMP8小鼠海马 Beclin-1 的表达(P <0.05,见图1、表3)。
3 讨论
快速老化小鼠SAMP8是一个从普通的遗传群AKR/J系小鼠中通过表型选择培育出的快速老化小鼠,表现为衰老相关的学习记忆缺陷与AD临床表现非常相似。另外,SAMP8小鼠也具有β淀粉样蛋白沉积和tau蛋白高度磷酸化等AD的病理特征[3-5]。因此,目前SAMP8小鼠被认为是有效的研究散发性AD的动物模型,并且已有大量的研究采用SAMP8小鼠作为AD动物模型研究AD的机制及药物治疗AD的作用机制[6]。

图1 三组小鼠海马Beclin-1表达Figure 1 Expression of Beclin-1 in hippocampus in three groups
表3 三组小鼠海马Beclin-1阳性表达细胞计数(±s)Table 3 Comparison of positive Beclin-1 cell counts in hippocampus among three groups(±s)
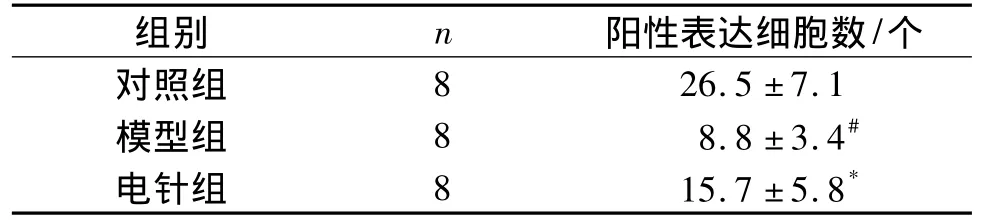
表3 三组小鼠海马Beclin-1阳性表达细胞计数(±s)Table 3 Comparison of positive Beclin-1 cell counts in hippocampus among three groups(±s)
与对照组比较,#P <0.01;与模型组比较,*P <0.05
组别 n 阳性表达细胞数/个26.5 ±7.1模型组 8 8.8 ±3.4#电针组 8 15.7 ±5.8对照组8*
AD发病的主要原因是随着年龄的增长,各脏腑的功能活动均逐渐减弱,其中以肾的精气亏虚最为显著。因此,选择百会、大椎、肾俞(双侧)、足三里(双侧)进行治疗。百会位居头之巅顶,为“三阳五会”,具有通调督脉气血,补脑益智之功。大椎为督脉的重要穴位,手足三阳的阳气由此汇入本穴并与督脉的阳气上行头,有益气补脑的作用。肾俞是肾的背俞穴,具有调补肾气的作用。足三里为胃的下合穴,脾胃为后天之本,气血生化之源,胃经又为多气多血之经,针刺足三里可以补益气血。以上诸穴合用,共奏补肾益髓之功。
自噬与AD密切相关,AD患者脑部可见巨型细胞自噬减少[7],AD模型SAMP8小鼠脑部自噬活力降低[8]。Beclin-1是酵母ATG6的同系物,通过与其上下游的调节蛋白相互作用,组成多条信号通路,调节自噬,其表达与自噬活性呈正相关。一方面,Beclin-1 mRNA及蛋白表达在AD患者脑部样品及从 AD 患者分离的小胶质细胞中明显降低[9,10];另一方面自噬活性降低及自噬体的聚集有助于Beclin-1减少。Beclin-1缺乏可激起 β-淀粉样蛋白(Aβ)沉积,Beclin-1过度表达可减少Aβ聚集。Aβ的过量表达和异常聚集是引起AD的重要原因之一,Beclin-1在AD发展中起重要作用。因此,提高Beclin-1表达可能对AD有治疗作用。本研究显示,SAMP8小鼠较同龄SAMR1小鼠Beclin-1表达明显降低,电针能提高SAMP8小鼠海马Beclin-1的表达,从而增强自噬活性,改善学习记忆能力。
Morris水迷宫是目前最常用的评价动物学习和记忆能力的装置,通过让实验动物在水中寻找隐藏平台并通过分析其寻找平台所用的时间和所走的路径判断其学习、记忆功能的好坏。通过实验发现,SAMP8小鼠学习记忆力下降,可能与海马Beclin-1表达降低,自噬活性减弱有关。电针组平均潜伏期较模型组缩短,原平台象限停留时间增加,表明电针可提高AD模型小鼠的学习记忆能力。
[1]Cheng H,Yu J,Jiang Z,et al.Acupuncture improves cognitive deficits and regulates the brain cell proliferation of SAMP8 mice[J].Neurosci Lett,2008,432(2):111-116.
[2]Wolfe DM,Lee JH,Kumar A,et al.Autophagy failure in Alzheimer’s disease and the role of defective lysosomal acidification[J].Eur J Neurosci,2013,37(12):1949-1961.
[3]Manich G,Mercader C,Lynch G,et al.Characterization of amyloidbeta granules in the hippocampus of SAMP8 mice[J].J Alzheimers Dis,2011,25(11):535-546.
[4]Pallas M,Camins A,Smith MA,et al.From aging to Alzheimer's disease:unveiling“the switch”with the senescence-accelerated mouse model(SAMP8)[J].J Alzheimers Dis,2008,15(9):615-624.
[5]Takeda T.Senescence-accelerated mouse(SAM)with special references to neurodegeneration models,SAMP8 and SAMP10 mice[J].Neurochem Res,2009,34(12):639-659.
[6]Cheng XR,Zhou WX,Zhang YX.The behavioral,pathological and therapeutic features of the senescence-accelerated mouse prone 8 strain as an Alzheimer’s disease animal model[J].Ageing Res Rev,2014,13(11):13-37.
[7]Lee S,Sato Y,Nixon RA.Lysosomal proteolysis inhibition selectively disrupts axonal transport of degradative organelles and causes an Alzheimer’s-like axonal dystrophy[J].J Neurosci,2011,31(21):7817-7830.
[8]Ma Q,Qiang J,Gu P,et al.Age-related autophagy alterations in the brain of senescence accelerated mouse prone 8(SAMP8)mice[J].Exp Gerontol,2011,46(7):533-541.
[9]Pickford F,Maslish E,Britschgi M,et al.The autophagy-related protein beclin 1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice[J].J Clin Invest,2008,118(6):2190-2199.
[10]Lucin KM,O’Brien CE,Bieri G,et al.Microglial beclin 1 regulates retromer trafficking and phagocytosis and is impaired in Alzheimer's disease[J].Neuron,2013,79(5):873-886.

