siRNA沉默Smad4对奥沙利铂抑制乳腺癌MDA-MB-231细胞侵袭和迁移的影响
马琳艳,宋乐乐,黄莹莹,孙小锦,董淑英,蒋志文,刘 浩(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,蚌埠 33030;蚌埠医学院第一附属医院药剂科;通讯作者,E-mail:liuhao6886@foxmail.com)
乳腺癌是女性最常发的恶性肿瘤之一,尽管近半个世纪以来对于乳腺癌的研究取得了重要的进展,术后无病生存率和总体生存率明显升高,每年仍约有30%的患者死于乳腺癌的复发和迁移[1]。研究表明在肿瘤发生发展的各个阶段都有miRNAs的参与,扮演着致癌或抑癌基因,故探索乳腺癌细胞侵袭和迁移相关miRNAs成为近年来治疗和预防乳腺癌迁移性复发的研究热点之一[2]。研究发现,siRNA沉默Smad4能减弱转化生长因子-β(transforming growth factor-β,TGF-β)诱导的 MDA-MB-231细胞的侵袭能力,可能与其抑制机制金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)的表达有关[3]。近年来有大量关于Smad4基因失活和肿瘤发生关系的研究,然而关于评估Smad4表达和乳腺癌侵袭和迁移间关系的研究目前却很少。因此本研究以乳腺癌MDA-MB-231细胞为研究对象,观察 siRNA Smad4转染后奥沙利铂(oxaliplatin,OXA)抑制乳腺癌细胞侵袭和迁移活性的变化,并探讨其可能机制,以期为siRNA用于乳腺癌侵袭迁移的防治提供新的思路和方案。
1 材料与方法
1.1 材料
1.1.1 细胞株 人乳腺癌MDA-MB-231细胞购于中国科学院上海细胞生物研究所细胞库。
1.1.2 主要试剂 DMEM培养基、胰蛋白酶、胎牛血清、MTT购于美国 GIBCO公司;OXA,批号:H20093167,齐鲁制药有限公司;Transwell小室:美国Corning公司;Smad4 siRNA序列:AAC TAC AAA TGG AGC TCA TCC,德国Qiagen公司设计,转染试剂由上海吉玛制药技术有限公司合成;兔抗人Smad4、TGF-β、MMP-9 抗体:武汉博士德生物工程有限公司;山羊抗兔IgG:中杉金桥生物技术有限公司;TGF-β、MMP-9 ELISA试剂盒:美国R&D公司。
1.2 方法
1.2.1 细胞培养 MDA-MB-231细胞采用DMEM培养液,含10%灭活FCS,2.0 g/L碳酸氢钠,1×105U/L青霉素,100 mg/L链霉素,37℃、饱和湿度、5%CO2培养箱中培养。
1.2.2 MTT法测定细胞增殖活性 为观察 OXA对MDA-MB-231细胞的增殖抑制作用,实验中采用不同浓度 OXA(0.25,0.5,1,2,4 μmol/L)处理MDA-MB-231细胞,使用MTT法检测细胞存活率。取对数生长期的细胞以每孔100 μl培养液含7 000个细胞接种于96孔板中,在37℃、饱和湿度、5%CO2培养箱中培养。培养24 h使细胞贴壁后,弃去每孔培养液,用含不同浓度 OXA(0.25,0.5,1,2,4 μmol/L)处理,同时设置阴性对照组和空白对照组,每组设3个复孔。继续培养24,48,72 h后每孔加入浓度为5 g/L的MTT溶液10 μl继续孵育4 h,弃上清;每孔加 DMSO 150 μl,37 ℃孵育 30 min,全自动定量绘图酶标仪测定每孔的570 nm波长吸光度A值,各药重复实验3组。
1.2.3 siRNA转染 探索最佳的转染效率:将对数生长期的细胞接种于24孔板,每孔1×105个细胞,培养24 h后,弃培养液,用PBS洗1遍,按照说明书进行操作,将不同体积脂质体(Lipofectamine 2000,Life Technologies)与 50 μl opti-MEM 混匀,1 μl阴性对照6-羧基荧光素(negative control FAM,NC-FAM)(5'- UUCUCCGAACGUGUCACGUTT-3')与 50 μl opti-MEM混匀,静置5 min,将Lipofectamine 2000加入到NC-FAM中,按照Lipofectamine 2000∶NC-FAM=1∶4,1∶2,1∶1,2∶1,5∶2 的比例结合成复合物,静置20 min,将复合物加入到每孔中,并加入opti-MEM使每孔终体积为2 ml。12 h后,荧光显微镜下观察转染效率并选取1∶1为最佳比例。
将对数生长期细胞制成单细胞悬液以每孔4×105个细胞接种于6孔板中,培养24 h后按1∶1的比例进行转染,6 h后更换新鲜培养液,次日收集细胞提取蛋白,进行Western blot检测Smad4 siRNA对MDA-MB-231细胞中Smad4蛋白表达的影响。
1.2.4 Transwell小室迁移实验 取对数生长期的MDA-MB-231细胞,用对照组、1 μmol/L OXA 组、Smad4 siRNA 组、1 μmol/L OXA+Smad4 siRNA 组含1%血清的培养基重悬,每个Transwell小室的上室加入5×104细胞,下室加入 600 μl含10%胎牛血清的培养液,加入时避免气泡的产生。置于5%CO2,37℃,饱和湿度环境下继续培养24 h后,弃上室中培养液,PBS漂洗2-3次,常温下置于4%多聚甲醛固定15 min。用棉签吸去上室内液体,1%结晶紫染液室温下染色15 min,PBS漂洗2-3次,显微镜下每孔随机取5个视野拍照,统计细胞数目并取平均值。每组细胞均设3个复孔,实验重复3次。
1.2.5 Transwell小室侵袭实验 将预冷的Matrigel胶与无血清的DMEM培养基按1∶8稀释铺于Transwell小室上下室之间,每孔50 μl均匀包被于Transwell小室底部膜内,置培养箱30 min使之成胶。其余步骤均与迁移实验相同。
1.2.6 细胞划痕实验 取对数生长期的MDA-MB-231细胞制成单细胞悬液,按每孔5×105个细胞接种于6孔板中并混合均匀。待细胞生长至90%融合时,用200 μl的无菌枪头每隔1 cm垂直于横轴进行划痕,用PBS漂洗去除划下的漂浮细胞,加入对照组、1 μmol/L OXA 组、Smad4 siRNA 组、1 μmol/L OXA+Smad4 siRNA组的无血清培养基。置于5%CO2,37℃,饱和湿度环境下继续培养,于0,24 h观察细胞的划痕愈合情况并拍照。
1.2.7 Western blot检测蛋白表达 将对数生长期MDA-MB-231细胞按每孔5×105个细胞种入六孔板中,于37℃、5%CO2、饱和湿度下培养24 h后设对照组、1 μmol/L OXA 组、Smad4 siRNA 组、1 μmol/L OXA+Smad4 siRNA组继续培养24 h后收集蛋白。将收集的细胞离心5 min,2 500 r/min,弃上清,每管加入150 μl的细胞裂解液并重悬打匀后迁移入1 ml的离心管中,冰上裂解30 min。裂解完毕后4℃离心15 min,12 000 r/min,取上清液并用BCA蛋白定量法测各组蛋白含量并用裂解液将各组蛋白稀释至等浓度并与2×上样液以1∶1比例混合,于100℃煮沸3 min使蛋白变性。取20 μg每组,用 10%SDS-PAGE 凝胶电泳(70 V,30 min,90 V,90 min);转膜(250 mA,150 min)至PDVF 膜;5%脱脂牛奶封闭 2 h;一抗(兔抗人 Smad4、TGF-β、MMP-9,抗体浓度1∶100),封闭过夜;TPBS洗3次,PBS洗1 次,15 min/次;山羊抗兔二抗 1∶1 000,室温孵育2 h;TPBS洗3次,每次15 min;Bio-Rad凝胶成像系统获取图像。
1.2.8 ELISA检测MMP-9和TGF-β 活性 将对数生长期MDA-MB-231细胞按每孔5×104个细胞种入十二孔板中,设对照组、1 μmol/L OXA组、Smad4 siRNA 组、1 μmol/L OXA+Smad4 siRNA 组,24 h 后收集细胞培养液,用BCA试剂盒检测其蛋白含量并用培养液稀释至等蛋白含量。装入1.5 ml的离心管中,4℃离心15 min,16 000 r/min。加入实验前将试剂盒取出室温平衡20 min。设标准孔和样品孔,在标准孔中加标准品(S0-S5)各50 μl;样品孔加样品10 μl和样品稀释液40 μl。除空白孔外每孔加入检测抗体100 μl,用封版膜封住,于37℃恒温箱培育60 min。培育完毕后,弃去孔内液体并用洗涤液洗5次。每孔加入底物A、B各50 μl,于37℃孵育15 min。每孔加入50 μl终止液并于15 min内检测450 nm处各孔的吸光度(A)值。
1.3 统计学方法
2 结果
2.1 OXA对MDA-MB-231细胞增殖抑制作用
MTT结果表明,随着OXA浓度的增加和作用时间的延长,细胞的存活率下降。1 μmol/L的OXA作用于MDA-MB-231细胞后24,48,72 h,细胞存活率分别是(77.42 ±3.98)%、(60.38 ±3.65)% 和(40.15 ±4.37)%(见图1)。
2.2 siRNA转染乳腺癌 MDA-MB-231细胞中Smad4表达下降
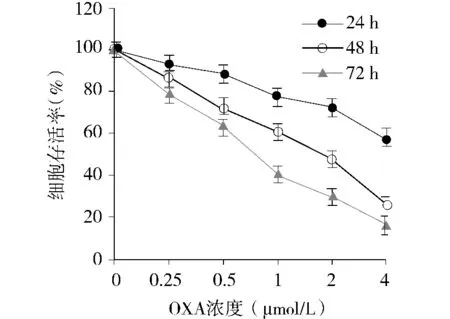
图1 OXA诱导乳腺癌细胞MDA-MB-231后24,48,72 h细胞存活率变化Figure 1 Changes of the viability of MDA-MB-231 cells after treatment with OXA for 24,48 and 72 h
Western blot结果显示,与对照组比较,Smad4 siRNA组Smad4蛋白表达明显降低(见图2A)。测定灰度值并计算出Smad4 siRNA组MDA-MB-231细胞中Smad4蛋白表达抑制率为(60.44±3.95)%,与对照组比较,差异有统计学意义(P<0.05,见图2B)。
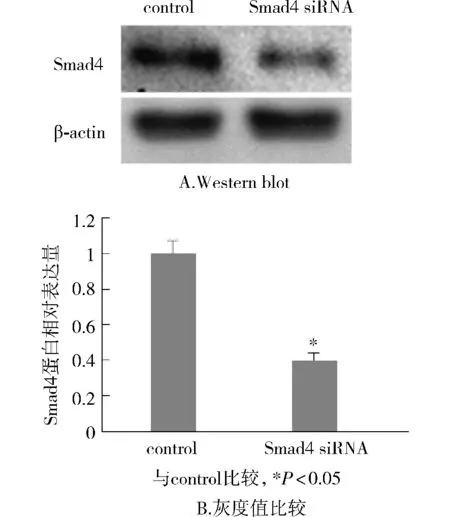
图2 Smad4 siRNA对MDA-MB-231细胞中Smad4蛋白表达的影响Figure 2 Effect of Smad4 siRNA on the expression of Smad4 protein in MDA-MB-231 cells
2.3 Smad4 siRNA对OXA抑制MDA-MB-231细胞迁移和侵袭活性的影响
实验分为对照组、1 μmol/L OXA 组、Smad4 siRNA 组、1 μmol/L OXA+Smad4 siRNA 组,以观察Smad4 siRNA对OXA抑制MDA-MB-231细胞迁移和侵袭活性的影响。
2.3.1 Transwell迁移和侵袭实验 Transwell迁移和侵袭实验结果显示(见图3A,3B),与对照组相比,OXA组MDA-MB-231细胞迁移和侵袭抑制率分别为(35.16 ±1.15)% 和(39.59 ±2.43)%,Smad4 siRNA组分别为(43.89 ±3.04)% 和(34.69 ±3.12)%,OXA+Smad4 siRNA 组为(61.85 ±4.54)%和(65.31±3.07)%。提示 Smad4 siRNA 可以增强OXA抑制MDA-MB-231细胞迁移和侵袭活性,差异均具有统计学意义(P<0.05)。
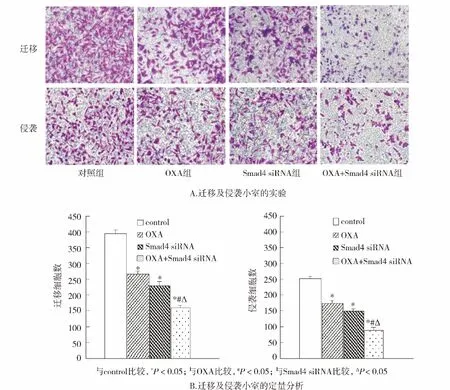
图3 Transwell小室法检测OXA和Smad4 siRNA及两者合用对MDA-MB-231细胞迁移和侵袭能力的变化Figure 3 Effects of OXA,Smad4 siRNA and their combination on MDA-MB-231 cell invasion and migration assessed by Transwell small chamber assay.
2.3.2 细胞划痕实验 细胞划痕实验结果显示:OXA组和Smad4 siRNA组均可抑制MDA-MB-231细胞的划痕愈合速度,而OXA+Smad4 siRNA组更明显抑制了划痕的愈合(见图4)。提示Smad4 siRNA可以增强OXA抑制MDA-MB-231细胞迁移的活性。
2.4 Smad4 siRNA转染增强OXA抑制MDA-MB-231细胞中TGF-β和MMP-9蛋白表达和活性的作用
Western blot(见图5A)及ELISA(见图5B)结果均显示,单独使用OXA组和Smad4 siRNA组均可抑制TGF-β和MMP-9蛋白和活性表达,合用后抑制作用增强,差异均具有统计学意义(P<0.05)。
3 讨论

图4 细胞划痕实验检测OXA和Smad4 siRNA单独及联合使用对MDA-MB-231细胞迁移能力的影响Figure 4 Effects of OXA,Smad4 siRNA and their combination on MDA-MB-231 cell migration assessed by wound healing assay
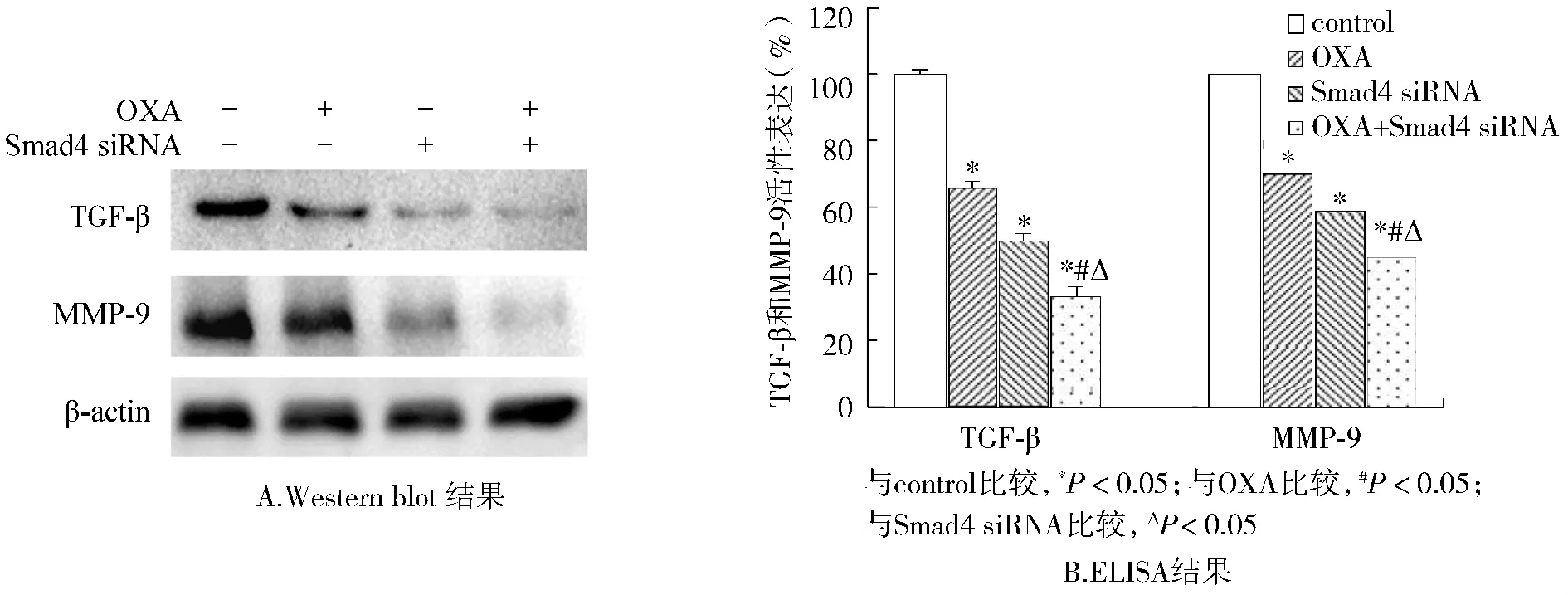
图5 OXA和Smad4 siRNA及两者合用对TGF-β和MMP-9蛋白表达和活性的影响Figure 5 Effects of OXA,Smad4 siRNA and their combination on protein expressions and activities of TGF-β and MMP-9
在肿瘤的发生和发展过程中,TGF-β发挥着抑癌基因及癌基因的双重角色[4]。在细胞癌化早期促进分化或凋亡,而在肿瘤发展期则丧失了这种应答的敏感性,刺激血管生成、抑制免疫应答、为肿瘤细胞的生长和转移提供了良好的局部环境[5]。Wang等[6]发现,下调 TGF-β 的表达可以通过调控ERK/S100A4通路抑制乳腺癌MDA-MB-231细胞的侵袭和迁移活性。TGF-β信号通路的关键信号转导分子是胞质蛋白Smads,经典TGF-β通路中,TGF-β需与TGF-β受体Ⅱ结合,而受体Ⅰ的转磷酸化作用将Smad2/3磷酸化后再与Smad4结合形成三聚体移至细胞核,抑制上皮因子,促进间质蛋白表达[7]。Smad4在信号传输途径中是唯一的共同介导型Smad,在TGF-β信号向细胞核内移行传递过程中发挥重要作用[8]。TGF-β/Smad传导通路与肿瘤细胞的侵袭和迁移活性的相关性研究也提示了可以通过调控下调Smad4的表达从而使该通路的传导受阻,减少TGF-β 信号向细胞核内移行传递的过程[9,10]。
MMPs在肿瘤细胞的侵袭转移过程中至关重要,直接或间接引起MMPs蛋白水平降低、活性下降或基因沉默从而降低肿瘤细胞侵袭迁移活性成为研究热点[11]。OXA是继顺铂和卡铂后的第三代铂类化合物,可诱发DNA的一级和次级损伤,引起肿瘤细胞的凋亡。有研究发现,Smad4 siRNA能减弱TGF-β诱导的细胞侵袭能力,可能与其抑制MMP-9的表达有密切关系[12]。刘保兰等[13]发现,OXA 可以抑制多发性骨髓瘤细胞的侵袭和迁移且检测到OXA作用后细胞中MMP-9的活性明显受到抑制。Wiercinska等[14]证实了 Smad4 是 TGF-β 通过 MMP-2和MMP-9表达诱导乳腺癌细胞侵袭活性的重要因素。
siRNA沉默基因表达结合其他经典药物或经典途径用于肿瘤研究已成为近年来的研究热点[15],为实现多途径、多通路综合治疗取得更好疗效有重要意义。本课题通过siRNA沉默Smad4基因,观察对OXA抑制乳腺癌MDA-MB-231细胞侵袭和迁移活性的影响和可能机制。Transwell和划痕实验结果显示,与对照组相比,Smad4 siRNA和OXA单用均可明显抑制MDA-MB-231细胞的侵袭和迁移,合用后抑制作用明显增强。为了探索Smad4 siRNA增强OXA抑制乳腺癌MDA-MB-231细胞侵袭和迁移活性的可能机制,Western blot和ELISA检测结果显示Smad4 siRNA和OXA单用均可使细胞中TGF-β和MMP-9蛋白和活性表达减少,且合用后更明显减少。以上结果显示,下调TGF-β和MMP-9蛋白和活性表达可能是降低乳腺癌细胞侵袭和迁移活性的有效途径之一,且siRNA介导的Smad4沉默可增强OXA下调MDA-MB-231细胞中TGF-β和MMP-9蛋白和活性表达的作用,从而使细胞的侵袭和迁移活性受到明显抑制。
以上研究结果提示Smad4 siRNA可以增强OXA抑制MDA-MB-231细胞侵袭和迁移的活性,其作用可能与干扰了TGF-β/Smad传导通路和抑制MMP-9蛋白活性表达相关。本研究为siRNA用于治疗乳腺癌提供一定的实验基础和新思路。
[1]Glicksman AS,Fulton JP.Metachronous cancer[J].R I Med J,2013,96(4):41-44.
[2]Gyparaki MT,Basdra EK,Papavassiliou AG.MicroRNAs as regulatory elements in triple negative breast cancer[J].Cancer Lett,2014,354(1):1-4.
[3]Deckers,van Dinther M,Buijs J,et al.The tumor suppressor Smad4 is required for transforming growth factor beta-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells[J].Cancer Res,2006,66(4):2202-2209.
[4]Miyazono K,Ehata S,Koinuma D.Tumor-promoting functions of transforming growth factor-β in progression of cancer[J].Ups J Med Sci,2012,117(2):143-152.
[5]Lee C,Zhang Q,Kozlowski J,et al.Natural products and transforming growth factor-beta(TGF-β)signaling in cancer development and progression[J].Curr Cancer Drug Targets,2013,13(5):500-505.
[6]Wang XG,Meng Q,Qi FM,et al.Blocking TGF-β inhibits breast cancer cell invasiveness via ERK/S100A4 signal[J].Eur Rev Med Pharmacol Sci,2014,18(24):3844-3853.
[7]Deckers,van Dinther M,Buijs J,et al.The tumor suppressor Smad4 is required for transforming growth factor beta-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells[J].Cancer Res,2006,66(4):2202-2209.
[8]Gu AD,Zhang S,Wang Y,et al.A critical role for transcription factor Smad4 in T cell function that is independent of transforming growth factor β receptor signaling[J].Immunity,2015,42(1):68-79.
[9]Liu NN,Xi Y,Callaghan MU,et al.SMAD4 is a potential prognostic marker in human breast carcinomas[J].Tumour Biol,2014,35(1):641-650.
[10]Zhang X,Ma Y,You T,et al.Roles of TGF-β/Smad signaling pathway in pathogenesis and development of gluteal muscle contracture[J].Connect Tissue Res,2015,56(1):9-17.
[11]Watanabe H.Extracellular matrix-regulation of cancer invasion and metastasis[J].Gan To Kagaku Ryoho,2010,37(11):2058-2061.
[12]Itatani Y,Kawada K,Fujishita T,et al.Loss of SMAD4 from colorectal cancer cells promotes CCL15 expression to recruit CCR1+myeloid cells and facilitate liver metastasis[J].Gastroenterology,2013,145(5):1064-1075.
[13]刘保兰,刘心,周柰岑,等.奥沙利铂诱导人骨髓瘤细胞RPMI8226凋亡机制的实验研究[J].中国实验血液学杂志,2013,21(1):99-104.
[14]Wiercinska E,Naber HP,Pardali E,et al.The TGF-β/Smad pathway induces breast cancer cell invasion through the up-regulation of matrix metalloproteinase 2 and 9 in a spheroid invasion model system[J].Breast Cancer Res Treat,2011,128(3):657-666.
[15]Niu Z,Li X,Hu B,Li R,et al.Small interfering RNA targeted to secretory clusterin blocks tumor growth,motility,and invasion in breast cancer[J].Acta Biochim Biophys Sin,2012,44(12):991-998.

