CK15在食管鳞癌患者组织及血清中的表达与意义
张艳姣,许翠萍,乔亚光,申宇宏,赵和平(山西医科大学第一临床医院消化科,太原 03000;通讯作者,E-mail:cuipingxu@hotmail.com)
食管鳞癌(esophageal squamous cell cancer,ESCC)是我国常见的恶性肿瘤。国内研究[1]发现,由于食管鳞癌早期症状不明显,许多患者未能及时就诊以致病情恶化,超过70%的食管鳞癌患者就诊时已处于晚期,即使手术切除预后效果也不容乐观。因此,对食管鳞癌的早期诊断意义重大。本研究通过检测细胞角蛋白15(Cytokeratin15,CK15)在食管鳞癌患者癌组织中的表达情况,检测CK15、增殖细胞核抗原(PCNA)及细胞角蛋白19片段抗原(CYFRA21-1)在食管鳞癌患者血清中的表达情况,探讨CK15在食管鳞癌发生、发展中可能的作用及意义,为食管鳞癌诊断标志物的发现提供实验依据。
1 材料及方法
1.1 临床资料
本研究通过伦理委员会审查并签署知情同意书。30例食管鳞癌患者均经病理确诊的食管组织活检标本都来自山西医科大学第一临床医学院,分别取食管鳞癌组织及癌旁组织(距病灶中心为5-10 cm,内镜下黏膜颜色正常,结构完整,并且病理检测无癌细胞)放于Corning管中-80℃保存。抽取食管鳞癌患者组、体检的正常对照组受检者晨起空腹状态肘静脉血5 ml,3 000 r/min离心10 min,分装于Eppendorf管中-80℃保存。食管鳞癌组男性16例,女性14例,年龄 44-70岁,平均(59.9±7.38)岁。正常对照组男性10例,女性20例,年龄28-60岁,平均(42.40±9.95)岁。
1.2 试剂与仪器
兔抗人CK15单克隆抗体分子量49 kD(英国ABcam公司);鼠抗人β-actin单克隆抗体,分子量43 kD,山羊抗兔二抗,山羊抗鼠二抗均购自北京中杉金桥生物技术有限公司;CK15、PCNA的ELISA试剂盒购自上海酶联生物有限公司。CYFRA21-1试剂购自苏州常光华医生物试剂有限公司。
半干电转仪(Bio-Rad,USA),Alpha多功能数字凝胶成像分析系统(美国ProteinSimple公司),ZLX800全自动酶标仪(Bio-Tek,USA),CYFRA21-1检验仪器使用EVERESYS A1800系列化学发光测定仪(苏州常光华医有限公司)。
1.3 方法
1.3.1 Western blot法检测CK15的表达 将收集的组织加入组织裂解液后研磨,制备总蛋白液,按照二奎琳甲酸(BCA)蛋白定量试剂盒说明书测定蛋白浓度。10%SDS不连续聚丙烯酰胺凝胶电泳(电压80-120 V),半干电转移(PVDF膜,15 V恒压,15 min)、封闭、加一抗(1∶700)及抗 β-actin单体(1∶700)4℃孵育过夜,洗膜后分别加HRP标记的羊抗兔二抗(1∶10 000)及HRP标记的羊抗鼠二抗(1∶10 000)孵育(4 ℃,2 h)、洗膜、显影。运用Alpha View图像分析软件分析样品灰度值,以目的蛋白/β-actin表示CK15的相对蛋白表达量。
1.3.2 ELISA 法检测血清中 CK15、PCNA 的含量 按说明书操作步骤稀释标准品,设空白孔、标准孔、待测样本孔后准确加样品及标准品,温育、洗板、加酶、再温育、洗板、加显色剂,温育10 min后加终止液,最后450 nm波长下依序测量各孔的吸光度值。CK15正常人血清学参考值范围是25-490 μg/L,PCNA正常人血清学参考范围是0.45-8.5 ng/ml。
1.3.3 化学发光法检测 CYFRA21-1 按EVERESYS A1800系列化学发光测定仪说明书操作步骤进行操作。CYFRA21-1正常人血清学的参考值为小于 4.0 ng/ml。
1.4 统计学分析
应用SPSS 17.0统计学软件进行结果分析,计量资料比较采用t检验,不服从正态分布采用秩和检验(u),检验水准P<0.05。诊断实验评价:敏感性=食管鳞癌检测阳性/食管鳞癌病人总数,特异性=正常人检测阴性数/正常人总人数,联合检测采用并联方法。
2 结果
2.1 Western blot检测 CK15的表达
Western blot检测结果显示,CK15及β-actin的条带在PVDF膜中主要分别分布在分子量大小为49 kD及43 kD的区域中,CK15在食管鳞癌组织及癌旁组织中的表达相对强度分别为5.21±2.80和24.35±11.39,CK15在食管鳞癌组织中的表达明显低于癌旁食管组织(P<0.05,见图1)。
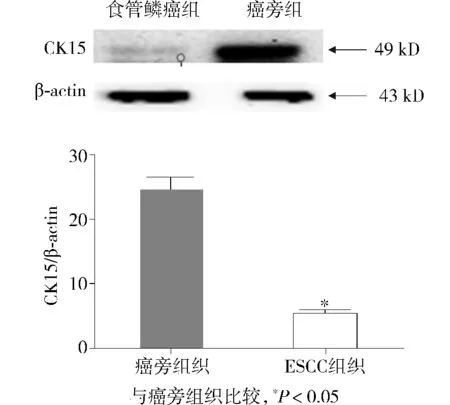
图1 CK15在食管鳞癌组织中的表达Figure 1 Expression of CK15 in the tissues of patients with ESCC
2.2 ELISA法检测CK15、PCNA及化学发光法测定CYFRA21-1的表达
食管鳞癌患者血清CK15水平明显低于正常对照组(P<0.05),CYFRA21-1水平明显高于正常对照组(P<0.05),PCNA在食管鳞癌患者血清及正常对照组中表达差异无统计学意义(P>0.05,见表1)。
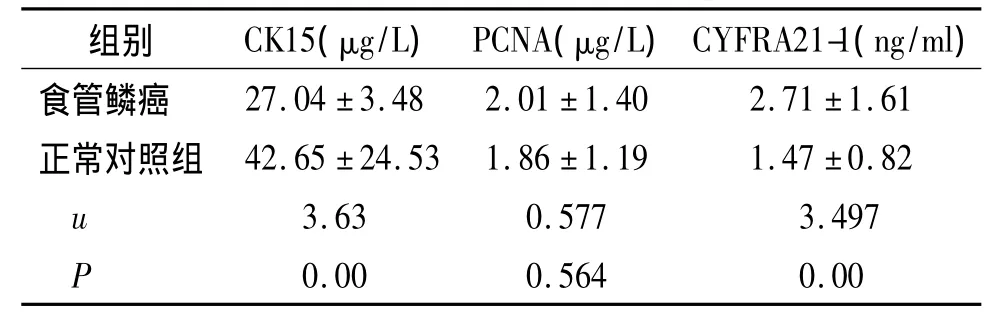
表1 食管鳞癌患者组和正常对照组血清中三种指标含量的分析Table 1 Comparison of serum levels of three indexes between ESCC and control group
单项及联合检测血清CK15与CYFRA21-1对食管鳞癌的诊断分析见表2。单项检测血清中CK15、CYFRA21-1水平对食管鳞癌诊断的敏感性分别为33.33%、30.00%,而联合检测敏感性为60.00%,因此联合检测可提高对食管鳞癌诊断的敏感性。

表2 CK15及CYFRA21-1诊断食管鳞癌的分析 (%)Table 2 Comparison of sensitivity and specificity of CK15 and CYFRA21-1 in diagnosis of ESCC(%)
3 讨论
细胞角蛋白(CK)是细胞骨架蛋白,其基因表达有很强的规律性,受细胞分化的调节,由30种不同的基因编码,可以转录成20种不同的多肽,分为Ⅰ型角蛋白和Ⅱ型角蛋白[2]。CK15是Ⅰ型酸性细胞角蛋白,既往研究认为,CK15是毛囊干细胞特异性标记物[3]。Lyle等研究表明:CK15在毛囊隆突区细胞中有特异性的表达,CK15阳性细胞具有干细胞生长周期慢的特点,同时高表达β1整合素和CK19。CK15阳性细胞在毛囊生长期开始时有短暂的增殖,而在其余生长周期中处于静止状态,在细胞的分化过程中CK15表达量减少出现时间较CK19更早,证明CK15阳性细胞是表皮干细胞,CK15可用于鉴定表皮干细胞[4]。多数研究不仅强调CK15的表达在上皮性肿瘤诊断中的重要性,还强调发育异常的角化细胞抑制CK15的表达而使鳞状细胞发生癌变[5]。大量研究证明,CK15还存在于食管、宫颈及角膜缘上皮的鳞状细胞中[6-9],病理条件下还存在于口腔鳞状细胞中[10]。但CK15是否在食管鳞癌中表达尚未见报道。本研究采用两种方法检测到CK15在食管鳞癌患者的表达下调,提示CK15的表达下调与食管鳞癌的发生有关。
CK19是较早被发现的能用来标记表皮干细胞的标志物之一。CYFRA21-1为CK19可溶性片段抗原,CYFRA21-1分布于上皮细胞胞质中,当上皮组织发生癌变时,可加速恶性上皮细胞的降解,使得大量可溶性的细胞角蛋白片段释放到细胞外液及血液中。因此,血液中CYRFA21-1的检测有助于肿瘤的诊断和病情监测。CYFRA21-1被广泛认为是非小细胞肺癌敏感的肿瘤标志物[11]。近来有报道认为,CYFRA21-1在肿瘤中的阳性率较其他肿瘤标志物高[12]。已有研究报道CYFRA21-1可能是诊断人类食管鳞癌有价值的标志物,且CYFRA21-1不仅可评估食管鳞癌治疗前的临床疗效而且还可以预测食管鳞癌的预后[13]。目前CYFRA21-1已经在临床上用于鳞癌的辅助诊断,但因其敏感性差,常需与其他的肿瘤标志物联合检测。
PCNA作为DNA聚合酶δ的辅助蛋白,其表达与细胞周期有关,为细胞核内DNA的复制与修复中各蛋白之间的协调作用提供平台,其量的变化与DNA的合成相一致,参与组织的增殖、分化以及损伤后修复[14],因此可作为评价细胞增殖状态的一项指标,也可用于判断肿瘤的恶性程度及预后。PCNA目前被认为是鳞状上皮细胞肿瘤的特异性标志物。国内孙海涛等[15]研究证实PCNA在食管鳞癌组织中表达增高。这也与本课题组前期的PCNA免疫组化的实验结果一致。然而本实验研究中发现PCNA在食管鳞癌组及正常对照组血清中表达无差异,可能因为PCNA是反映细胞核增殖的指标,主要在组织细胞核中表达而在血清中不分泌或者不表达。
本实验结果显示食管鳞癌患者组织及血清中CK15表达明显低于正常对照组,而CYFRA21-1在食管鳞癌患者血清中的表达明显高于正常对照组,提示CK15、CYFRA21-1对食管鳞癌的辅助诊断有一定的价值。表2的结果显示,分别单项检测血清中CYFRA21-1、CK15水平对食管鳞癌诊断的敏感性均呈较低水平,所以在食管鳞癌的诊断中依靠单项肿瘤标志物容易引起漏诊,而联合检测CYFRA21-1、CK15可明显提高食管鳞癌诊断的敏感性。
综上,本研究观察CK15在食管鳞癌患者组织及血清中的表达情况,结果提示CK15与食管鳞癌的发生有关,联合检测血清CYFRA21-1、CK15可提高对食管鳞癌诊断的敏感性,是诊断食管鳞癌的标志物,今后将在临床上扩大样本进一步验证。
[1]侯激流.血清肿瘤标志物联合检测在食管癌早期诊断中的价值分析[J].中国医学工程,2012,20(6):16-17.
[2]孙莉,李新功.细胞角蛋白检测在皮肤上皮性肿瘤诊断中的应用[J].中国麻风皮肤病杂志,2005,21(7):543-545.
[3]Bieniek R,Lazar AJ,Photopoulos C,et al.Sebaceous tumours contain a subpopulation of cells expressing the keratin 15 stem cell marker[J].Br J Dermatol,2007,156(2):378-380.
[4]Lyle S.The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells[J].J Cell Sci,1998,111(11):3179-3188.
[5]Bose A,Teh MT,Mackenzie IC,et al.Keratin K15 as a Biomarker of Epidermal Stem Cells[J].Int J Mol Sci,2013,14(10):19385-19398.
[6]Leube RE,Bader BL,Bosch FX,et al.Molecular characterization and expression of the stratification-related cytokeratins 4 and 15[J].J Cell Biol,1988,106(4):1249-1261.
[7]Smedts F,Ramaekers F,Leube RE,et al.Expression of keratins 1,6,15,16,and 20 in normal cervical epithelium,squamous metaplasia,cervical intraepithelial neoplasia,and cervical carcinoma[J].Am J Pathol,1993,142(2):403-412.
[8]Figueira EC,Di Girolamo N,Coroneo MT,et al.The phenotype of limbal epithelial stem cells[J].Invest Ophthalmol Vis Sci,2007,48:144-156.
[9]Garza LA.Bald scalp in men with androgenetic alopecia retains hair follicle stem cells but lacks CD200-rich and CD34-positive hair follicle progenitor cells[J].J Clin Investig,2011,121(2):613-622.
[10]Khanom R.Expression of basal cell keratin 15 and keratin 19 in oral squamous neoplasms represents diverse pathophysiologies[J].Histol Histopathol,2012,27(7):949-959.
[11]Okamura K,Takayama K,Izumi M,et al.Diagnostic value of CEA and CYFRA 21-1 tumor markers in primary lung cancer[J].Lung Cancer,2013,80(1):45-49.
[12]Alata F,Alata O,Metinta M,et al.Diagnostic value of CEA,CA 15-3,CA 19-9,CYFRA 21-1,NSE and TSA assay in pleural effusions[J].Lung Cancer,2001,31(1):9-16.
[13]Zhao N,Han B,Wu ZY,et al.Clinical significance of serum Stathmin in esophageal squamous cell carcinoma[J].World Chin J Digestol,2014,7(5):2361- 2371
[14]Mailand N,Gibbs-Seymour I,Bekker-Jensen S.Regulation of PCNA-protein interactions for genome stability[J].Nature Rev Mol Cell Biol,2013,14(5):269-282.
[15]孙海涛,高宏,张艺,等.P53、PCNA及P-gp在食管癌中表达的研究[J].航空航天医学杂志,2012,23(1):35-37.

