染砷大鼠脑砷代谢研究
通信作者:郑玉建,男,教授,博士生导师,研究方向:环境卫生学,E-mail:zhyujian6@sina.cn。
吴军,男,副教授,研究方向:环境卫生学,E-mail:wuj1997@sohu.com。
·基础医学研究·
染砷大鼠脑砷代谢研究
葛龙1, 刘嘉鸣1, 夏荣香2, 魏洁群3, 吴军1, 郑玉建1
(1新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室, 乌鲁木齐830011;2新疆维吾尔自治区疾病预防控制中心地方病科,
乌鲁木齐830000;3新疆医科大学第二附属医院行政办公室, 乌鲁木齐830063)
摘要:目的研究染砷大鼠脑中砷形态代谢产物、代谢酶含量水平及其相关性,初步探讨砷代谢与砷毒性机制关联性。方法雄性清洁级Wistar大鼠20只,分成对照组及砷酸钠低、中、高剂量组4组。各组大鼠砷酸钠经口染毒3个月后处死并摘取脑组织。采用高效液相色谱-氢化物发生原子荧光光谱法(HPLC-HGAFS)测定并比较砷酸钠各剂量染毒组大鼠脑组织中砷形态代谢产物[iAs(Ⅲ)、iAs(Ⅴ)、总砷(Total As)含量以及一甲基化率(PMI)、二甲基化率(SMI)]及代谢酶GSSG含量、甲基转移酶活力、GST活力、GSH含量;通过试剂盒法分析各组大鼠脑中甲基转移酶的活力,并探讨大鼠脑中砷形态代谢产物与代谢酶的相关性。结果染毒组大鼠随染毒剂量和时间的增加,出现生长发育迟缓及狂躁、相互撕咬等现象;砷染毒剂量升高会促进脑中iAs(Ⅲ)和总砷含量增加;同时砷染毒组脑组织中GSSG含量有所升高而GSH含量有所下降;随染毒剂量升高,GST活力也随之呈现升高趋势;与对照组比较,砷酸钠染毒各剂量组大鼠脑中PMI值均较低, SMI值有所升高(P<0.05)。砷酸钠染毒组甲基转移酶活力与iAs(Ⅲ)%含量呈负相关(r=-0.714,P<0.05),与PMI和SMI均呈正相关(rPMI=0.714,rSMI=0.805,P<0.05);砷酸钠染毒组GSH含量与iAs(Ⅲ)%含量呈正相关(r=0.855,P<0.05),与PMI和SMI均呈负相关(rPMI=-0.855,rSMI=-0.858,P<0.05)。结论低剂量砷酸钠染毒会打破脑组织中GSSG与GSH的动态平衡,造成脑组织的氧化损伤,砷酸钠染毒后其代谢产物在脑组织中可能具有一定的蓄积能力。
关键词:砷代谢; 砷形态; 代谢酶; 相关性
基金项目:教育部高等学校博士点基金(20126517110002, 20126517120003); 国家自然科学基金(81260410); 新疆医科大学博士科研启动基金(2012-17)
作者简介:葛龙 (1988-),男,在读硕士,研究方向:环境与健康。
中图分类号:R599.9
doi:10.3969/j.issn.1009-5551.2015.03.008
[收稿日期:2014-06-13]
Study on cerebral metabolism in rats with arsenic
GE Long1, LIU Jiaming1, XIA Rongxiang2, WEI Jiequn3, WU Jun1, ZHENG Yujian1
(1DepartmentofOccupationalandEnvironmentalHealth,CollegeofPublicHealth,
XinjiangMedicalUniversity,Urumqi830011,China;2DepartmentofEndemic,Centersfor
DiseaseControlandPreventionofXinjiangUygurAutonomousRegion,Urumqi830000,China;
3DepartmentofAdministrativeofFice,TheSecondAffiliatedHospitalofXinjiangMedical
University,Urumqi830063,China)
Abstract:ObjectiveTo observe the arsenic metabolites, metabolic enzyme levels in arsenic-poisoned rat brain for a preliminary study on the relationship between arsenic and arsenic toxicity mechanism. Methods20 male Wistar rats in clean grade were divided into 4 groups: control group, arsenate group in low dose, arsenate group in middle dose and arsenate group in high dose. The rats by oral administration were killed after 3 months and the brain tissues were removed. High performance liquid chromatography hydride generation atomic fluorescence spectrometry (HPLC-HGAFS) was applied to determine and compare the diencephalon arsenic metabolites [iAs(Ⅲ), iAs(Ⅴ), total arsenic (Total As) content and methylation rates (PMI), methylation rate (SMI)] and metabolic enzyme (GSSG content, methyl transferase activity, GST activity, GSH content) level in each group. Reagent kit method was taken to analyze the enzyme activity of methyl transfer and their relationship. ResultsWith the dose and time of arsenic exposure, the rats had growth retardation and manic bites; Arsenic exposure increased iAs(Ⅲ) and total arsenic content in the brain; PMI in arsenate groups was lower than that in the control group, and SMI in the control group increased (P<0.05). The activity of methyl transferase in sodium arsenate exposed group and the content of iAs (Ⅲ) % showed a negative correlation (r=0.714, P<0.05), and there was a positive correlation with PMI and SMI (rPMI=0.714, rSMI=0.850, P<0.05); The content of GSH in sodium arsenate exposed group was positively related with iAs (Ⅲ) % content (r=0.855, P<0.05), and negatively correlated with PMI and SMI (rPMI=0.855, rSMI=0.858, P<0.05). ConclusionSodium arsenate in low doses exposure could break the dynamic balance between GSH and GSSG in brain tissue and cause oxidative damage of brain tissue. Sodium arsenate exposure and its metabolites may have a certain capability of accumulation in the brain tissue.
Key words: arsenic metabolism; arsenic; metabolic enzyme; correlation
我国是饮水型砷暴露较为严重的国家,在高砷暴露的饮用水中主要为无机砷,而其中五价砷(iAs5+)代谢及毒性的研究相对较少。当砷在体内蓄积到一定程度时,可引起皮肤癌、中枢神经功紊乱、周围神经系统功能改变、糖尿病等疾病及机体功能障碍[1]。杨光等[2]的研究结果显示大鼠脑组织可能会对通过血-脑屏障的砷化物进行进一步的甲基化。到目前为止,脑砷代谢机制还不清楚,其对砷毒性机制的影响及两者关系也尚不明确。因此本实验研究染砷大鼠脑组织中砷形态代谢物及代谢酶水平差异,并分析其相关性,为进一步研究脑砷毒性机制奠定基础。
1材料与方法
1.1实验动物与分组选择清洁级雄性Wistar大鼠20只 [由新疆医科大学实验动物中心提供,动物生产许可证编号:SCXK(新)2003-0001,动物使用许可证编号:SYXK(新)2003-0001],体质量150~190 g。在湿度40%~60%、室温18℃~22℃的环境下适应性喂养1 w后,按体质量随机分为4组,即对照组及砷酸钠染毒低、中、高剂量组,每组5只。
1.2主要仪器和试剂仪器:Hamilton PRP-X100阴离子色谱柱(150 mm×2.1 mm, 3 μm,美国Hamilton 公司),Sa-10砷形态预处理前装置和AFS-830A 氢化物发生-双道原子荧光光谱仪 (北京吉天仪器设备有限公司),酶标仪型号为MC318(上海三科仪器有限公司) ,其余仪器为常规设备。试剂:去离子水(18 MΩ) 、砷酸钠、一甲基砷酸(MMA)、二甲基砷酸(DMA)等标准物质(德国Laboratories of Dr.Ehrenstorfer)、砷酸钠(Na-2HAsO-4)分析纯(湖南衡阳凤凰化学工业厂),大鼠甲基转移酶活性/含量测定分析试剂盒(美国Epigentek公司),凯基核蛋白和胞浆蛋白提取[谷胱甘肽(glutathione,GSH)含量]试剂盒(南京凯基生物科技发展有限公司),其余试剂均为分析纯的常规试剂。
1.3受试物与染毒方式以Na-2HAsO-4[iAs (Ⅴ)]为受试物,对照组用去离子水替代,采用喂饲法饮水经口染毒。砷酸钠高剂量为20 mg/kg,中剂量为6.7 mg/kg,低剂量为2.2 mg/kg。按此3个剂量配制并让受试大鼠自由进食饮水。染毒期间,通过参考大鼠每周平均体质量及日均饮水量并结合各组染毒剂量配制染毒水溶液,以确保饮水中的砷浓度不变。经此染毒3个月后处死大鼠并取大脑组织,用4℃生理盐水冲洗并用滤纸吸干水分并称其湿重。-80℃液氮中冷藏保存。
1.4待测样品的预处理量取1.0 mL不同价态不同剂量砷酸钠染毒组匀浆后的脑组织样品,置于不锈钢萃取池中。萃取条件:溶剂为1.0 mL甲醇,时间2 min×5,温度100℃,压力1 500 Psi;在40℃离心浓缩仪上将萃取液离心浓缩,浓缩至约1.0 mL后,用超纯水定容至1.0 mL,即为待测样液。得到的待测样液按HGAFS法分析条件经HPLC分离后定量分析。
1.5砷形态参数及相关酶水平分析方法待测样液按砷形态分析方法以标样、对照及低、中、高剂量组的顺序依次进样,通过HPLC-HGAFS法测定标准曲线,进而分离和测定脑中砷形态水平。脑组织砷形态分析洗脱液采用15 mmol/L的(NH-4)-2HPO-4溶液,流速为(pH=6.0)1.0 mL/min。HPLC-HGAFS仪器参数包括:载气400 mL/min,载流7%盐酸,负高压285 V,灯电流为80、36 mA,屏蔽气600 mL/min,还原剂0.35%NaOH和1.5%KBH-4溶液。按照相关试剂盒测定核蛋白(nucleoprotein)、胞浆蛋白(Cytoplasm protein)和谷胱甘肽(glutathione,GSH)含量及甲基转移酶(arsenic+3 oxidation statemethytransferase,As3MT)活力,严格按照试剂盒说明书进行操作。其中,GSH含量需经蛋白校正。并分析砷形态水平[一甲基化率(PMI)=(MMA+DMA)/TAs,二甲基化率(SMI)=DMA/(MMA+DMA)]。
1.6统计学处理采用SPSS16.0软件进行统计学分析,计量资料结果以均数±标准差(±s)表示,相关性分析采用Spearman法。经检验数据为非正态分布时,采用非参数检验进行相互比较和相关性分析,以P<0.05为差异有统计学意义。
2结果
2.1一般情况对照组大鼠生长发育及活动均正常,未见明显的异常行为。砷酸钠染毒组大鼠进食量以及饮水量都会随着染毒时间和剂量的增加而有所减少,并伴随体质重增长迟缓,活动减少,个别大鼠会出现皮肤潮红、被毛脱落、狂躁、相互撕咬等现象。与对照组比较,砷酸钠染毒组大鼠脑组织的脏体比差异无统计学意义。
2.2染砷大鼠脑中砷形态代谢产物水平染毒3个月后,各组大鼠脑组织中均未检测到iAs(Ⅴ);与对照组比较,砷酸钠染毒各剂量组大鼠脑中iAs(Ⅲ)和总砷含量升高(P<0.05);与对照组比较,砷酸钠染毒各剂量组随砷酸钠染毒剂量增加, PMI呈下降趋势,且差异具有统计学意义(P<0.05);砷酸钠染毒各剂量组大鼠脑组织中SMI整体上呈现下降趋势,但与对照组比较,除中剂量组外,其余剂量组均高于对照组(P<0.05),见表1。
2.3染砷大鼠脑中砷代谢相关酶水平各组大鼠在实验3个月后,随砷酸钠染毒剂量的增加,染毒组大鼠脑中GSSG含量呈现先升高后降低的趋势;而GSH含量则呈现先降低后升高的趋势。与对照组比较,低剂量砷酸钠染毒组大鼠脑中GSSG含量升高(P<0.05),而GSH含量下降(P<0.05);GST活力随砷酸钠染毒剂量升高而呈现升高趋势,且高剂量组高于对照组(P<0.05);砷酸钠染毒组大鼠脑中甲基转移酶活力逐渐下降,但各剂量砷酸钠染毒组中甲基转移酶活力均高于对照组(P<0.05),见表2。
2.4染砷大鼠脑中砷形态代谢产物与代谢酶相关性分析砷酸钠染毒组甲基转移酶活力与iAs(Ⅲ)%含量呈负相关(r=-0.714,P<0.05),与PMI和SMI均呈正相关(rPMI=0.714,rSMI=0.805,P<0.05);砷酸钠染毒组GSH含量与iAs(Ⅲ)%含量呈正相关(r=0.855,P<0.05),与PMI和SMI均呈负相关(rPMI=-0.855,rSMI=-0.858,P<0.05);砷酸钠染毒组GST活力与总砷含量呈正相关(r=0.530,P<0.05),见表3。
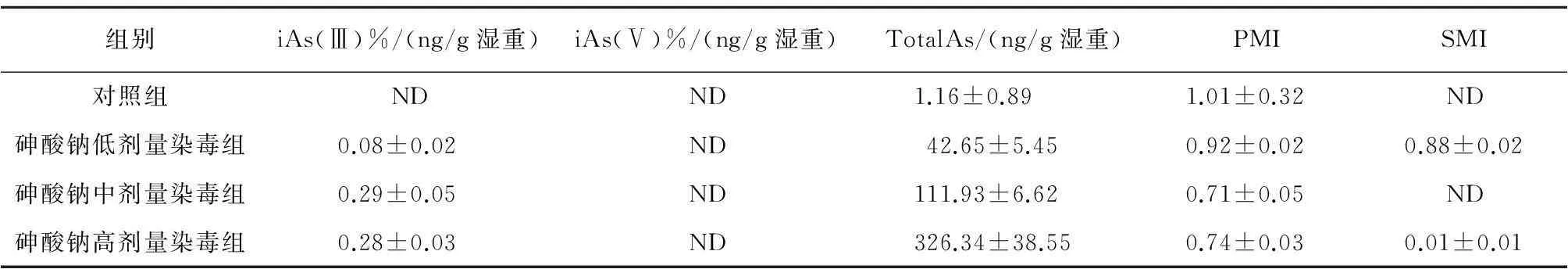
组别iAs(Ⅲ)%/(ng/g湿重)iAs(Ⅴ)%/(ng/g湿重)TotalAs/(ng/g湿重)PMISMI对照组NDND1.16±0.891.01±0.32ND砷酸钠低剂量染毒组0.08±0.02ND42.65±5.450.92±0.020.88±0.02砷酸钠中剂量染毒组0.29±0.05ND111.93±6.620.71±0.05ND砷酸钠高剂量染毒组0.28±0.03ND326.34±38.550.74±0.030.01±0.01
注:“ND”表示未检出; 与对照组比较,*P<0.05。

组别GSSG/(ng/L)甲基转移酶活力/(U/g)GSH含量/(mg/gprot)GST活力/(U/mgprot)对照组425.78±32.012.59±0.969.94±1.518.17±3.23砷酸钠低剂量染毒组476.52±12.2213.82±1.123.36±0.5410.52±1.25砷酸钠中剂量染毒组366.85±13.3510.66±1.058.72±1.3514.25±7.98砷酸钠高剂量染毒组396.25±38.217.78±1.2413.17±1.4318.91±3.54
注: 与对照组比较,*P<0.05。
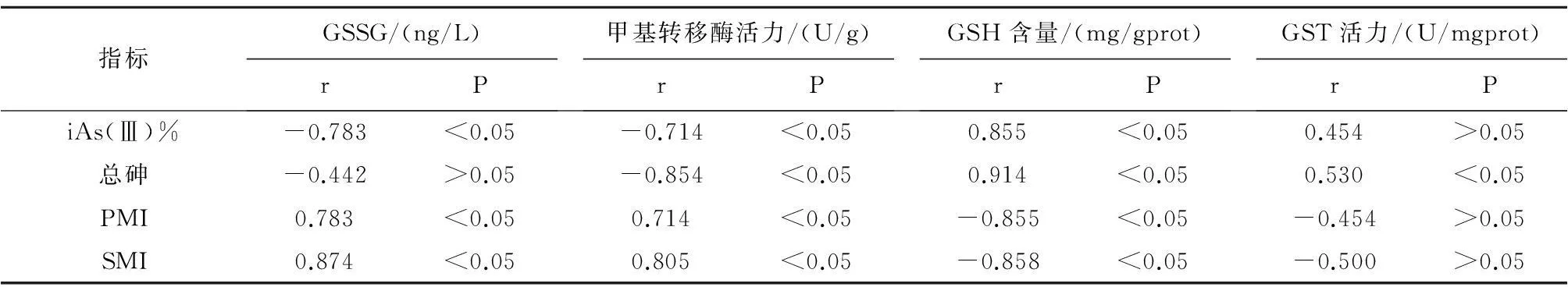
指标GSSG/(ng/L)rP甲基转移酶活力/(U/g)rPGSH含量/(mg/gprot)rPGST活力/(U/mgprot)rPiAs(Ⅲ)%-0.783<0.05-0.714<0.050.855<0.050.454>0.05总砷-0.442>0.05-0.854<0.050.914<0.050.530<0.05PMI0.783<0.050.714<0.05-0.855<0.05-0.454>0.05SMI0.874<0.050.805<0.05-0.858<0.05-0.500>0.05
3讨论
3.1砷暴露对砷代谢产物的影响诸多研究均表明,砷的摄入会影响其在体内的甲基化进程[3-4],砷在体内的毒性会通过甲基化进程调控代谢产物的构成以及代谢酶的活力来体现,有机砷代谢产物的毒性往往要高于无机砷,所以探讨砷毒性机制与研究砷甲基化代谢是密不可分的[5]。本研究结果显示,砷酸钠会促进脑中iAs(Ⅲ)和总砷含量增加,虽然PMI低于对照组,但DMA以及MMA的含量随剂量的升高而有所增加,且SMI高于对照组。提示砷酸钠会促进脑中无机砷含量的增加,且随外暴露剂量升高有增加趋势;与对照组比较,砷酸钠染毒导致砷二甲基化产物的累积增多,从而也会蓄积相对更多的甲基化产物,进而表明砷酸钠染毒对大鼠脑组织会有一定的毒性蓄积能力,并且对脑部神经产生毒性作用。
3.2砷暴露对砷代谢酶的影响在没有外界干扰的情况下,生物体内GSH和GSSG通常处于动态平衡状态。在砷代谢过程中,代谢产物可通过对谷胱甘肽还原酶和硫氧蛋白还原酶的强烈抑制作用,进而影响细胞维持正常的还原状态能力[6]。有研究表明即使摄入微量的砷,也会对体内氧化还原的平衡产生不同程度的影响,使脑脂质过氧化水平升高、 GSH浓度和抗氧化酶活力降低,从而使脑组织自由基受到损害,引起神经细胞异常凋亡[2,7]。本研究结果显示,砷酸钠低剂量染毒组大鼠脑组织中GSSG含量高于对照组、 GSH含量低于对照组,表明低剂量砷酸钠染毒会对GSSG有一定的促进作用以及对GSH产生抑制作用,从而打破GSH和GSSG之间的动态平衡,造成正常的还原状态能力降低而对脑组织产生毒性蓄积作用。本研究结果还发现,各剂量砷酸钠染毒组大鼠脑组织中甲基转移酶的活力均高于对照组,且低剂量砷酸钠染毒对大鼠脑中甲基转移酶活力的促进更为明显,提示砷酸钠在脑组织中有具有一定的砷代谢能力,同时也说明砷酸钠在脑组织中的代谢更为彻底和全面。
3.3脑砷代谢与砷毒性关系有研究显示,成年大鼠的血脑屏障可以阻止iAs(Ⅴ)进入脑中,但部分的DMA会通过成年大鼠的血脑屏障[8];也有研究认为,肝、肾等脏器砷蓄积最为严重,可能是由于砷经肝、肾代谢导致。虽然脑组织中砷浓度最低,但表明仍有部分可通过血脑屏障而对不同区域脑组织造成实质性无法恢复的伤害[9]。本研究结果显示,脑组织中的砷形态代谢产物主要是DMA,且DMA含量随砷酸钠染毒剂量的升高而升高,表明DMA可透过血脑屏障进入脑组织。提示iAs(Ⅴ)甲基化代谢产物可进入脑组织并对其产生毒性影响,且脑组织中砷代谢相关酶含量、活力及代谢酶与代谢产物相关系数会随砷酸钠染毒剂量的改变而改变,提示砷酸钠会通过血脑屏障,并且脑组织具有砷代谢能力,这与金亚平等[10]研究得出的结论一致。相关研究已表明砷酸钠会通过血脑屏障引起大鼠脑皮质活性以及递质浓度发生改变,可能会导致中枢神经系统紊乱,引起神经行为功能异常,从而影响听觉、视觉、应激反应等基本能力,对脑组织记忆功能、神经行为功能损害明显,进而使大鼠的行为习惯发生不同程度的改变,影响其大脑生长发育[11-13]。
人群流行病学调查也有类似报道,地方性砷中毒病区长期饮用含砷水的儿童智商均值较全国农村儿童智商理论分布值略低,长期记忆力和语言能力都有所下降,说明病区儿童智力发育存在障碍,智力受到了不同程度的损伤[14]。
综上所述,本研究结果表明,低剂量砷酸钠染毒会打破脑组织中GSSG与GSH的动态平衡,造成脑组织的氧化损伤,砷酸钠染毒后其代谢产物在脑组织中可能具有一定的蓄积能力。至此,砷致神经毒性机制目前研究还不是很清楚,关于砷代谢与砷毒性机制的关系还需深入研究。
参考文献:
[1]李玉飞,康朝胜,藏贵勇,等. 慢性砷中毒对大鼠海马CA3超微结构的影响[J]. 环境与健康杂志, 2008, 25(6):517-519, 封3.
[2]杨光,李秋娟,叶建新,等. 低剂量砷暴露小鼠脑组织核酸损伤的免疫组织化学观察[J]. 毒理学杂志, 2007, 21(1):43-45.
[3]吴军,吴顺华,姜平,等. 不同价态无机砷染毒大鼠尿液砷形态代谢产物构成比分析研究[J]. 新疆医科大学学报, 2010, 33(4):331-334.
[4]吴军,师喆,郑玉建,等. 不同价态砷对DNA和砷甲基转移酶的影响[J]. 环境与健康杂志, 2012, 29(1):20-25.
[5]Kitchin KT. Recent advance in Arsenic carcinogenesis:mode of action,animal model system,and methylated Arsenic metabolites[J]. Toxicol Appl Pharmacol, 2001, 172:249-261.
[6]Jomova K, Jenisova Z, Feszterova M, et al. Arsenic:toxicity, oxidative stress and human disease[J]. J Appl Toxicol, 2011, 31(2):95-107.
[7]高怡,仇玉兰,田凤洁,等. 饮水砷暴露大鼠血砷、尿砷和组织砷含量测定分析[J]. 山西医科大学学报, 2011, 42(1):33-36.
[8]张军,王艳,金亚平,等. 经母体砷暴露仔鼠肝和脑组织砷形态检测分析[J]. 中国工业医学杂志, 2011, 24(2):125-126.
[9]杨东焱,梁超轲. 砷对大脑毒性的研究进展[J]. 卫生研究, 2003, 32(3):272-275.
[10]金亚平,李昕,陆春伟,等. 饮水砷暴露小鼠肝和脑组织多形态砷检测分析[J]. 中国地方病学杂志, 2005, 24(2):137-139.
[11]蒋鸫,孙宝飞. 慢性砷中毒对小鼠海马CA1区星形胶质细胞的影响[J]. 局解手术学杂志, 2011, 20(3):239-241.
[12]赵凤红,王艳,孙迪,等. 饮水砷暴露对儿童视觉简单反应时及联合型瑞文IQ值的影响[J]. 环境与健康杂志, 2009, 26(12):1037-1038.
[13]朱筑霞,潘玮炜,易必达,等. 砷致大鼠海马神经细胞凋亡对学习记忆功能的影响[J]. 贵州医药, 2010, 34(9):777-780.
[14]李军,王三祥,王正辉,等. 砷中毒病区儿童智力水平调查[J]. 中国公共卫生, 2006, 22(7):856-857.
(本文编辑王艳)


