不同动物皮肤对黄体酮乳膏体外经皮透过性的比较
通信作者:高晓黎,女,教授,博士生导师,研究方向:新药研究,E-mail:xli_g@126.com。
不同动物皮肤对黄体酮乳膏体外经皮透过性的比较
陶虹1,2, 刘争光3, 周湘龙1, 高晓黎1
(1新疆医科大学药学院, 乌鲁木齐830011;2新疆维吾尔自治区食品药品检验所, 乌鲁木齐830002;3新疆农业大学, 乌鲁木齐830002)
摘要:目的考察黄体酮乳膏在不同动物离体皮肤中的透皮吸收性能。方法选用小鼠、大鼠、豚鼠、家兔、比格犬和小型猪的离体皮肤,采用Franz扩散池法,用高效液相色谱法测定接收液中的黄体酮含量,并进行不同模型的拟合。结果黄体酮乳膏透皮动力学行为符合一级动力学模型。小鼠腹部皮肤对黄体酮的稳态透皮速率(Js)为(8.854 3±0.741 1) μg·cm-2·h-1,在6种动物皮肤中最高,与其他5种动物皮肤的稳态透皮速率差异均有统计学意义(P均<0.05)。结论选择小鼠腹部皮肤作为体外透皮吸收实验模型时,黄体酮乳膏的透皮吸收效果最好。
关键词:黄体酮; 体外透皮吸收; 动物腹部皮肤; 高效液相色谱法
基金项目:乌鲁木齐市高新区创新基金(CX10208W)
作者简介:陶虹(1975-),女,在读博士,副主任药师,研究方向:药物新剂型。
中图分类号:R944
doi:10.3969/j.issn.1009-5551.2015.03.011
[收稿日期:2014-06-01]
Comparison of transdermal pemeability of progesterone cream on
different animals′ skin
TAO Hong1,2, LIU Zhengguang3, ZHOU Xianglong1, GAO Xiaoli1
(1XinjiangMedicalUniversity,Urumqi830011,China;2InstituteForFoodandDrug
ControlofXinjiangUygurAutonomousRegion,Urumqi830004,China;3XinjiangAgriculture
University,Urumqi830052,China)
Abstract:ObjectiveTo investigate the transdermal permeability of progesterone cream on different animals′ skin, and suggest the suitable animal′s skin for prescription screening. MethodsFranz diffusion cell and HPLC were used to detect the concentration of progesterone in receiving solution. ResultsAbdominal skin of rats had the best effect of the transdermal penetration of progesterone; the 24 h-accumulated permeation of progesterone reached the maximum and percutaneous rate was the highest. ConclusionAbdominal skin of rats is the most suitable model for proscription screening of transdermal progesterone delivery system.
Key words: progesterone; percutaneous permeability; abdominal skin of animals; high efficiency liquid chromatography
黄体酮是一种天然孕激素类药物,使用已有50多年的历史,其被广泛应用于临床治疗先兆流产、习惯性流产、月经不调、子宫功能性出血、子宫内膜异位等妇产科疾病,是目前激素替代治疗中较理想的孕激素[1-3]。此外,其也应用于体外受精作用中的黄体支持[4]和非妇产科疾病中,如输卵管结石、肾绞痛、胆总管结石与胆绞痛、前列腺增生症、食管癌等疾病的辅助治疗[5-6]。黄体酮常用剂型为口服胶囊和油溶注射剂,口服制剂首过效应比较强,油溶注射剂长期注射易造成疼痛和硬节[7-8]。因此近年来不断探索其他的给药途径。黄体酮分子量为314.47 Da,脂溶性强,是一种较为理想的透皮给药候选药物,因此目前国内外对黄体酮透皮给药系统均有研究[9-10]。经研究证实,黄体酮经皮下、直肠、阴道给药后均可被吸收[11]。透皮吸收制剂可以避开胃肠道降解和肝首过效应,并且可提高用药的安全性。国外的同类产品有黄体酮脂质体霜、黄体酮脂质体身体乳、女性乳膏、女性更年期乳霜、天然黄体酮身体乳、妇女平衡霜、孕酮霜等[12-20],但目前国内尚未有同类上市产品。本研究将自制的黄体酮水包油型乳膏,采用改良Freeze扩散池法进行体外透皮扩散实验,收集不同时间点的接受液,用HPLC法测定接受液中黄体酮浓度,计算累计渗透量并对不同方程进行拟合,并比较常用的小鼠、大鼠、豚鼠、兔、比格犬和小型猪6种实验动物的离体皮肤对黄体酮乳膏的透过特性,以期为黄体酮透皮吸收制剂的开发提供理论依据。
1动物、仪器与材料
1.1实验动物小鼠10只,体质量(25±5) g,许可证号SYXK(新)2010-0003;大鼠10只,体质量(140±20)g, 许可证号SYXK(新)2010-0003;家兔1只,体质量2.5 kg,许可证号SYXK(新)2010-0002;豚鼠2只,体质量(220±20)g;比格犬1只,体质量10 kg,许可证号SYXK(新)2010-0001;实验用小型猪1只,体质量20 kg。实验动物均购自新疆医科大学实验动物中心,均为雌性动物。
1.2仪器与材料TP-3 型智能透皮扩散仪(南京新联电子设备有限公司),岛津LC-2010AHT高效液相色谱仪(日本岛津公司),Saterus AE200 电子天平(瑞士梅特勒-托利多公司)。自制黄体酮乳膏(批号:20121004,规格:2%),空白基质(批号:20100501),黄体酮对照品(中国药品生物制品检定所,批号:100027-200307),甲醇、乙腈和乙醇均为色谱纯,其余试剂为分析纯。
1.3方法
1.3.1实验动物离体皮肤的制备小鼠:腹部涂抹脱毛剂,15 min后用温水洗净,正常饲养24 h后处死,取腹部皮肤。大鼠、豚鼠、家兔、比格犬和实验用小型猪: 均在处死后立即用电动剃须刀将腹部毛剃除,取腹部皮肤。小心剪除皮下脂肪后反复用生理盐水清洗干净,切割成合适的小块皮肤置-20℃冰箱冷冻保存。
1.3.2体外透皮实验从冰箱中取出实验动物皮肤,置生理盐水中30 min自然解冻。将皮肤置于扩散池上固定,角质层向上,真皮层面向接受池。用滤纸吸干皮肤表面的水分,将自制的黄体酮乳膏均匀涂抹在皮肤表面。接收液温度为37℃,电磁搅拌速度为200 r/min,扩散面积为1.3 cm2。分别于1、2、4、6、8、24 h取样1 mL,同时补充同温的接收液1 mL。样液均经0.22 μm微孔滤膜过滤后进行高效液相色谱分析,检测结果按下式计算各时间点的累计透过量Q(μg/cm):

[Cn:t 时间浓度的测量值(μg/mL);Ci:t 时间以前浓度的测量值(μg/mL);Vo:接收液的总体积(mL);Vi:每次取样的体积(mL);A:扩散池面积(cm2)]。
1.3.3不同接收液的比较黄体酮属于甾体激素、脂溶性物质,在水中微溶。接收液中可加入聚乙二醇(PEG)作为甾体激素的助溶剂,或在接收液中加入乙醇均会大大增加甾体激素的溶出[21]。比较黄体酮乳膏分别以15%PEG+20%乙醇+生理盐水和20%乙醇+生理盐水为接收液的透皮效果。
1.3.4空白对照取空白乳膏均匀涂抹在固定好的离体皮肤表面,按照“1.3”项下进行实验,测定接受液的吸收值,监测实验过程中空白乳膏的影响,以减少实验误差。
1.3.5高效液相色谱法色谱柱为Waters 5C18-MS-Ⅱ(4.6 mm×250 mm,5 μm),柱温30℃,检测波长为245 nm,流动相为甲醇∶水(75∶25),流速为1.0 mL/min。
标准曲线制备:分别精密量取500 μg/mL黄体酮储备液适量,用20%乙醇生理盐水稀释成一系列对照溶液,0.22 μm 滤膜过滤入进样小瓶,进样20 μL。以黄体酮主峰峰面积为纵坐标,对照溶液浓度为横坐标,进行线性回归,标准曲线方程为:A=75 321C-4 173.3,线性范围为0.033~22.2 μg/mL(r=0.999 9),最低检测限为22 ng/mL。低、中、高3个浓度的方法回收率分别为100.7%、98.7%和98.4%。黄体酮主峰保留时间为10.903 min,与相邻杂质分离度>1.5。系统适用性实验和小鼠24 h透皮接收液的高效液相色谱图见图1、2。
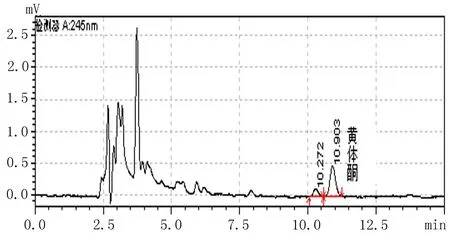
图1 系统适用性实验
1.4统计学处理采用SPSS16.0软件进行单因素方差分析统计,数据采用均数±标准差(±s)表示,检验水准α=0.05。
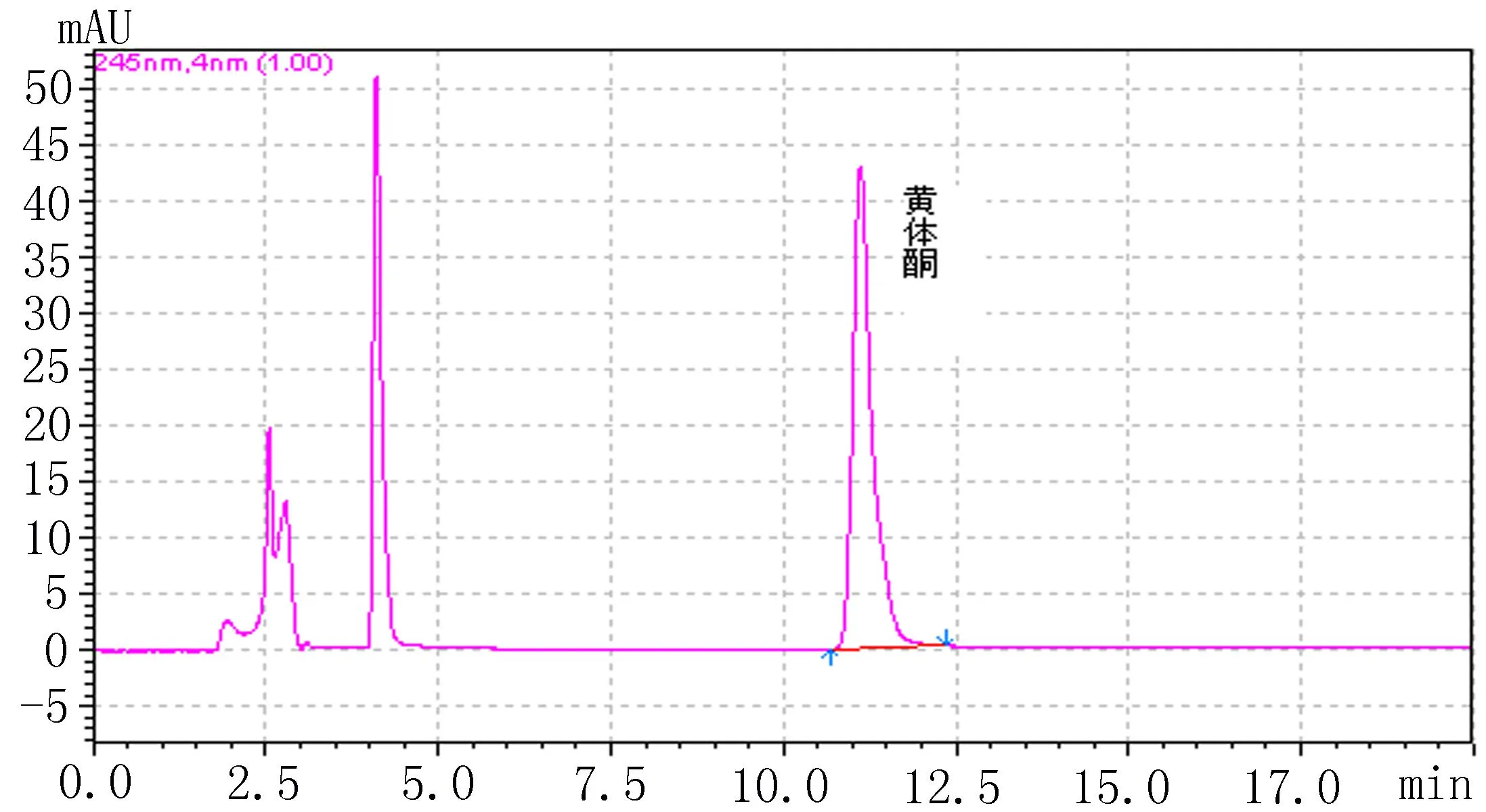
图2 小鼠24 h透皮接收液
2结果
2.1不同接收液的比较结果2种接受液均符合漏槽条件。以15%聚乙二醇+20%乙醇+生理盐水作为接收液的累计渗透曲线方程为Q=7.696 6t-8.746 0,r=0.998 5;以20%乙醇+生理盐水作为接收液的累计渗透曲线方程为Q=8.854 3t-14.606 7,r=0.996 5。两组数据间差异无统计学意义,说明本实验中聚乙二醇的加入并没有增加黄体酮的稳态透皮速率(Js),但增加了接收液的粘度,故选择20%乙醇+生理盐水为接收液。
2.2体外透皮实验结果根据公式计算出黄体酮透过小鼠、大鼠、豚鼠、家兔、比格犬和小型猪腹部皮肤的累计渗透量。分别以一级动力学、Higuchi方程、Hixcon-Crowell方程和 Riteger-Peppas 方程进行拟合,拟合方程的优劣按照 R值判断,一级动力学方程拟合的相关系数均>0.98,相对于其他3种方程的相关系数分布更均匀,表明黄体酮的体外渗透过程更符合一级动力学。所得的直线斜率为稳态透皮速率(Js),在横坐标上的截距为药物透皮吸收的时滞Tlag(h),结果见表1。

表1 6种动物皮肤透皮吸收的方程拟合
黄体酮乳膏透过6种动物皮肤的稳态透皮速率大小顺序依次为:小鼠>豚鼠>家兔>大鼠>比格犬>小型猪。对6种动物皮肤的稳态透皮速率进行单因素方差分析,结果小鼠与其他动物皮肤的稳态透皮速率差异均有统计学意义(P均<0.05);大鼠与豚鼠和家兔的稳态透皮速率差异无统计学意义(P均>0.05);比格犬与小型猪差异无统计学意义,而比格犬和小型猪与其他4种动物的稳态透皮速率差异均有统计学意义(P均<0.05)。
2.3动物腹部的离体皮肤厚度实验过程中发现不同种类动物皮肤厚度差异较大,除了大鼠和家兔以外,药物在皮肤中的稳态透皮速率大小随着皮肤厚度的增加而减小。6种动物离体皮肤的稳态透皮速率及厚度测量结果见表2。
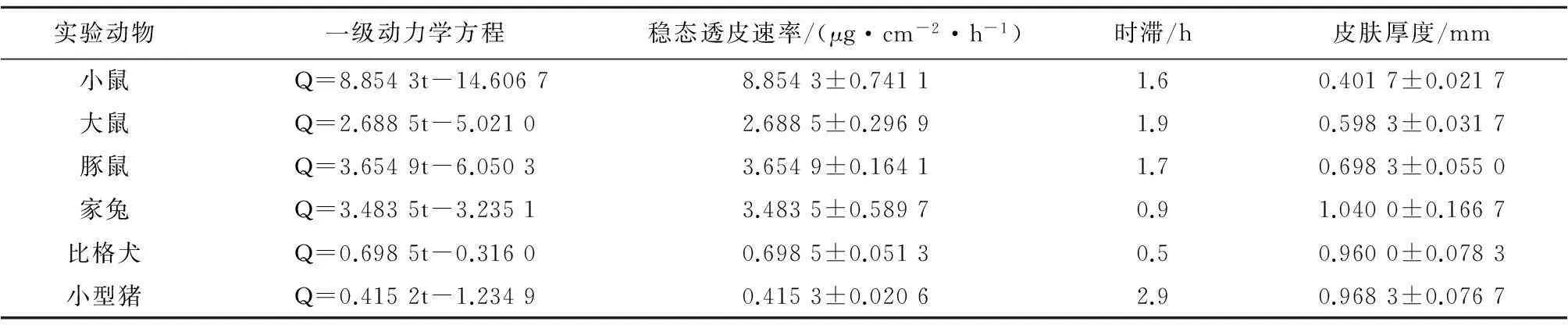
实验动物一级动力学方程稳态透皮速率/(μg·cm-2·h-1)时滞/h皮肤厚度/mm小鼠Q=8.8543t-14.60678.8543±0.74111.60.4017±0.0217大鼠Q=2.6885t-5.02102.6885±0.29691.90.5983±0.0317豚鼠Q=3.6549t-6.05033.6549±0.16411.70.6983±0.0550家兔Q=3.4835t-3.23513.4835±0.58970.91.0400±0.1667比格犬Q=0.6985t-0.31600.6985±0.05130.50.9600±0.0783小型猪Q=0.4152t-1.23490.4153±0.02062.90.9683±0.0767
3讨论
体外透皮实验最理想的皮肤是人的皮肤,因为用其求出的参数最接近临床实际,但是人的皮肤来源少,很难获得,所以选用合适的动物皮肤来研究透皮吸收具有重要的意义。
有较多文献报道猪的皮肤特性与人的最为接近[22]。猪皮肤中的汗腺是顶泌汗腺,分布于真皮和脂肪相接的真皮深层。研究表明,巴马小型猪与人的真皮厚度、表皮厚度和真皮/表皮厚度比值上没有统计学差异[23],所以本研究亦选用了小型猪的腹部皮肤,从猪的实验参数可以大致推断出黄体酮在人皮肤上的渗透情况,为预测人体对黄体酮的吸收提供理论参考。
豚鼠和家兔皮肤非常敏感,常用于皮肤致敏和刺激实验;大鼠常用于药理的急性毒性、长期毒性以及药效学实验;小鼠和大鼠是最常用的实验动物,皮肤最易得,因此常用于透皮吸收制剂处方的筛选。故本研究考察了黄体酮乳膏在这几种动物皮肤的透过性差异。小鼠皮肤对黄体酮乳膏的稳态透皮速率最快,所以对处方中的成分改变会较其他5种动物皮肤敏感。比格犬和小型猪皮肤的稳态透皮速率均较低,不适合作为黄体酮透皮制剂处方筛选的动物模型,但其数据可以作为人体透皮吸收过程的参考。目前透皮吸收制剂体内药动学研究多选择小型猪为实验动物,因此本研究结果也为黄体酮乳膏分析体内外吸收相关性奠定了基础。本研究结果也可为与黄体酮化学性质相近的物质在不同动物皮肤中的透过性提供参考。
参考文献:
[1]龚蔚,乔育屏.安宫黄体酮用于药物流产后阴道流血98例临床观察[J].山东医药,2010,50(13):18-19.
[2]古丽巴哈尔·卡吾力,高晓黎.黄体酮在更年期综合症治疗中的应用[J].新疆医科大学学报,2006,29(6):550-551.
[3]Helene BL, Santo L, James NA. Transdermal progesterone cream for vasomotor symptoms and postmenopausal bone loss[J]. Obstet Gynecol,1999,94:225-231.
[4]张韶珍,陈骞,冯云.黄体酮胶囊在体外受精治疗中的黄体支持作用[J].中国优生与遗传杂志,2009,17(11):101-102.
[5]张方红,安详.黄体酮治疗肾及输尿管结石治疗分析[J].中国医药论坛,2005,3(11):85-88.
[6]白大春,胡文启,杨言春,等.黄体酮承山穴注射治疗肾绞痛478例报告[J].中国医学理论与实践,2006,16(8):963-965.
[7]孙青苗,金彦,陈捷,等.肌肉注射黄体酮致局部不良反应相关因素分析[J].中国药物应用与监测,2009,6(5):300-302.
[8]薛惠英,唐玉珠,姜萍.黄体酮胶丸两种不同给药方式在促排卵周期黄体支持中的作用比较[J].中国优生与遗传杂志, 2010,18(11):112-115.
[9]俞佳,梁文权,金一.黄体酮透皮给药系统体外经皮渗透特性的研究[J].中国临床药理学与治疗学,2006, 11(8):907-910.
[10]Claudia V, Alexandra W,Andreas E. Clausen, and Andreas Bernkop Schnu rch,Thiolated Polymers: Development and Evaluation of Transdermal Delivery Systems for Progesterone[J].Pharm Res, 2011,18(2):211-216.
[11]Wren BG, McFarland K, Edwards L, et al. Effect of sequential transdermal progesterone cream on endometrium bleeding pattern and plasma progesterone and salivary progesterone levels in postmenopausal women[J]. Climacteric, 2000, 3(3):153-154.
[12]Gambrell R, Don MD. Progesterone skin cream and measurements of absorption[J]. Menopause , 2003, 10(1):1-3.
[13]Oleary P, Feddema P, Chan K, et al. Salivary?but not serum or urinary levels of progesterone are elevated after topical application of progesterone cream to pre-and postmenopausal women[J]. Clin Endocrinol, 2000, 53(5):615-620.
[14]Stanczyk FZ, Paulson RJ, Roy S. Percutaneous administration of progesterone:blood levels and endometrial protection[J]. Menopause, 2005, 12(2):232-237.
[15]Hermann AC, Nafziger AN, Victory J, et al. Over-the-counter progesterone cream produces significant drug exposure compared to a food and drug administration-approved oral progesterone product[J]. J Clin Pharmacol, 2005, 45(6):614-619.
[16]Arvind V, Fred W, Adam C, et al. Bleeding profiles and effects on the endometrium for women using a novel combination of transdermal oestradiol and natural progesterone cream as part of a continuous combined hormone replacement regime[J]. An Int J Obstet Gynaecol, 2005, 112(10):1402.
[17]Leonetti Helene B, Longo Santo, Anasti James N. Transdermal Progesterone Cream for Vasomotor Symptoms and Postmenopausal Bone Loss[J]. Am Coll Obstet Gynaecol, 1999, 94(2):225-228.
[18]Holzer G, Riegler E, Honigsmann H, et al. Effects and side-effects of 2% progesterone cream on the skin of peri- and postmenopausal women[J]. Br J Dermatol, 2005, 153(3):626-634.
[19]Vignali M, Centinaio G. Efficacy of the vaginal administration of natural progesterone in patients with recurrent spontaneous hormone caused abortion[J]. Minerva Ginecol, 2005, 52(9):367-374.
[20]Madelon LF, Maurice C, Heather M. Treatment Options for the menopausal Woman[J]. Spine, 2001, 26(2):5-7, 11-15.
[21]靳阳,李建民.黄体酮透皮吸收研究[J].南开大学学报,1997,30(4):21-25.
[22]陈俊颖,胡俊西,魏泓.人与巴马香猪皮肤的比较生物学研究[J].中国比较医学杂志, 2006,16(5):288-290.
[23]郑必祥,彭代智,左海斌,等.巴马小型猪与人真皮的组织形态学和生物力学基本特征比较研究[J].第三军医大学学报,2010,32(8):754-758.
(本文编辑施洋)

