低桔霉素且产Monacolin K红曲菌株的筛选与鉴定
刘 颖,林 风,郑军荣,陈利丁,高振云,李志强,王海龙,王焌翔,吴丽云
(1.福建省微生物研究所;2.福建省新药(微生物)筛选重点实验室,福建福州350007)
红曲是以大米为原料,由红曲菌繁殖而来的一种米曲,其已广泛应用于食品酿造和食用色素方面[1].随着现代科学技术的发展,红曲活性次级代谢物质的功能已成为研究热点.其中,莫纳可林K(Monacolin K)是胆固醇合成关键酶HMG-CoA的还原酶抑制剂,能阻断胆固醇的合成,进而调节人体内的异常血脂,治疗高血脂[2].天然发酵红曲中的Monacolin K由酸式和内酯式2种结构组成(以酸式结构为主),酸式Monacolin K 无需水解即可直接发挥降血脂功能[3];仅 0.001-0.005 μg·mL-1Monacolin K 即可使胆固醇的合成受阻[4],半致死剂量为1000 mg·kg-1(口服),是目前各国公认的降胆固醇的理想药剂.
由于红曲代谢过程中会产生具有肾毒素和潜在的致畸性的桔霉素,严重影响红曲的应用.因此,采用优化发酵、菌种筛选等技术研发高产Monacolin K且低产甚至不产桔霉素的功能性红曲成为其产业化生产技术革命的致高点[5].许赣荣等[6]通过自然筛选找到一株低桔霉素的红曲菌,其发酵产物中酸式Monacolin K的比例大于60%;吴祖芳等[7]经过复合诱变处理得到不产桔霉素红曲菌变异株;Fu et al[8]从分子生物学水平上对红曲菌进行基因工程改造,得到了理想的桔霉素基因敲除菌株,其桔霉素含量可下降98%左右.
福建省是我国红曲的主要传统生产地,但目前福建省内的红曲产品以色曲为主,有关功能性红曲产品的研究及开发尚未见报道.因此,本试验对福建省古田地区不同来源的红曲米和红曲粉进行分离纯化,利用形态学观察、固态发酵和HPLC检测,筛选产Monacolin K且桔霉素含量低的红曲菌株,并对其进行初步鉴定,为后期的工业开发奠定基础.
1 材料与方法
1.1 试验材料
1.1.1 红曲样品 从福建古田地区收集不同来源的红曲米和红曲粉.
1.1.2 试剂 内酯式Monacolin K(即洛伐他汀)标准品(批号:100600201003)购自中国食品药品检定研究所,含量为99.4%;甲醇、乙腈、磷酸均为色谱纯;其他试剂为分析纯.
1.1.3 培养基 种子培养基:葡萄糖 5 g,蛋白胨 1.5 g,酵母粉 1.0 g,硫酸镁 0.05 g,磷酸二氢钾 0.1 g,硝酸钠 0.3 g.
固体发酵培养基:将50 g大米浸泡过夜,沥干装入500 mL三角瓶中,蒸熟后搅拌至松散再经121℃灭菌30 min.
1.2 试验方法
1.2.1 红曲的分离纯化 将不同来源的红曲米置于无菌研钵中研磨成红曲粉末.取0.5 g红曲粉末加入10 mL无菌水,梯度稀释,分别吸取0.1 mL不同浓度稀释液涂布于PDA分离平板上,30℃培养.挑取单菌落转接至试管斜面培养.若菌落不纯再按上述方法反复进行分离纯化,至出现纯净的红曲霉菌落为止.
1.2.2 红曲的筛选 根据红曲在PDA分离培养基上形成单菌落颜色的深浅,初筛时挑选产生色素较少、颜色较浅的菌落转接斜面,30℃培养7 d.复筛需将初筛挑选出的菌株分别进行固态发酵,发酵时间25-30 d.通过HPLC检测发酵产物中酸式和内酯式Monacolin K的含量,从而筛选出能合成Monacolin K的红曲菌株.
1.2.3 固态发酵 用无菌水冲洗红曲菌斜面孢子至带玻璃珠的三角瓶中,再用玻璃珠将孢子打散制成106cfu·mL-1孢子悬液.以2%接种量将菌悬液接入种子培养基中,30 ℃、120 r·min-1振荡培养48 h.将生长好的种子液以10%接种量转接于固体培养基中,将培养温度由30℃逐步降至24℃,变温发酵至第26天结束.
1.2.4 分析方法 样品处理:参照文献[9]的方法进行处理.
酸式Monacolin K标准品的制备:参照文献[9]的方法并进行适当调整.用少量乙腈溶解,同时用0.1 mol·L-1NaOH调节不同pH,并延长超声时间至2 h,过滤后于4℃保存,作为HPLC检测时的定性标准品待用.
HPLC 检测条件[10]:色谱柱为 Kromasil C-18、5 μm、250 mm×4.6 mm,柱温 28 ℃,流动相 V乙腈∶V0.1g·dL-1磷酸水溶液=65 ∶35,紫外检测器波长为 238 nm.
桔霉素检测:将发酵样品送福建省疾病预防控制中心检测.
1.2.5 菌落的形态观察 将同一红曲单菌落分别点板接种于 Wa、MEA、CYA、G25N平板培养基[11]上,25℃培养7 d,观察菌落形态、颜色[12]、大小等.
用接种针在红曲试管斜面上取少量孢子分别于Wa、MEA、CYA、G25N平板培养基[11]上划线,将无菌盖玻片斜插入培养基中,于25℃倒置培养.分别于4、7 d后,用无菌镊子将粘有菌丝的盖玻片小心取下,快速经火焰干燥,将盖玻片固定于一块干净的载玻片上,并在40×10倍显微镜下观察红曲(菌丝、分生孢子、闭囊壳等)形态特征[13-14].
1.2.6 红曲菌的分子生物学鉴定 红曲菌总DNA的提取参照文献[15].采用ITS通用引物进行PCR扩增,ITS的正向引物为ITS1:5'-TCC GTA GGT GAA CCT GCG G-3',反向引物为ITS4:5'-TCC TCC GCT TAT TGA TAT GC-3'.引物由上海生工生物工程有限公司合成.PCR扩增ITSl-5.8SrDNA-ITS2基因区域,所得产物送上海立菲生物技术有限公司测序.将测序结果用Blast软件在GenBank数据库中进行相似性比较,选取同源性较高的菌株的ITSl-5.8SrDNA-ITS2区域序列作为参比对象.用ClustalX软件按照最大同源性原则进行多序列比对.采用MEGA软件包构建系统发育树.
2 结果与分析
2.1 红曲菌株的分离纯化
对不同来源的红曲米和红曲粉进行分离纯化后,根据其在PDA分离培养基上生长的形态和颜色,共挑选出6种红曲菌,共计96株.
在PDA分离培养基上30℃培养48 h,平板上出现白色单菌落;72 h单菌落增大的同时开始变色,呈现不同颜色;4 d后部分单菌落颜色继续加深,部分菌落背面出现放射状皱褶;继续培养至7 d后,不同菌落形态分化较明显,主要形态特征如表1所示(颜色描述参照文献[12]).

表1 红曲菌的形态分类Table 1 Different morphologies of Monascus
2.2 Monacolin K 的检测
2.2.1 酸式Monacolin K的制备 在一定的碱性条件下,内酯式Monacolin K可水解成为酸式Monacolin K.但若碱性太强,酸式 Monacolin K 可进一步水解[16].按照文献[9]制备酸式Monacolin K标准品,溶液pH>13,内酯式Monacolin K水解生成其他杂质,酸式Monacolin K转化率降低.同时,由于内酯式Monacolin K不溶于水,在转化反应结束后的水溶液中仍有部分不溶的针状固体.经HPLC检测,不溶针状固体为内酯式Monacolin K,制备液中酸式Monacolin K含量低,且有不明杂质峰出现于3.5 min(图1).
本试验在配制内酯式Monacolin K时添加了少量乙腈助溶,减少了碱浓度,降低了溶液pH;同时提高超声转化的时间,有利于内酯式Monacolin K充分水解为酸式Monacolin K.在相同处理条件,随着溶液pH的增大,Monacolin K的生成率也相应升高.当溶液pH为10左右,Monacolin K转化率达到最高(图2).经HPLC-MS鉴定,生成物质的分子质量与酸式Monacolin K分子质量一致(图3).此外,经HPLC检测,酸式和内酯式Monacolin K能够很好地分离,保留时间分别为9.5和 15.46 min(图 4).

图1 pH>13时溶液中的不明杂质峰Fig.1 The unknown impurity peak in the solution at pH>13
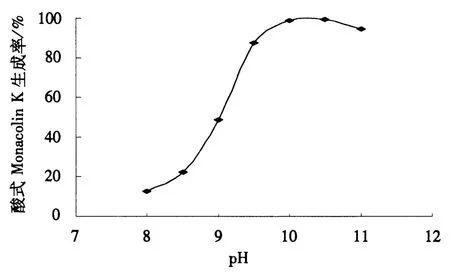
图2 不同pH下酸式Monacolin K的生成率Fig.2 The formation rate of acid form Monacolin K at different pH
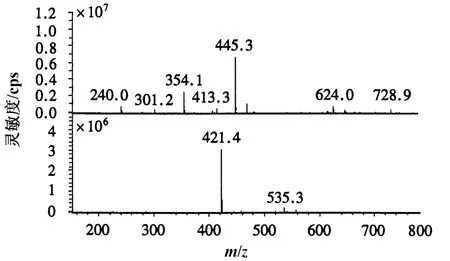
图3 酸式Monacolin K的MS检测结果Fig.3 The result of MS detection for acid form Monacolin K
2.2.2 复筛菌株Monacolin K的含量 通过对复筛的红曲菌种进行大米固体发酵,HPLC检测发酵产物,得到一株产Monacolin K的红曲菌株NW3-2.经检测,该菌株发酵产物的桔霉素含量低于最低检测限16.0 μg·kg-1(图5-6),发酵合成的总Monacolin K含量为5.67 mg·g-1,其中,酸式和内酯式 Monacolin K 含量分别为3.20和 2.47 mg·g-1(图 7).
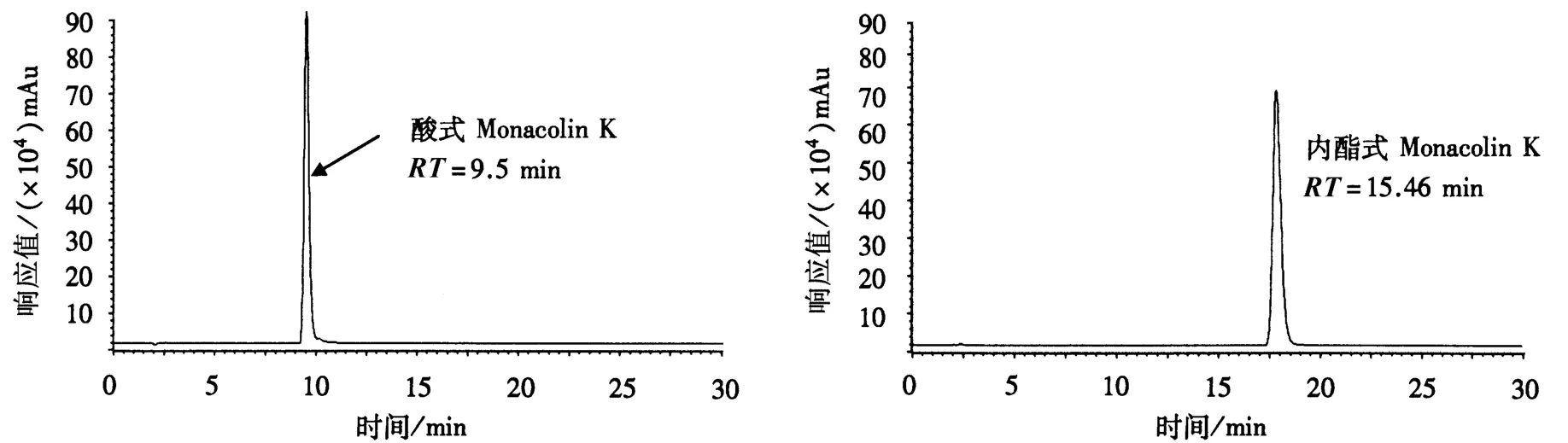
图4 酸式和内酯式Monacolin K的HPLC图谱Fig.4 The HPLC result of acid form and lactone form Monacolin K

图5 NW3-2发酵样品中桔霉素检测的HPLC图谱Fig.5 The HPLC result of citrinin in the fermentation products of NW3-2
2.3 红曲菌落的形态特征
表2为复筛挑选出的红曲菌NW3-2在Wa、MEA、CYA、G25N培养基上25℃培养7 d形成的菌落特征.参考中国科学院微生物研究所保存的11种红曲典型种的综合描述[11],结合其在G25N培养基上的生长状况,初步排除红曲菌株NW3-2是红色红曲、橙色红曲、发白红曲、苍白红曲和血红红曲的可能.
2.4 红曲菌在不同培养基上的显微形态特征
红曲的个体形态包括菌丝、无性世代和有性世代.由表3可知,在Wa、MEA培养基上的菌丝显微形态较相似,以有性繁殖形成闭囊壳为主,分生孢子偶见;在CYA、G25N培养基上以无性繁殖形成分生孢子为主.
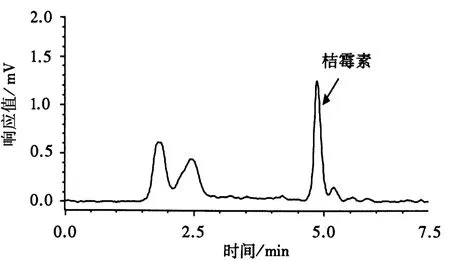
图6 桔霉素添加到发酵样品中的HPLC图谱Fig.6 The HPLC result of citrinin added to the fermentation sample

图7 NW3-2红曲发酵产物HPLC图谱Fig.7 The HPLC result of the fermentation products of Monascus NW3-2

表2 红曲菌NW3-2在25℃培养7 d的菌落特征Table 2 The colony characteristics of Monascus NW3-2 cultured for 7 days at 25℃

表3 红曲菌NW3-2在不同培养基上的显微形态特征Table 3 The microstructure of Monascus NW3-2 growing on the different culture media
2.5 分子生物学鉴定
2.5.1 红曲菌NW3-2的ITS区域PCR扩增结果 通过PCR扩增红曲菌 NW3-2的 ITSl-5.8SrDNA-ITS2区域基因,扩增产物经琼脂糖凝胶电泳,得到约600 bp的特异性条带(图8).
2.5.2 红曲菌 NW3-2 ITSl-5.8SrDNA-ITS2 基因区域测序结果 多序列比对发现,红曲菌NW3-2与紫色红曲M.purpureus ATCC16365(AF451857)、橙色红曲 M.aurantiacus AS 3.4384(DQ978995)、丛 毛 红 曲 M.pilosusFRR2194(GU733334)、发 白 红 曲 M.albidulusAS3.568(DQ978994)、红色红曲 M.ruber BCRC 31532(JX173297)的ITS碱基序列[17]最为接近.其中与丛毛红曲、发白红曲、红色红曲的序列相似达99%,仅相差1个碱基.图9表明,本试验筛选出的红曲菌NW3-2与丛毛红曲、发白红曲、红色红曲相差1个碱基序列,紫色红曲和橙色红曲与红曲菌NW3-2相差2个碱基序列.
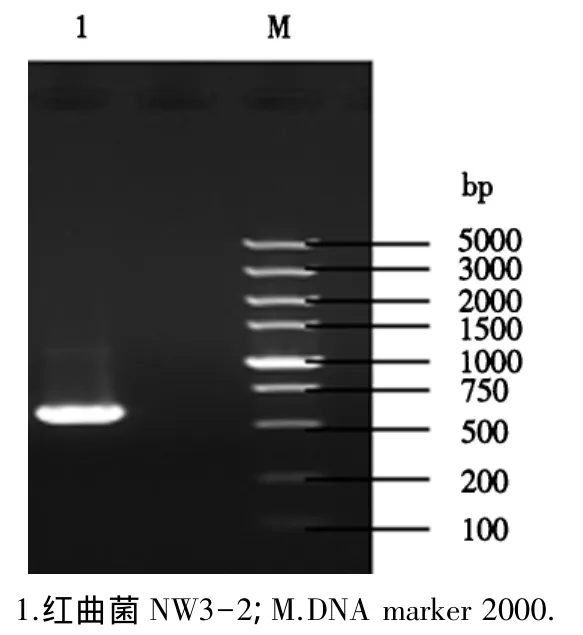
图8 红曲菌NW3-2的ITS区域PCR电泳图Fig.8 Electropherogram of ITS regions of Monascus NW3-2

图9 基于ITSl-5.8SrDNA-ITS2区域序列构建的发育进化树Fig.9 The phylogenetic tree based on 5.8S rDNA domain sequence alignment
3 小结与讨论
Monacolin K是红曲胞内产物,细胞内的积累速率基本与生长同步,适于固态发酵法,且我国的红曲霉固态发酵技术较为成熟,在筛选中运用该方法能更准确地挑选出具有合成Monacolin K能力的红曲菌株.
本实验室对不同红曲产品的菌种进行分离纯化,得到不同形态和颜色的红曲菌株96株,通过挑选颜色较浅的红曲菌株,并经固态发酵检测其代谢产物Monacolin K和桔霉素含量,筛选出一株具工业化生产前景的功能红曲菌株NW3-2.该红曲菌发酵产物中的桔霉素含量低于最低检测限16.0 μg·kg-1(符合欧标和日本标准).经多次固态发酵试验证实,功能红曲菌株NW3-2发酵产物均符合相关行业标准[9].此外,酸式Monacolin K含量指标是最终产品品质控制的关键参数之一,本研究还优化了酸式Monacolin K标准品的制备条件.
经ITS区域序列分析表明,红曲菌NW3-2与丛毛红曲、发白红曲、红色红曲的序列相似性达99%;但使用单一的分析方法仍难以最终确定其种类.目前,国际上对于红曲菌属以下种的分类仍未能形成统一的标准[18-19].对于同一菌株而言,基因测序会受到所选用DNA片段和引物的影响而产生不同的结果,同时个体间差异也影响分类判断.如郭芳等[20]曾对4种红曲菌株的ITS区域基因进行测序,该4种红曲菌株在形态上有显著差异,但其ITS基因序列两两相同,且两组不同的序列仅存在2个碱基的差别.因此,后期将使用多种分子标记方法进行综合分析,并结合生理生化试验对红曲菌NW3-2的属种进行更系统的分类鉴定.
[1]傅金泉.中国红曲及其实用技术[M].北京:中国轻工业出版社,1997:7-22.
[2]ALBERSTS A W,CHEN J,KURON G,et al.Mevinolin:a highly potent competitive inhibitor of hydroxymethyglutaryl-coenzyme a reeducates and a cholesterol-lowering agent[J].Proc Nalt Acad Sci USA,1980,77(7):3957-3961.
[3]SACKS F M,PREFFER M A,MOYE L A,et al.The effect of provastatin on coronary events after myocardial injection in patients with average cholesterol levels[J].N Engl J Med,1996,335:1001-1007.
[4]王雅芬,傅月华.红曲霉的有效生理活性物质及应用[J].杭州科技,2000(5):25-27.
[5]夏永军,许赣荣.不产桔霉素红曲菌选育的研究进展[J].食品研究与开发,2006,27(3):130-133.
[6]许赣荣,陈哗,陈蕴,等.无桔霉素高比例开环式莫纳可林K红曲产品的生产[J].食品与发酵工业,2004,30(10):59-63.
[7]吴祖芳,翁佩芳.无桔霉素红曲色素突变株FM5183对单谷氨酸钠(MSG)、组氨酸的代谢特性[J].生物技术,2002,12(6):31-33.
[8]FU G M,XU Y,LI Y P,et al.Construction of a replacement vector to disrupt pksCT gene for the mycotoxin citrinin biosynthesis in Monascus aurantiacus and maintain food red pigment production[J].Asia Pacific Journal of Clinical Nutrition,2007,16(Suppl 1):137-142.
[9]中华人民共和国国家发展和改革委员会.QB/T2847-2007功能性红曲米(粉)[S].北京:中国轻工业出版社,2007.
[10]朱华,许赣荣,陈蕴.HPLC法测定红曲中酸型与内酯型两种形态Monacolin K含量[J].无锡轻工大学学报,2003,22(3):46-52.
[11]李钟庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003:61-62.
[12]周太玄.色谱[M].北京:科学出版社,1957:2-20.
[13]李钟庆,杨晓暾,郭芳.综观红曲与红曲菌[M].北京:中国轻工业出版社,2009:33-66.
[14]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1997:133-134.
[15]林福呈,王洪凯.丝状真菌分子细胞生物学与实验技术[M].北京:科学出版社,2010:27.
[16]鲁佳慧,刘昕.红曲的生产工艺及Monacolin K和桔霉素的检测[J].现代食品科技,2005,22(1):144-146.
[17]刘芳,林英任,王士娟,等.悬钩子皮下盘菌种内遗传多样性的ITS序列分析[J].福建农林大学学报:自然科学版,2011,40(1):54-57.
[18]沈士秀.红曲的研究、生产及应用[J].食品工业科技,2001,22(1):85-88.
[19]吕旭聪,翁星,韩妙坤,等.福建红曲中红曲菌的分离鉴定及菌株特性研究[J].中国食品学报,2012,12(2):88-96.
[20]郭芳,李钟庆.四种红曲菌各自固有的分子生物学和生物化学特性[J].微生物学杂志,2007,27(1):69-71.

