原发性肝癌介入术中肝动脉-门静脉瘘的影像学特点及治疗
陈立军 杨仁杰 朱林忠 朱旭
·临床研究与应用·
原发性肝癌介入术中肝动脉-门静脉瘘的影像学特点及治疗
陈立军①杨仁杰②朱林忠②朱旭②
目的:探讨原发性肝癌合并肝动脉-门静脉瘘的血管造影表现,寻找相应的肿瘤治疗及瘘口封堵策略,改善合并动门脉瘘的肝癌的治疗效果。方法:通过对769例接受介入治疗的肝癌患者中112例合并肝动脉-门静脉瘘(hepatic artery-portal vein shunt,HAPVS)者进行影像学分析,认识其特点,结合动门脉瘘的分型,尽可能越过瘘口至肿瘤供血动脉栓塞肿瘤,再退至瘘口近端行瘘口封堵;对无法跨过瘘口的中、重度瘘,先行封堵瘘口,再栓塞肿瘤或单纯化疗灌注;对轻度周围型直接同步栓塞肿瘤及瘘口;同时处理合并的门脉癌栓及动静脉瘘。结果:肝癌合并动门脉瘘的血管造影表现为门静脉早显及异常分流,在112例中、轻度52例、中度34例、重度26例;中央型及中央型合并周围型31例、周围型81例,同时合并肝动-静脉瘘7例,门静脉癌栓50例。成功栓塞肝癌病灶101例(90.1%),成功跨过瘘口栓塞癌灶48例(42.9%);瘘口封堵成功74例(66.1%)。未出现严重并发症。结论:周围型、轻中度动门脉瘘较容易封堵瘘口,而中央型、重度动门脉瘘封堵瘘口难度较大。大多数患者得到有效的肿瘤栓塞及瘘口封堵,介入治疗安全、可靠。
原发性肝癌 肝动脉-门静脉瘘 影像学表现 介入治疗
原发性肝癌(primary liver carcinoma,PLC)是临床上常见的恶性肿瘤。经导管动脉内化疗栓塞术(transcatheter-arterial chemoembolization,TACE)被认为是外科手术治疗外的一种有效治疗方法。肝动脉-门静脉瘘(hepatic artery-portal vein shunt,HAPVS)是中晚期肝癌常见合并症,容易导致肝癌播散转移,加重肝功能损害及门静脉高压症状[1],并容易造成药物的分流,造成栓塞失败及异位栓塞,严重影响患者的治疗和预后[2-3]。因此,介入术中对肝癌HAPVS的发现,瘘口类型、位置、分流大小的判断及采取正确的封堵手段显得尤其重要。
1 材料与方法
1.1 一般资料
2012年1月至2013年12月北京大学北京肿瘤医院确诊原发性肝癌并行介入治疗患者769例,肝癌的诊断符合中国抗癌协会肝癌专业委员会2001年标准,就诊时无肿瘤切除适应证或放弃手术者。数字减影血管造影(digital subtraction angiography,DSA)检查发现112例同时有不同程度HAPVS,其中男性101例,女性11例,年龄36~83岁,平均年龄57.7岁。介入治疗前影像学(CT和/或MRI)提示巨块型40例、结节型64例,弥漫型8例。
1.2 治疗方法
全部病例均采用Seldinger技术经皮经股动脉穿刺行DSA检查,在血管造影机引导下置入5F导管鞘,将5F造影管头端选择性插入腹腔动脉、肠系膜上动脉、膈下动脉,以高压注射器注入欧乃派克,速率5~6 mL/s,总量25~30 mL/次,采集速度4~6帧/s,延长摄片时间至静脉期或者门静脉主干显影停止。若有侧支循环供血者,行侧支供血动脉造影,发现门静脉提前显影为肝动脉-门静脉瘘。
根据动门脉瘘口的位置,将动门脉瘘分为中央型、周围型。中央型:瘘口位于门静脉主干和一级分支;周围型:位于门静脉二级分支以下。按照瘘口分流量的大小及显影的时间,将动门脉瘘分为轻、中及重度。
治疗时尽量采用微导管行超选择插管造影了解HAPVS部位、数目、分流量及肿瘤供血染色情况,分别或同时进行堵瘘及肿瘤化疗栓塞治疗。尽可能跨过瘘口栓塞肿瘤,然后封堵瘘口再栓塞,即所谓“夹心”疗法。如无法跨过瘘口,先封堵瘘口再栓塞或者灌注化疗。对于瘘口分流量大的门静脉主干瘘同时伴有门静脉癌栓或逆肝血流,无法跨越瘘口的仅行灌注化疗。封堵材料包括明胶海绵颗粒、聚乙烯醇微粒(PVA)、生物微球(Embosphere Microsphers)、微弹簧圈等,单独或联合应用。
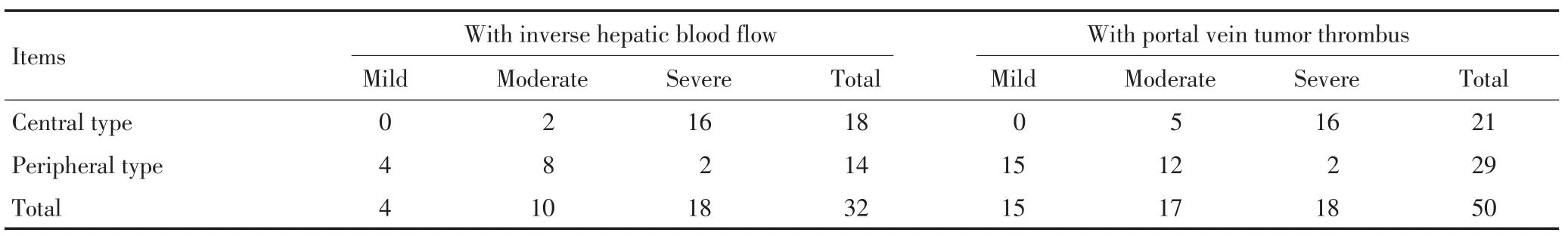
表2 不同类型动门脉瘘合并逆肝血流及门静脉癌栓的情况 例Table 2 Inverse hepatic blood flow and PVTT situation given different types of dynamic portal fistula n
1.3 统计学方法
所有数据均使用SPSS 17.0统计学方法处理,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HAPVS的DSA表现分型
112例动门脉瘘中,轻度52例(46.4%)、中度34例(30.4%)、重度26例(23.2%);中央型31例(27.7%)、周围型81例(72.3%),见表1。同时合并肝静脉瘘7例。
2.2 动门脉瘘合并逆肝血流及门静脉癌栓
逆肝血流32例、发生率28.6%;轻度、重度瘘逆肝血流发生率分别为7.7%、69.2%,重度明显多于轻度,差异有统计学意义(χ2=32.416,P<0.001);中央型、周围型逆肝血流发生率分别为58.1%、17.31%,中央型高于周围型,差异有统计学意义(χ2=18.270,P<0.001)。合并门静脉癌栓50例、发生率44.6%;轻度、重度瘘癌栓发生率分别为28.8%、69.2%,重度明显高于轻度,差异有统计学意义(χ2=11.582,P=0.001);中央型、周围型癌栓发生率分别为67.7%、35.8%,中央型明显高于周围型,差异有统计学意义(χ2=9.225,P<0.05,表1,2)。

表1 肝动脉-门静脉瘘的分型 例Table 1 Fistula types n
2.3 肝癌病灶的处理
成功栓塞肿瘤101例,成功率90.1%,中央型、周围型成功率分别为80.6%、93.8%,周围型高于中央型,差异有统计学意义(χ2=4.399,P<0.05);跨过瘘口栓塞肿瘤48例、成功率42.9%,中央型、周围型成功率分别为67.7%、33.3%,中央型明显高于周围型,差异有统计学意义(χ2=10.839,P<0.001);未跨过瘘口栓塞肿瘤53例、成功率47.3%,中央型、周围型成功率分别为12.9%、60.5%,周围型高于中央型,差异有统计学意义(χ2=11.998,P<0.001,表3,4)。其他11例仅行灌注化疗。
2.4 瘘口的处理
瘘口封堵成功74例、成功率66.1%,中央型、周围型成功率分别为51.6%、71.6%,周围型高于中央型,差异有统计学意义(χ2=3.997,P<0.05),瘘口封堵未成功的38例中周围型23例占60.5%(表5)。
2.5 瘘的典型表现
图1A可见中央型动门脉瘘;以弹簧圈栓塞后分流明显减少见图1B。中央型重度动门脉瘘见图2A,并明显的逆流;先后2次介入治疗以41枚弹簧圈栓塞瘘口后分流消失见图2B。周围型动门脉瘘图3A;采用微导管超超选择技术,以微球栓塞异常分流的分支后,于肝右动脉给予碘油栓塞肿瘤,可见栓塞(图3B)。动门脉瘘同时合并动静脉瘘见图4。动门脉瘘合并门静脉癌栓见图5。碘油栓塞肿瘤及门静脉铸型见图6。

表3 成功栓塞肿瘤与瘘口分型的关系 例Table 3 Relationship between fistula type and successful tumor emboli﹣zation n

表4 是否跨过瘘口栓塞肿瘤与瘘口分型的关系 例Table 4 Relationship between fistula type and successful tumor embolization by overpassing the fistula n
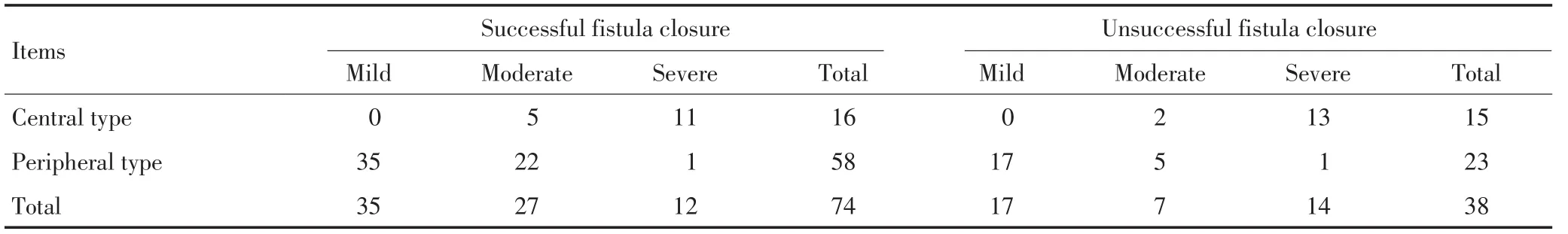
表5 瘘口封堵与瘘口分型 例Table 5 Relationship between fistula type and successful fistula closure n

图1 中央型动门脉瘘Figure 1 Central-type artery-portal vein fistula
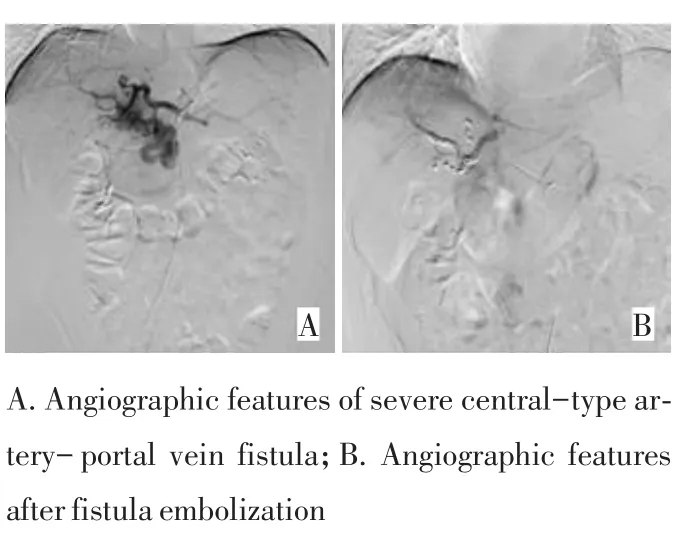
图2 中央型重度动门脉瘘Figure 2 Severe central-type artery-portal vein fistula

图3 周围型动门脉瘘Figure3 Peripheral-typeartery-portalveinfistula
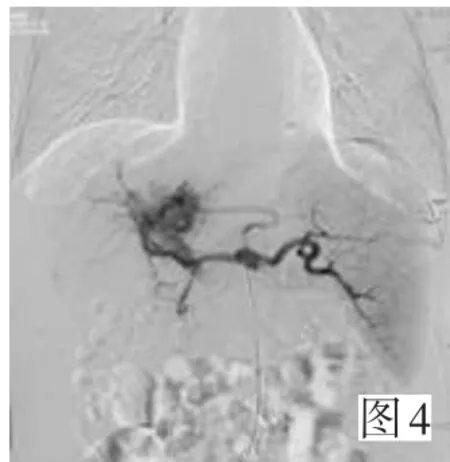
▶图4 动门脉瘘合并动静脉瘘Figure 4 Artery-portal vein fistula complicated by hepatic artery-hepatic vein fistula

图5 动门脉瘘合并门静脉癌栓Figure 5 Artery-portal vein fistula complicated by portal vein cancer thrombus
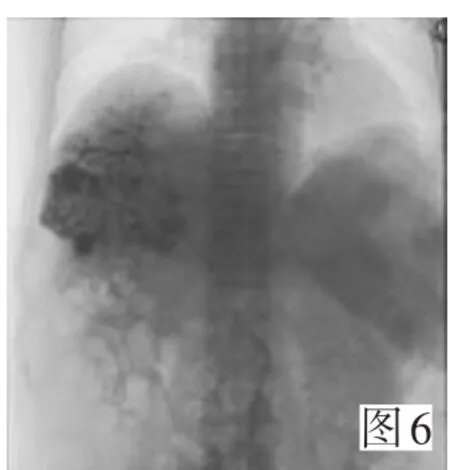
图6 碘油栓塞肿瘤及门静脉铸型Figure 6 Lipiodol embolization of tumor and portal vein casting
3 讨论
3.1 PLC合并HAPVS的形成机制
原发性肝癌合并HAPVS的发生率文献报道不一[4-5],本组为14.6%。生理状况下,肝动脉和门静脉在Glisson鞘内伴行,各自分支进入肝窦,血流经肝窦入中央静脉,汇总后经肝静脉进入下腔静脉。肝动脉—门静脉之间存在广泛的潜在吻合支。HAPVS形成与肝癌的相关机制大致相似,目前认同的主要有以下4种[6]:1)肿瘤组织直接破坏门静脉和肝静脉主干或分支,致肝动脉血引流入门静脉或肝静脉系统,形成瘘;2)经血管途径,即正常肝组织内肝动脉、门静脉之间存在着广泛的吻合支,当肿瘤等病理情况下压迫其一部分分支时,吻合支开放形成瘘;3)肿瘤压迫和(或)门静脉较大分支的瘤栓使门静脉血流受阻时,较大的胆管周围血管丛或肝动脉的门静脉管壁分支均可异常开放,形成经管腔途径的瘘以及直接的瘘;4)肿瘤产生血管生长因子,促进新生血管网的形成,形成瘘。近来有学者[7-8]研究认为HAPVS的形成与肿瘤促进血管内皮生长因子高表达及外周血内皮祖细胞有关。孙磊等[9]认为HAPVS的发生与乙型肝炎病史、肝硬化基础、肿瘤类型、肿瘤数目和门静脉癌栓有关。
3.2 PLC合并HAPVS的DSA影像学特点
根据动-门脉瘘瘘口的位置,动门脉瘘分为中央型、周围型。1)中央型:瘘口位于门静脉主干和一级分支的HAPVS,表现为肝动脉显影时见门静脉主干和/或分支早期显影,且多可见肝动脉明显增粗;2)周围型:瘘口位于门静脉二级和二级以下分支的HAPVS,造影表现为动脉期可见动脉分支旁的较粗和浅淡的门静脉同时显影,即“双轨征”或“网格征”。根据瘘分流程度不同将HAPVS分为轻、中、重度。1)轻度:动脉中期见门脉4级分支显示,动脉晚期清楚,表现为病灶边缘出现“蚯蚓”状或“小草”样显影的门静脉小分支,对比剂排空慢,持续到实质期;2)中度:动脉中期门静脉分支2、3级及其分支显影,可有双轨征”或“网格征”;3)重度:动脉早期门静脉主干及其分支显影包括门静脉血流向肝或门脉血流逆肝走行,瘘口远端的肝动脉显影浅淡甚至不显影,而门静脉显影清楚,肿瘤染色出现在门静脉显影之后,大部分对比剂通过短路进入门静脉,致使门静脉快速显影,随后才进入肿瘤内之故。本组轻、中、重度分别占46.4%、30.4%、23.2%,与宋锦文等[10]报道一致,中、重度瘘与轻度瘘各占约一半。本研究认为中央型瘘以重度为主、轻度少见;周围型瘘以轻度为主、重度较少。
动-门脉瘘往往同时合并肝动脉-肝静脉瘘者,其造影表现为:动脉期对比剂进入肝静脉分支或肝静脉,或可见对比剂进入下腔静脉及右心房。肝动脉-肝静脉瘘在造影及栓塞治疗中需特别关注,否则有肺栓塞的危险。本研究发现34例动静脉瘘,其中3例术后发现肺栓塞。
原发性肝癌合并肝动脉-门脉瘘往往与门静脉癌栓并存[11-12],其DSA表现特异性高,表现为门静脉内结节状充盈缺损、“线样征”或“条纹征”。本研究合并门静脉癌栓中、重度瘘发生率高,差异有统计学意义,认为发生率较高与瘘的形成机制相关,瘘与癌栓互为因果,肖景坤等[13]认为门静脉癌栓是动-门脉瘘封堵效果的独立危险因素。本研究逆肝血流中央型重度瘘发生率高,差异有统计学意义,可认为发生率较高与其瘘口大、分流量及压力高有关。HAPVS的存在特别是中央型重度瘘进一步加重门静脉高压症状,损害肝功能。
3.3 PLC合并HAPVS的介入治疗策略
原发性肝癌合并HAPVS增加了介入治疗的风险和难度。由于分流道的存在,化疗药物及栓塞剂可以通过瘘口流向非病变血管,严重影响治疗效果并损害肝功能,如合并肝静脉瘘或逆肝血流可出现异位栓塞等,因此,封堵瘘口是治疗的关键。如果处理不当,不但不能很好地对肿瘤进行超选择性栓塞,反而会产生严重的后果[14]。目前,介入栓塞封堵静脉分流仍被认为是唯一快速而有效的治疗方法,进行肝动脉栓塞不仅能阻断肿瘤血供,抑制肿瘤生长,还能够阻断肝动脉-门静脉间的异常分流,缓解门静脉高压所致的腹腔积液和上消化道出血,并减少通过静脉分流引起的远处转移,增加正常肝组织的门静脉血供和营养,从而有利于改善肝功能及临床症状。肝动脉-门静脉瘘的控制亦可增加TACE的疗效,延长生存期[15]。
本研究中央型肝动脉-门静脉瘘的治疗,将微导管超选择插管越过瘘口,先对肿瘤行TACE治疗,然后将导管撤至瘘口处,根据瘘口大小选择适当材料封堵瘘口;对无法越过瘘口的病例,如果门静脉主干未完全阻塞或已形成侧支循环,则应先行封堵瘘口,再行肿瘤TACE治疗,此类病例若治疗过程中把肝动脉闭塞,仍有门静脉血流维持肝脏需要的血供,不会造成严重的后果;对门静脉主干完全阻塞或无侧支循环的病例,瘘口较大、封堵较困难或因封堵瘘口本身极易造成肝动脉栓塞而诱发严重的肝功能障碍,仅行灌注化疗;对有门静脉逆肝血流病例,先封堵瘘口,再行TACE治疗。周围型肝动脉—门静脉瘘的治疗,瘘口较大,血液分流量较大时,超选择插管堵瘘后栓塞肿瘤或避开瘘行肿瘤供血支TACE后再行堵瘘;小瘘口、分流量小者可行常规TACE治疗,此时行肝动脉碘化油栓塞,有少量碘化油进入门静脉小分支,形成肿瘤的双重栓塞,肿瘤坏死更完全,效果更好,本组治疗方法与孙刚庆[16]报道一致。合并肝动脉-肝静脉瘘的治疗,必须先封堵瘘口,再行TACE治疗。如封堵不完全,用碘油栓塞时,易发生肺栓塞。中央型重度瘘多采用微弹簧圈(2~5 mm)加明胶海绵颗粒(1 000~1 400 μm)或加生物微球(700~900 μm)封堵;中、轻度瘘多采用明胶海绵颗粒(350~710 μm)或PVA颗粒(300~500 μm)或生物微球(300~500 μm)或明胶海绵颗粒与微球合用封堵瘘口,依术中所见决定所用材料及规格。
本研究栓塞肿瘤成功率90.1%,周围型成功率高于中央型;跨过瘘口栓塞肿瘤成功率中央型明显高于周围型;未跨过瘘口栓塞肿瘤成功率周围型明显高于中央型成功率;瘘口封堵成功率66.1%,成功率周围型高于中央型。上述差异均有统计学意义。因此虽然有瘘的存在,无论是否跨过瘘口绝大多数病例均可成功栓塞肿瘤,中央型中、重度瘘以跨过瘘口栓塞为主,周围型轻度瘘跨过瘘口较困难、以直接栓塞肿瘤为主;中央型重度瘘尽可能跨过瘘口先行TACE再堵瘘;周围型、轻中度动门脉瘘的患者较容易封堵瘘口,可同时进行肿瘤栓塞及瘘口封堵;中央型、重度动门脉瘘患者封堵瘘口难度较大,加之中央型重度瘘合并门静脉癌栓及逆肝血流的发生率较高,故对中央型及重度瘘的正确及成功处理尤为重要。
封堵瘘口原则有三:其一,根据瘘口的类型、位置及分流大小,选择闭塞的方法和材料,尽可能关闭瘘口,且要保证肝脏足够的血流灌注;其二,根据瘘口的闭塞情况,决定是否进行碘油栓塞及碘油的剂量。其三,结合患者的肝功能储备情况进行综合考虑。
无论采用何种分类方法、何种堵瘘方法,术者在TACE术中对瘘的准确认知是基础,只有术者正确认识瘘的影像学特点,才能发现瘘、正确处理瘘、防止误栓、提高疗效。
[1] Li JJ,Shang JQ,Liu ZQ,et al.Interventional treatment of upper gastrointestinal bleeding in patients of hepatic carcinoma accom﹣panied with hepatic artery-portal vein shunting[J].Journal of In﹣terventional Radiology,2011,20(2):120-122.[李继军,尚建强,刘作勤,等.肝癌肝动脉-门静脉瘘并消化道出血的介入治疗[J].介人放射学杂志,2011,20(2):120-122.]
[2] Ratti F,Cipriani F,Paganelli M,et al.Surgical approach to multi﹣focal hepatocellular carcinoma with portal vein thrombosis and ar﹣ terioportal shunt leading to portal hypertension and bleeding:a case report[J].World Journal Surgical Oncology,2012,10:34-38.
[3] Xu GB,Xiong B,Liu JF,et al.Strategy and clinical effect of inter﹣ventional chemoembolization in treatment of primaryHepatocellu﹣ar carcinoma combined with hepatic arteriovenous shunting[J]. Journal of Clinical Radiology,2011,30(1):82-85.[徐国斌,熊 斌,刘骏方,等.原发性肝癌合并肝动静脉瘘的介入栓塞治疗策略及疗效探讨[J].临床放射学杂志,2011,30(1):82-85.]
[4] Xu GB,Xiong B.Primary liver cancer complicated with hepatic arterioportal fistula:Clinical characteristics and risk factors[J]. World Chinese Journal of Digestology,2012,20(29):2832-2835. [徐国斌,熊 斌.原发性肝癌合并肝动脉-门静脉瘘的相关因素及临床特点[J].世界华人消化杂志,2012,20(29):2832-2835.]
[5] Xu GT,Tan ZX,Hu YL.Strategy and clinical effect of interven﹣tional chemoembolization in treatment of primary hepatocelluar carcinoma combined with hepatic arteriovenous shunting[J].He﹣bei Medical Journ,2013,35(3):403-404.[许军廷,檀增宪,胡永立.原发性肝癌合并动静脉瘘的介入治疗及疗效评估[J].河北医药, 2013,35(3):403-404.]
[6] Chen YH,Li JP,Tan GS,et al.DSA finding and interventional methods of liver cancer complicated with arterial-portal venous shunts[J].Journal of Oncology,2010,16(1):56-59.[陈燕浩,李家平,谭国胜,等.肝癌合并动门脉瘘的DSA表现和介入治疗方法[J].肿瘤学杂志,2010,16(1):56-59.]
[7] Li XL,Zhu ZY,Shi RS,et al.The DSA characteristics and the ex﹣pression of VEGF of primary hepatocellular carcinoma:acorrela﹣tive study[J].Journal of Interventional Radiology,2010,19(5): 377-381.[李先浪,先正元,石荣书,等.原发性肝癌DSA表现特点与癌组织血管内皮细胞生长因子表达相关性研究[J].介入放射学杂志,2010,19(5):377-381.]
[8] Bu XH,Zheng ZM,Du WJ,et al.Relevance between peripheral endothelial progenitor cells and hepatic artery-portal vein shunt﹣ing in primary hepatic carcinoma[J].Journal of Shandong Univer﹣sity(Health Sciences),2010,48(4):87-90.[布学慧,郑昭敏,杜文军,等.外周血内皮祖细胞水平与肝癌肝动-门静脉瘘的相关性[J].山东大学学报,2010,48(4):87-90.]
[9] Sun L,Shi HB,Liu S,et al.The factors related to the formation of arterioportal shunting patients with hepatocellular carcinomas [J].Journal of Interventional Radiology,2012,21(3):206-210.[孙磊,施海彬,刘 圣,等.肝细胞癌肝动脉门静脉分流形成的相关因素分析[J].介入放射学杂志,2012,21(3):206-210.]
[10]Song JW,Yang Y,Liu XH,et al.Clinical application of a new DSA typing in the embolotherapy for hepatocarcinoma with arte﹣riovenous shunting[J].Journal of Clinical Radiology,2012,31(8): 1156-1159.[宋锦文,杨 艳,刘晓红,等.肝癌合并动-静脉分流一种DSA新分型法的临床应用[J].临床放射学杂志,2012,31(8): 1156-1159.]
[11]Zhu LZ,Yang RJ.Digital subtraction angiography manifestation and intervent ional therapy of arteriovenous shunting in primary hepatocellular carcinoma of advanced stage[J].Journal of Peking University:Health Sciences,2008,40(2):129-134.[朱林忠,杨仁杰.原发性肝癌合并动静脉瘘的数字减影血管造影表现及介入治疗[J].北京大学学报医学版,2008,40(2):129-134.]
[12]Zhang FQ,Li YW.Advance in treatment of primary liver cancer complicated with arteriovenous shunt[J].Modern Diagnosis& Treatment,2008,19(5):287-290.[张富强,李玉伟.原发性肝癌合并动静脉瘘的介入治疗进展[J].现代诊断与治疗,2008,19(5):287-290.]
[13]Xiao JK,Lv WF,Zhou CZ,et al.Interventional chemoemboliza﹣tion for primary hepatocelluar carcinoma complicated by arterio﹣venous shunting:retrospective analysis of 62 cases[J].Journal of Interventional Radiology,2014,23(8):683-687.[肖景坤,吕维富,周春泽,等.原发性肝癌伴动静脉瘘介入栓塞治疗62例回顾性分析[J].介入放射学杂志,2014,23(8):683-687.]
[14]Zeng H.The treatment strategies and the efficacy of the interven﹣tion to treat with primary hepatocellular carcinoma with hepatic arteriovenous fistula[J].Journal of Zhejiang Chinese Medical Uni﹣versity,2012,36(2):145-146.[曾 晖.介入栓塞治疗原发性肝癌合并肝动静脉瘘的临床疗效分析[J].浙江中医药大学学报,2012, 36(2):145-146.]
[15]Huang HH,Li YJ,Xu AB,et al.Strategy and clinical effect of in﹣terventional chemoembolization on the treatment for hepatocellu﹣ ar carcinoma complicated with hepatic arteriovenous shunting[J]. Journal of Oncology,2013,19(7):509-513.[黄洪华,李拥军,徐爱兵,等.肝癌合并肝动—静脉瘘的介入栓塞处理策略及疗效观察[J].肿瘤学杂志,2013,19(7):509-513.]
[16]Sun GQ.DSA finding and interventional therapy of arteriove﹣nous shunting in primary hepatocellniar carcinoma[J].Contempo﹣rary Medicine,Journal,2013,19(18):6-8.[孙刚庆.肝癌合并肝动脉-门静脉瘘的DSA表现和介入治疗[J].当代医学,2013,19(18): 6-8.]
(2015-03-31收稿)
(2015-05-13修回)
(编辑:周晓颖)

陈立军 专业方向为肿瘤的介入治疗。
E-mail:chenlj700106@sina.com
第十届全国胃癌学术会议通知
由中国抗癌协会胃癌专业委员会、北京大学肿瘤医院主办的“第十届全国胃癌学术会议暨第三届阳光长城肿瘤学术会议”将于2015年6月26~28日在北京国际会议中心举行。本届会议将延续“规范、融合、创新”这一主题,旨在进一步提高中国胃癌规范化诊疗水平、推动多学科协作、促进转化医学的发展,并将在加强国际间交流与合作方面做出更多有益的尝试。会议将邀请国内外著名专家就胃癌诊治和研究的最新进展以及热点问题进行精彩演讲和互动讨论。会议内容涵盖胃癌、神经内分泌肿瘤的诊断、治疗、研究等各领域,根据不同学科、不同层级专业人员的需求搭建多个学习、交流和展示的平台。每年一届的学术盛会是肿瘤领域各位学者拓展国际视野,把握学科发展,提升专业能力,促进同道友谊的互动交流平台,欢迎业内同道的关注、支持和参与。(详情请见http://www.cjco.cn/CN/news/news616.shtml)
——引自“中国抗癌协会”网站
Imaging characteristics and intervention therapy for hepatic artery-portal vein shunts in patients with primary liver carcinoma
Lijun CHEN1,Renjie YANG2,Linzhong ZHU2,Xu ZHU2
1Department of Oncology,Tianjin Binhai New District Dagang Hospital,Tianjin 300270,China;2Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Department of Interventional Radiology,Peking University Cancer Hospital&Institute,Beijing 100142,China.
Renjie YANG;E-mail:renjieyang2007@163.com
Objective:To investigate the onset of hepatic artery-portal vein shunts(HAPVS)in primary liver cancer(PLC)patients through digital subtraction angiography(DSA)and to devise a suitable strategy for treating both lesions and shunt tracts.In the process,the therapeutic effect on such patients can be enhanced.Methods:A total of 769 PLC patients who accepted transarterial chemoembolization(TACE)were analyzed retrospectively.We examined the image characteristics of 112 cases with HAPVS based on shunt type.For patients with middle or severe fistula,we initially attempted to overpass the fistula.Then,we either embolized the tumor lesions or merely provided chemotherapy to the patients.For patients with mild peripheral fistula,we embolized the tumor and fistula simultaneously.Then,the accompanying arterial-vein shunt and portal vein tumor thrombus(PVTT)were handled at the same time.Results:DSA findings showed that portal veins were observed in the early stage of angiography.A total of 52 of the 112 cases with HAPVS involved mild shunts,34 exhibited moderate shunts,and 26 reported severe shunts.Among these cases,31 involved centraland central peripheral-type artery-portal vein fistula,whereas 81 involved peripheral-type artery-portal vein fistula.Seven cases were examined in combination with hepatic artery-liver vein shunts,and 50 cases were investigated in conjunction with PVTT.Tumor embolization was successful in 101 cases(90.1%).Moreover,catheters successfully overpassed shunt tracts and embolized the tumors in 48 cases(42.9%).Shunt tracts were successfully closed in 74 cases(66.1%),and no serious complication was observed.Conclusion:Peripheral-type artery-portal vein fistula and mild-to-moderate shunts were easier to close than central-type artery-portal vein fistula and severe shunts were.Tumor embolization and shunt closure were successful in most patients.Therefore,TACE is a safe and reliable method for treating HAPVS in PLC.
primary liver carcinoma,hepatic artery-portal vein shunt,imaging appearance,intervention therapy
10.3969/j.issn.1000-8179.20150370
①天津市滨海新区大港医院肿瘤科(天津市300270);②北京大学肿瘤医院暨北京市肿瘤防治研究所介入治疗科,恶性肿瘤发病机制及转化研究教育部重点实验室
杨仁杰 renjieyang2007@163.com

