浒苔水体光谱特征参量时间序列数据拟合研究
卢 霞, 王春艳, 谢宏全, 彭红春, 李海英
(淮海工学院 测绘工程学院, 江苏 连云港, 222005)
浒苔(Entermorpha prolifra)是一种大型绿藻,广泛分布于我国浙江、江苏、福建等海域。浒苔(绿潮)灾害的大规模暴发严重威胁了沿岸旅游业和海水养殖业的发展, 在打捞、清除浒苔的过程中, 也给当地政府带来了一定经济负担。因此, 开展浒苔的实时动态监测甚为必要。浒苔分布范围广、易于随水漂移, 常规的人工调查难以准确监测其分布及变化。而遥感技术的进步与发展可实时动态监测浒苔灾害。浒苔藻体在不同的生长阶段, 因其物理、化学或生物学性状有所不同, 而导致对自然入射的或自身发出的电磁波的响应也有所不同; 在一定程度上形成了具有鉴别特征的“指纹效应”。因此, 浒苔光谱特征的研究将有助于浒苔识别算法提取和遥感波段选择等。
国内外学者利用遥感技术开展大规模的浒苔绿潮灾害动态监测研究已经取得一定进展[1-5]。采用的遥感数据源主要包括 MODIS数据和 SAR数据; 提取算法主要包括归一化植被指数 NDVI(Normalized Difference Vegetation Index), 增强的植被指数 EVI(Enhanced Vegetation Index), 漂浮藻体指数 FAI(Floating Algae Index)。这些算法都基于浒苔藻体反射光谱。本文以此为突破点, 采集连云港海域缘管浒苔藻体为实验样本, 获取浒苔藻体由成熟期至死亡期间的反射光谱, 开展浒苔水体反射光谱特征参量的时间序列拟合研究, 以挖掘应用时间序列模型模拟浒苔水体光谱特征参量的可行性。该研究可为浒苔灾害动态实时监测业务化运行部门提供浒苔反射光谱数据以及行之有效的数据处理方法; 也为进一步丰富我国的地物光谱库和光谱知识库共享服务而作出贡献。
1 材料和方法
1.1 试验材料
于2011年1月1日上午11点50分, 在连云港凰窝风景区潮间带采集浒苔藻体, 采集点的 GPS定位为(119.5°E, 34.7°N)。基于多次室内浒苔培养密度的试验, 最终选取鲜重分别为0.1, 0.5, 1.0 g的浒苔藻体, 分别置于容积为250 mL的锥形瓶中, 并向3个锥形瓶中分别倒入200 mL海水, 轻轻摇动锥形瓶, 使浒苔藻体完全浸入海水中, 海水的盐度和酸碱度分别为25和 8.4; 浒苔藻体培养的光照强度为 26 μmol/(m2·s)左右, 平均温度为10℃。
1.2 光谱数据采集
浒苔水体的反射光谱测定主要在暗室进行, 照明光源的高度为60 cm, 照明光源与三角架的夹角为30°, 测试白板和浒苔水体反射光谱时, 光谱仪的高度固定为20 cm。光谱测定时间为2011年1月8日至3月9日。测定的光谱仪是美国ASD公司生产的HandHeld FieldSpec地物光谱仪, 波段覆盖350~1 050 nm, 其光谱分辨率为10 nm, 传感器探头全视场角(FOV)为 25°。在测定浒苔藻体的反射光谱时,每次测定10个光谱数据作平均。进行量化表达, 也就是从二维反射光谱曲线中应用各种不同数学方法提取各种变量。本文共提取了 38个与浒苔藻体色素含量高度相关的光谱特征参量,关于这些变量的定义和描述如表1所示。
1.3 光谱曲线特征量化表达
浒苔水体的反射光谱时间序列曲线在350~1050 nm存在较大的相似性(图1, 浒苔水体培养液质量浓度为0.5 g/L)。近红外波段的高反射平台是叶片散射的结果; 而在400~700 nm存在较强的吸收特征, 则主要是叶绿体内的电子跃迁所致。既然从光谱曲线本身无法挖掘趋势性, 就试图从光谱曲线中定量提取光谱诊断特征。因光谱仪测定波段范围所限, 本文重点将浒苔水体在400~900 nm范围内的反射光谱曲线
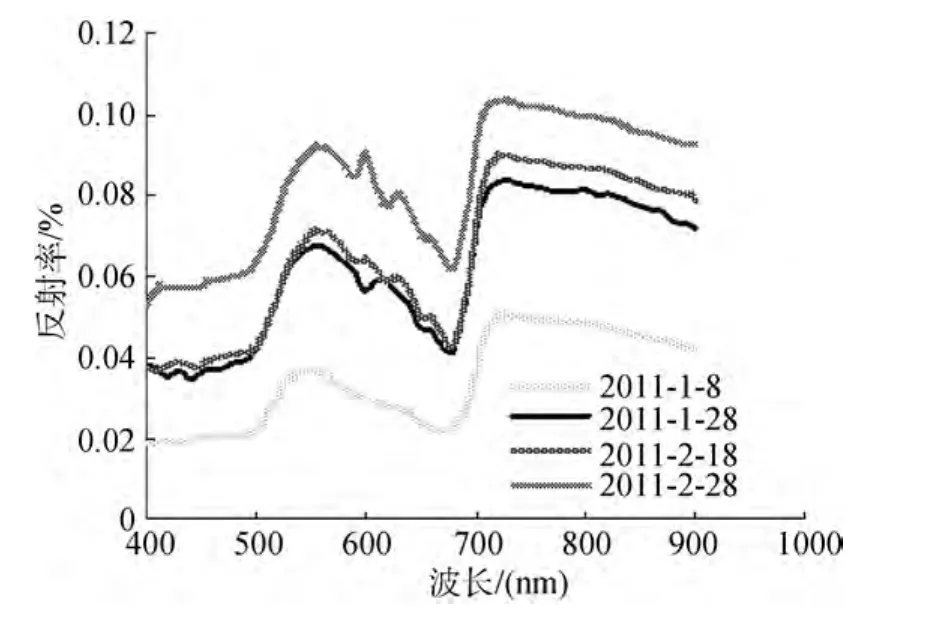
图1 浒苔水体不同日期的反射光谱Fig.1 The spectral reflectance of Enteromorpha prolifera water body
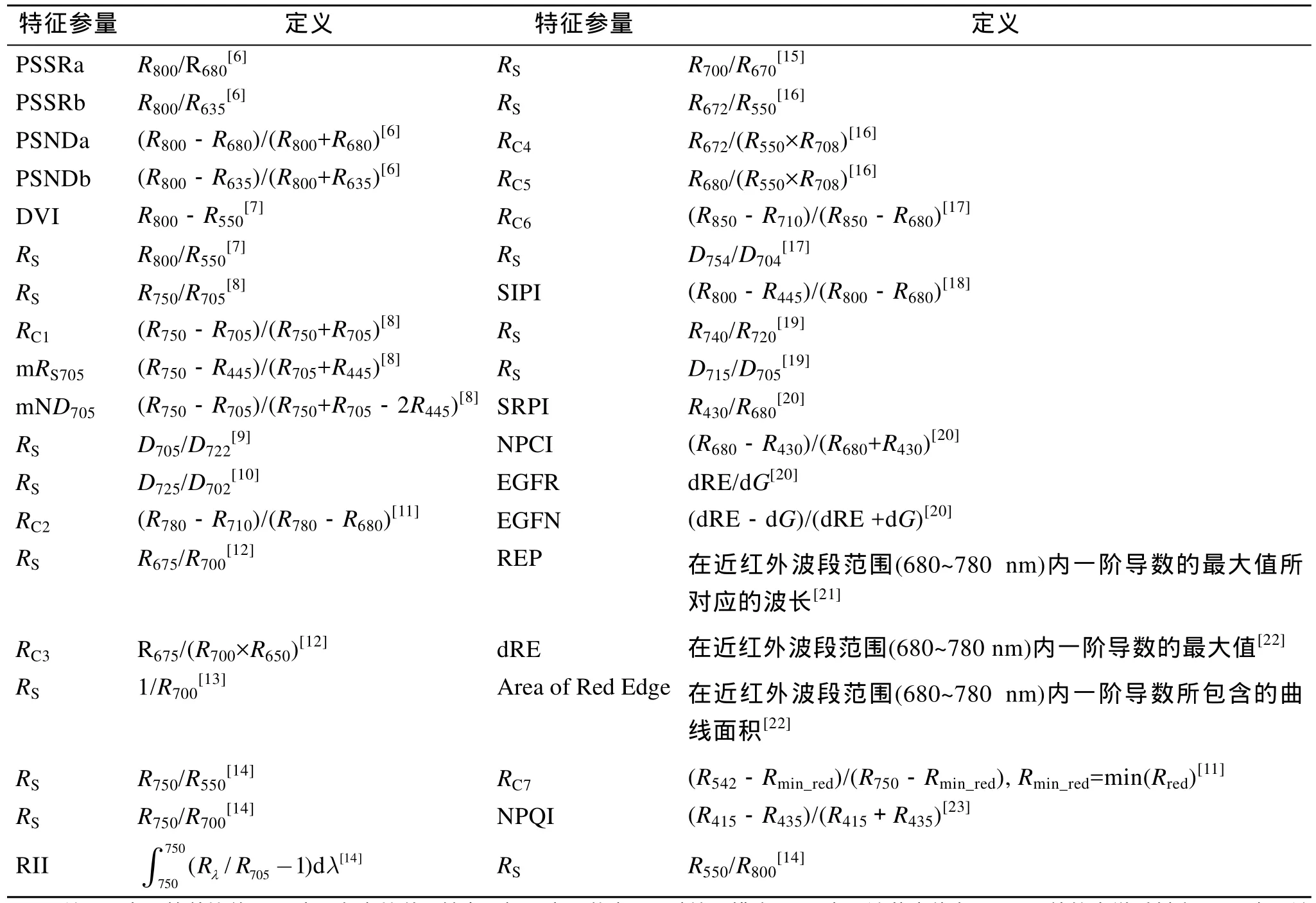
表1 光谱特征参量的定义和描述Tab.1 Definition and description of spectral variables
1.4 数据分析
本文共获取60 d的3种不同培养液质量浓度的浒苔水体反射光谱数据, 数据的预处理主要包括光谱数据格式转换、导数光谱和对数光谱的导出、缺失数据的处理等方面。其中因 1月 15日和 1月 19日光谱测试有误, 造成数据异常, 为确保时间序列的连续性, 本文采用相邻前后日期反射光谱的平均值代替。
1.5 时间序列拟合
依据最佳拟合准则不同, 产生不同拟合方法。时间序列数据的拟合方法通常包括曲线拟合、线性/非线性回归分析和自回归移动平均(ARMA)模型。曲线拟合就是将一组离散的数据以一个近似的曲线方程式来代表。时间序列模型拟合分析主要用于分析序列的趋势性及趋势的变动性。时间序列建模的基本步骤包括: (1)用观测、调查、统计、抽样等方法取得被观测系统时间序列动态数据; (2)根据动态数据作相关图, 进行相关分析, 求自相关函数; (3)辨识合适的随机模型, 进行曲线拟合。
2 结果与分析
2.1 光谱特征参量的聚类
将浒苔水体的反射光谱提取的38个特征参量进行相关分析, 并依据相关系数的大小进行归类。分类的准则是将相关系数0.9以上的变量归为一类, 然后在类别之间选取相关性相对较小的变量作为时间序列拟合变量, 最终得到 12个变量, 分别为 PSSRa,PSNDa, mRS705,D725/D702,R675/R700,RC3, RII,R700/R670,R740/R720,D715/D705, REP和Area of Red Edge。
2.2 光谱特征参量的时间序列拟合
2.2.1 光谱特征参量的线性/曲线拟合
浒苔水体的反射光谱特征参量的线性/曲线拟合精度评价指标主要包括多重判定系数(R2)、估算标准差(SEE: Standard Error of the Estimates)、拟合模型F检验和系数t检验的重要性(p)。三种浒苔水体培养液质量浓度下, 12个光谱特征参量的曲线拟合结果如表2~表4所示, 表中所有光谱特征参量的曲线模拟都满足模型F检验和模型系数的t检验。从表中可以看出: 12个光谱特征参量应用线性/曲线拟合法来拟合时间序列, 从精度评价指标看, 都符合要求, 且拟合函数均为二阶或三阶多项式; 但是光谱特征参量的拟合精度与浒苔水体培养液质量浓度之间存在的规律并不一致。也就是说, 有些光谱特征参量的时间序列趋势拟合精度随培养液质量浓度的增加而增加; 有些则不然。另外, 对于同一个光谱特征参量,不同培养密度下构建的时间序列多项式曲线拟合的阶数也不完全一致。从多项式曲线拟合的核心指标R2来看, 低培养液质量浓度(0.5 g/L)下, 浒苔水体反射光谱特征参量D715/D705的拟合精度最低,R2仅为0.349;R700/R670的拟合精度最高,R2为0.860。中等培养液质量浓度(2.5 g/L)下, 浒苔水体反射光谱特征参量D715/D705的拟合精度最高,R2为0.778; PSSRa的拟合精度最低,R2为0.499。高培养液质量浓度(5.0 g/L)下, 浒苔水体光谱特征参量RII的拟合精度最高,R2高达0.892;D725/D702的拟合精度最低,R2为0.419。
2.2.2 光谱特征参量的时间序列(ARMA)拟合
采用时间序列 ARMA模型对12个光谱特征参量进行拟合, 对AR(p)模型、MA(q)模型, ARMA(p,q)模型和ARIMA(p,d,q)模型而言, 拟合精度评价指标主要有: 最小信息准则 AIC (Akaike’s Information Criterion) 和BIC(Bayesian Information Criterion)以及模型标准误差。信息准则AIC和BIC主要用于模型的选择, 越小越好, 但其值受自由度的影响较大。模型标准误差越小, 估计精度越高。在应用时间序列模型之前, 首先将12个光谱特征参量进行零均值化处理, 之后应用单样本 K-S(Kolmogorov-Smirnov)检验特征参量时间序列的正态分布; 然后通过数据的相关图判断数据的平稳性以及确定p和q的取值。若数据呈现不平稳的特点, 则用差分来实现平稳。12个光谱特征参量时间序列拟合参数统计如表3所示。表中列出的时间序列模型均经过残差检验, 符合要求。从表中可看出: 所有的光谱特征参量均用自回归模型AR(n)、自回归移动平均模型ARMA(p,q)以及整合的自回归移动平均模型ARMA(p,d,q)较好地模拟。其中n,p,d,q参数均小于等于2。
从最小信息准则指标看, 低培养液质量浓度(0.5 g/L)下, 浒苔水体的反射光谱特征参量 mRS705的时间序列拟合精度最低, AIC和 BIC值最高, 分别为–1258.392, –1252.109; 参量D715/D705的拟合精度最高, AIC和BIC值最低, AIC和BIC分别为35.495,41.728。中、高培养液质量浓度(2.5 g/L和5.0 g/L)下,浒苔水体的反射光谱特征参量R700/R670的拟合精度最高, AIC 和BIC值最低, AIC分别为–18.526, –27.501;BIC 分别为–12.243, –23.312。中等培养液质量浓度(2.5 g/L)下, 参量R740/R720的时间序列拟合精度最低,AIC和BIC分别为–389.218, –385.030。高培养液质量浓度(5.0g/L)下, 参量Area of Red Edge的时间序列拟合精度最低, AIC和BIC分别为–384.606, –378.323。
2.3 光谱特征参量的时间序列拟合比较
本文用均方差RMSE(root mean square error)、实测值与预测值之间的散点图来检验光谱特征参量时间序列拟合效果。拟合均方差的统计结果如表4所示。从表4中可以看出: 同一参量在不同培养液质量浓度下, 时间序列拟合均方差也存在明显差异; 同一变量在相同培养液质量浓度条件下, 时间序列ARMA拟合与曲线拟合之间的均方差差异很小, 小于 0.01, 占 55.56%; 小于 0.04, 占 66.67%。将 3种不同培养液质量浓度下, 曲线拟合和时间序列拟合精度最高的光谱特征参量的实测值与两种拟合方法下产生的预测值作散点图, 以比较这两种拟合方法的精度。结果如图2所示。图中横坐标为浒苔水体反射光谱数据测定日期每5天平均之后的数据, 纵坐标为光谱特征参量的原始数据、时间序列ARMA和曲线拟合数据每5天平均之后的数据。从图2中可以看出: 浒苔水体在低培养液质量浓度(0.5 g/L)下, 光谱特征参量R700/R670和D715/D705的原始数据与时间序列ARMA拟合数据的吻合度稍高于曲线拟合数据。浒苔水体在中等培养液质量浓度(2.5 g/L)下, 光谱特征参量R700/R670和D715/D705的原始数据与时间序列ARMA拟合数据的吻合度明显高于曲线拟合数据。浒苔水体在高培养液质量浓度(5.0 g/L)下, 光谱特征参量 RII和R700/R670的原始数据与时间序列ARMA拟合数据的吻合度明显高于曲线拟合数据。综上可知: (1)在三种浒苔水体培养液质量浓度下,应用光谱特征参量R700/R670的时间序列ARMA拟合精度较高, 可应用在未来开展大规模浒苔灾害预报预警研究。(2)时间序列ARMA拟合模型比曲线拟合模型更能体现浒苔水体反射光谱特征参量的时间序列数据的变动趋势。
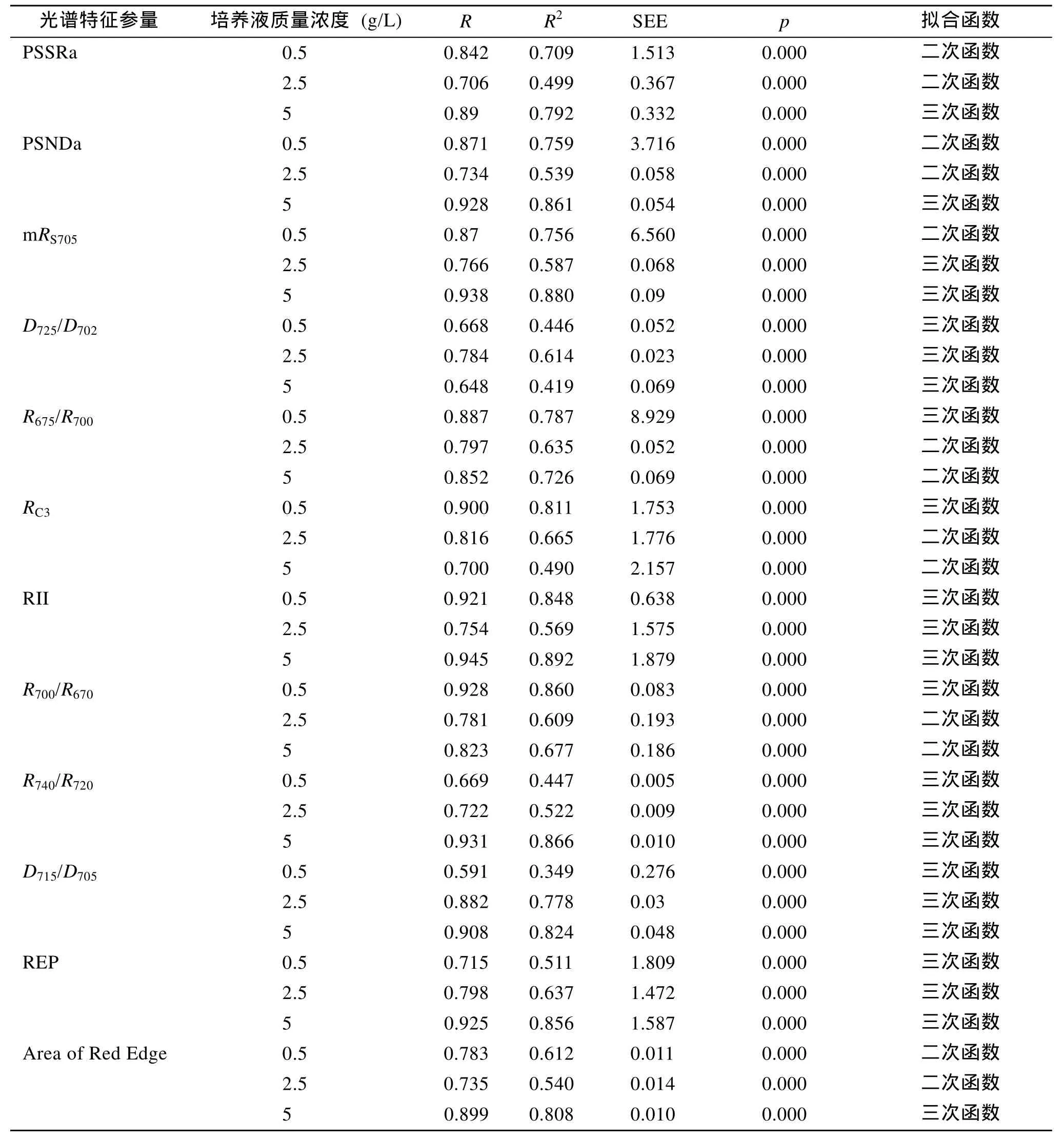
表2 光谱特征参量的曲线拟合Tab.2 Curve simulation statistics for spectral variables

表3 光谱特征参量的时间序列拟合统计Tab.3 Time series simulation statistics for spectral variables
3 结论
在实验室设置不同浓度的浒苔水体, 基于浒苔水体的光谱反射率定量提取光谱特征参量, 应用多项式和时间序列ARMA拟合法探讨浒苔水体反射光谱特征参量的时间序列特性。通过以上研究, 本文可得到如下结论。
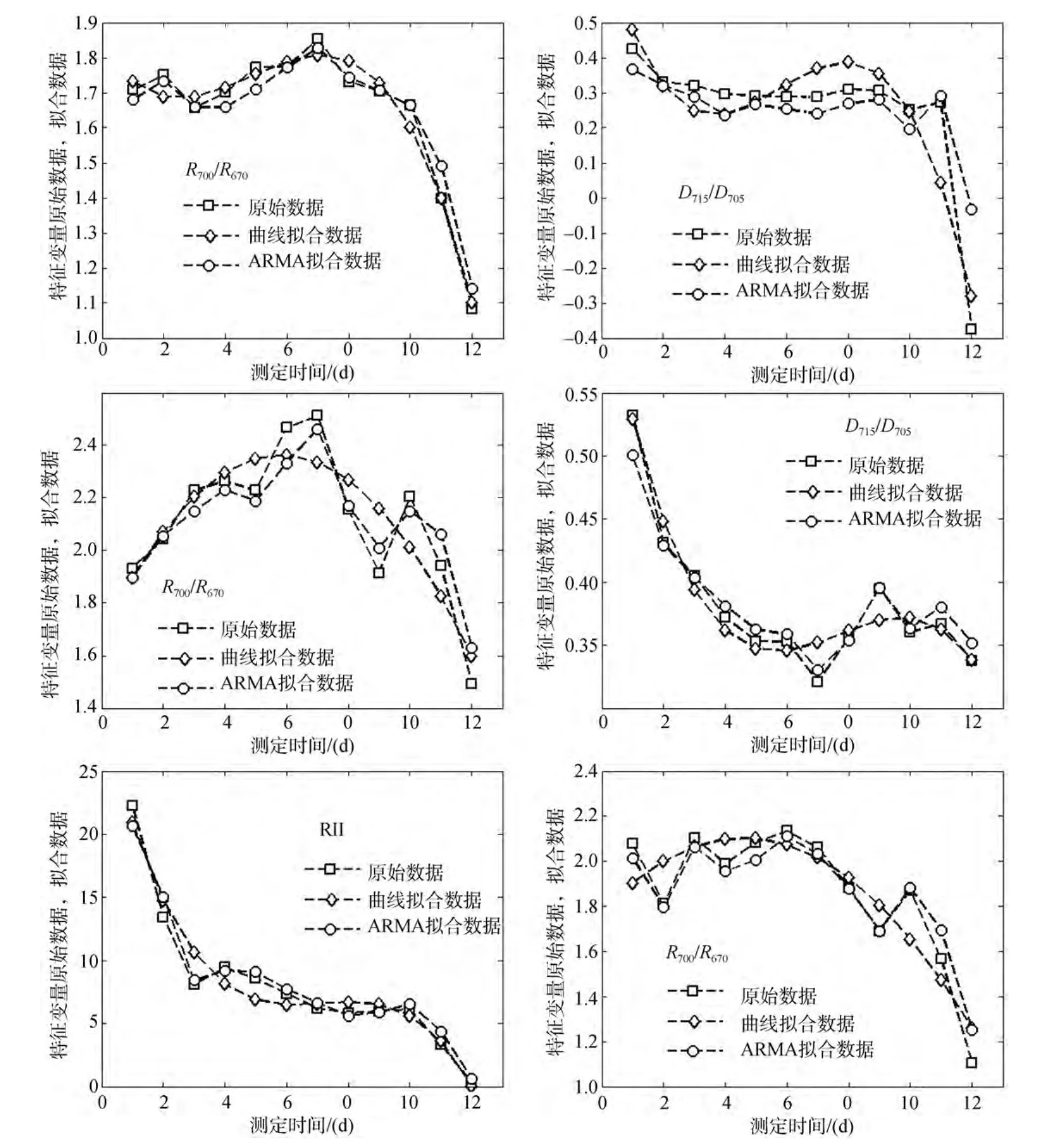
图2 浒苔水体光谱特征参量的观测值与预测值散点图Fig.2 The scatter plot of observed data and predicted data for spectral variables
1) 应用二次或三次多项式可较高精度地拟合浒苔水体的光谱特征参量时间序列数据; 但不同的培养液质量浓度下, 拟合精度最高的特征参量不同;同一光谱特征参量构建的时间序列多项式曲线拟合的阶数也不完全一致。
2) 应用时间序列 ARMA模型可较高精度地拟合浒苔水体反射光谱特征参量时间序列数据; 低培养液质量浓度(0.5 g/L)下, 浒苔水体的反射光谱特征参量D715/D705的拟合精度最高, 参量R700/R670的拟合精度仅次于D715/D705; 在中、高培养液质量浓度(2.5 g/L和5.0 g/L)下, 浒苔水体的反射光谱特征参量R700/R670的拟合精度最高。因此, 在3种浒苔水体培养液质量浓度下, 应用时间序列ARMA拟合法均能得到高精度的光谱特征参量为R700/R670。
3) 应用均方差以及光谱特征参量实测值与拟合值散点图比较多项式和时间序列 ARMA拟合精度,时间序列ARMA和多项式拟合的均方差差异很小, 3种培养液质量浓度下, 均方差差异在 0.04之内的变量占66.67%。因此, 时间序列ARMA拟合精度略高于多项式拟合, 且能较好地反映浒苔水体反射光谱特征参量时间序列数据分布和变动的特性。
本研究探讨了浒苔水体在 3种不同培养密度条件下, 光谱特征参量的时间序列拟合精度, 该研究结果可以相关政府管理部门实时动态监测浒苔灾害提供新的思路。在未来的研究中, 应加强浒苔藻体的孢子释放期和浒苔幼苗期间的光谱特征研究, 以对浒苔灾害的早期发现和预测提供帮助。
[1]Hu Chuanmin.A novel ocean color index to detect floating algae in the global oceans[J].Remote Sensing of Environment, 2009, 113: 2118-2129.
[2]蒋兴伟, 邹亚荣, 王华, 等.基于SAR快速提取浒苔信息应用研究[J].海洋学报, 2009, 31(2): 63-68.
[3]Scanlan C M, Foden J, Wells E, Best M A.The monitoring of opportunistic macroalgal blooms for the water framework directive[J].Marine Pollution Bulletin, 2007, 55: 162-171.
[4]蒋兴伟, 刘建强, 邹斌, 等.浒苔灾害卫星遥感应急监视监测系统及其应用[J].海洋学报, 2009, 31 (1) :52-63.
[5]Li Haiying, Peng Hongchun, Zhang Hui, et al.Monitoring the Burst-out of Enteromorpha prolifera in the Yellow Sea of China [EB/OL].[2013-10-31].http://spie.org/Publications/Proceedings/Paper/10.1117/12.974 617?origin_id=x4323&start_year=2012.
[6]Blackburn G A.Spectral indices for estimating photosynthetic pigment concentrations: a test using senescent tree leaves[J].International Journal of Remote Sensing, 1998, 19(4): 657-675.
[7]Buschman C, Nagel E.Invivo spectroscopy and internal optics of leaves as a basis for remote sensing of vegetation[J].International Journal of Remote Sensing,1993, 14(4): 711-722.
[8]Sims D A, Gamon J A.Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages[J].Remote Sensing of Environment, 2002, 81(2-3): 337-354.
[9]Zarco-Tejada P J, Miller J R, Mohammed G H, et al.Vegetation stress detection through chlorophyll a C b estimation and fluorescence effects on hyperspectral imagery[J].Journal of Environmental Quality, 2002,31(5): 1433-1441.
[10]Kochubey S M, Kazantsev T A.Changes in the first derivatives of leaf reflectance spectra of various plants induced by variations of chlorophyll content[J].Journal of Plant Physiology, 2007, 164 (12): 1648-1655.
[11]Maccioni A, Agati G, Mazzinghi P.New vegetation indices for remote measurement of chlorophylls based on leaf directional reflectance spectra[J].Journal of Photochemistry and Photobiology B: Biology, 2001,61(1): 52-61.
[12]Chappelle E W, Kim M S, McMurtrey III J E.Ratio analysis of reflectance spectra (RARS): An algorithm for the remote estimation of the concentrations of chlorophyll a, chlorophyll b and carotenoids in soybean leaves[J].Remote Sensing of Environment, 1992, 39(3):239-247.
[13]Gitelson A A, Buschmann C, Lichtenthaler H K.The chlorophyll fluorescence ratio F735/F700 as an accurate measure of the chlorophyll content in plants[J].Remote Sensing of Environment, 1999, 69(3): 296-302.
[14]Gitelson A A, Merzylac M N.Spectral reflectance changes associate with autumn senescence of Aesculus hippocastanum L.and Acer platanoides L.leaves Spectral features and relation to chlorophyll estimation[J].Journal of Plant Physiology, 1994, 143:286-292.
[15]Mc Murtey III, Chappelle J E , Kim E W M S, et al.Distinguish nitrogen fertilization levels in field corns(Zea mays L.) with actively induced fluorescence and passive reflectance measurements[J].Remote Sensing of Environment, 1994, 47: 36-44.
[16]Datt B.Remote sensing of chlorophyll a, chlorophyll b,chlorophyll a + b and total carotenoid content in eucalyptus leaves[J].Remote Sensing of Environment,1998, 66(2): 111-121.
[17]Datt B.Visible/near infrared reflectance and chlorophyll content in Eucalyptus leaves[J].International Journal ofRemote Sensing, 1999, 20(14): 2741- 2759.
[18]Penũelas J, Baret F, Filella I.Semi-empirical indices to assess carotenoids/chlorophyll a ratio from leaf spectral reflectance[J].Photosynthetica, 1995, 31(2): 221-230.
[19]Vogelman J E, Rock B N, Moss D M.Red edge spectral measurements from sugar maple leaves[J].International Journal of Remote Sensing, 1993, 14(8):1563-1575.
[20]Penũelas J, Gamon J A, Fredeen A L, et al.Reflectance indices associated with physiological changes in nitrogen- and water-limited sunflower leaves[J].Remote Sensing of Environment, 1994, 48: 135-146.
[21]Collins W.Remote sensing of crop type and maturity[J].Photogrammetric Engineering and Remote Sensing,1978, 44: 43-55.
[22]Filella I, Penuelas J.Red edge position and shapes as indicators of plant chlorophyll content, biomass and hydric status[J].International Journal of Remote Sensing, 1994, 15(7): 1459-1470.
[23]Barnes J D, Balaguer L, Manrique E, et al.A reappraisal of the use of DMSO for the extraction and determination of chlorophylls a and b in lichens and higher plants[J].Environmental and Experimental Botany, 1992, 32(2): 85-100.

