短角异剑水蚤对克氏双锯鱼稚鱼成活、生长和脂肪酸组成的影响
孟 振, 胡 鹏, 刘新富, 贾玉东, 刘 滨, 鲍 鹰, 张和森
(1.青岛市海水鱼类种子工程与生物技术重点实验室 中国水产科学研究院 黄海水产研究所, 山东 青岛266071; 2.中国科学院 海洋研究所, 山东 青岛 266071; 3.青岛通用水产养殖有限公司, 山东 青岛 266404)
海洋桡足类种类多、分布范围广、群体数量大,在海洋食物链中, 是构成海水鱼类仔稚鱼饵料生物的主要组成部分[1-3]。人工育苗实验中, 无论使用野外拖网采集的包含大量桡足类的浮游动物还是使用人工培养的桡足类, 都获得较好的生长效果和较高的成活率[4-8]。尤为重要的是, 桡足类每个种类的生活史含有12个不同规格的发育阶段, 提供了较宽规格幅度的生物饵料[3-6], 而且营养丰富, 特别是不饱和脂肪酸含量高, 弥补了现行的海水鱼类生物饵料体系(微藻-轮虫-卤虫无节幼体)个体大小范围有限和营养供给不足的缺陷, 可以成功应用于培育轮虫和卤虫无法饲养的经济鱼类, 如小口裂的石斑鱼类[9]和大口裂的金枪鱼[10]等。因此, 筛选合适的桡足类品种进行人工培养, 并探讨其对海水鱼类早期发育阶段的饵料价值和投喂效果, 对于解决许多名贵鱼类的苗种培育难题、提高海水鱼类人工培育苗种的质量和成活率都具有极为重要的意义。
短角异剑水蚤(Apocyclops royi)是一种广泛分布的海洋近岸小型桡足类[11], 是台湾培育石斑鱼苗常用的桡足类品种[12], 对其生理生态[13-14]的研究, 表明该品种是适于人工培养的小型饵料桡足类之一,但国内对该品种的人工培育研究尚处于起步阶段[15],也未见应用于海水鱼类育苗的报道。本实验在收集、分离和纯化培养短角异剑水蚤的基础上[16], 以重要的海水观赏鱼——克氏双锯鱼(Amphiprion clarkii,俗称红双带小丑鱼)稚鱼为实验对象, 研究了短角异剑水蚤对其生长、成活和脂肪酸组成的影响, 以验证短角异剑水蚤的饵料价值和投喂效果。
1 材料和方法
1.1 实验材料
短角异剑水蚤于2011年4月取自江苏省赣榆市一轮虫养殖池, 取回后置于150 L PVC水槽中暂养,分离、纯化后以浓缩海水小球藻为饵料培养1个月。随后转移至 3 m3的露天水泥池中充气培养, 每日投喂20 mL浓缩海水小球藻, 换水量0.5 m3/d。实验时,以350目筛绢过滤收集, 计数、消毒后投喂。
克氏双锯鱼(Amphiprion clarkii)亲鱼由青岛绚海水族科技有限公司人工培育、光温调控性腺成熟[17]。
褶皱臂尾轮虫(Brachionus plicatilis)由青岛通用水产养殖有限公司提供, 在室内 PVC水槽中充气培养, 投喂仔稚鱼前用浓缩小球藻强化 24 h, 过滤收集, 消毒后定量投喂。浓缩海水小球藻(Chlorellasp.)、卤虫(Artemiasp.)卵均购自青岛越洋进出口有限公司, 卤虫卵经孵化、去壳、小球藻营养强化、消毒后定量投喂。
1.2 实验方法
1.2.1 克氏双锯鱼受精卵孵化及初孵仔鱼收集
受精卵在原水槽中孵化, 孵化水温 26℃±1℃,pH值 7.8, 盐度 30, 微充气, 溶解氧高于 5.6 mg/L,光照强度1 000 lx, 光照周期L∶D=14 h∶10 h。待全部仔鱼孵出2 h内, 根据初孵仔鱼的趋光性, 光诱导聚集, 采收后将初孵仔鱼平均分到 2个 50 L的PVC水槽中进行投喂实验。采用不同批次受精卵重复实验一次。
1.2.2 克氏双锯鱼仔稚鱼投喂实验
2批次仔稚鱼培育水质条件同上, 每天吸底并换水2次, 10 d前每次换水量25%, 10~20 d换水量50%,同时统计各实验组死鱼数目。从孵化后1~7 d投喂褶皱臂尾轮虫, 日投喂2次, 投喂量10个/mL, 同时添加海水小球藻以调控水质颜色。从5 d至实验结束(20 d)分别投喂卤虫无节幼体(A1/A2组)和桡足类(C1/C2组)。A1/A2、C1/C2组卤虫无节幼体和桡足类投喂密度均为5个/mL, 日投喂2次。
1.2.3 卤虫无节幼体、桡足类和克氏双锯鱼稚鱼脂肪酸的测定
1.2.3.1 样品采集
卤虫无节幼体、桡足类: 卤虫无节幼体孵化8 h后, 投喂浓缩海水小球藻营养强化10 h, 饥饿12 h,分离卵壳, 经200目筛绢用蒸馏水冲洗过滤。桡足类以200目筛网收集转入新鲜海水中, 饥饿12 h清空消化道内的单胞藻, 筛滤掉排出的废物, 用蒸馏水冲洗。样品冷冻干燥24 h。
克氏双锯鱼稚鱼: 取20 d稚鱼20条, 转入新鲜海水, 饥饿24 h清空消化道内饵料, 用蒸馏水冲洗,样品冷冻干燥24 h。
1.2.3.2 样品处理
样品处理方法参考刘光兴等[18], 取冻干样品30 mg,加入1 mol/L KOH-甲醇3 mL, 在80℃水浴锅中皂化10 min, 加入2 mol/L HCl-甲醇溶液3 mL, 在80℃水浴锅中酯化反应10 min; 加入正己烷1 mL, 振荡萃取, 静止分层, 吸取上清液约 1 mL放入离心管中,低速离心5 min, 取1 μL进样测定。
1.2.3.3 脂肪酸测定
使用美国安捷伦公司7890A气相色谱仪分析测定脂肪酸的含量, 用面积归一法计算各种脂肪酸占总脂肪酸的百分含量。
1.3 数据处理

其中Lt为实验结束时稚鱼体长(mm),L0为实验开始时初孵仔鱼体长(mm),t为实验时间(d)。
采用SPSS17.0进行数据处理和统计检验。
2 结果
2.1 短角异剑水蚤和卤虫无节幼体脂肪酸组成分析
短角异剑水蚤与卤虫无节幼体脂肪酸组成的分析见表1, 几种对海水鱼类仔稚鱼具有重要营养价值的必需脂肪酸(EFA, 即n-3、n-6系列高不饱和脂肪酸 HUFA)中, 浓缩海水小球藻营养强化的卤虫无节幼体未检出 DHA(22: 6n-3), 其 EPA(20: 5n-3)、ARA(20: 4n-6)和EFA也分别仅占其总脂肪酸含量的1.408%、1.090%和3.801%, 而短角异剑水蚤DHA、EPA和ARA含量分别达21.185%、11.088%和3.250%,EFA含量为37.417%, 极显著高于卤虫无节幼体。桡足类DHA/EPA和EPA/ARA分别为1.911和3.412,卤虫无节幼体EPA/ARA为1.292。
2.2 短角异剑水蚤和卤虫无节幼体投喂对克氏双锯鱼稚鱼成活和生长的影响
5~20日龄, 投喂短角异剑水蚤的克氏双锯鱼稚鱼成活率(80.71%±8.23%)稍高于卤虫无节幼体组(76.30%±7.00%)(表2), 但两者差异不显著。短角异剑水蚤投喂组克氏双锯鱼稚鱼生长速度显著高于卤虫无节幼体组, 实验结束时体长极显著高于后者(P<0.01),体重和特定生长率均显著高于后者(P<0.05)。
2.3 克氏双锯鱼稚鱼脂肪酸组成的分析
实验结束时(20 d), 投喂短角异剑水蚤的克氏双锯鱼稚鱼DHA、EPA、ARA和EFA含量均高于卤虫无节幼体投喂组(表1), 且2个实验组的不饱和脂肪酸组成基本与饵料生物相对应。
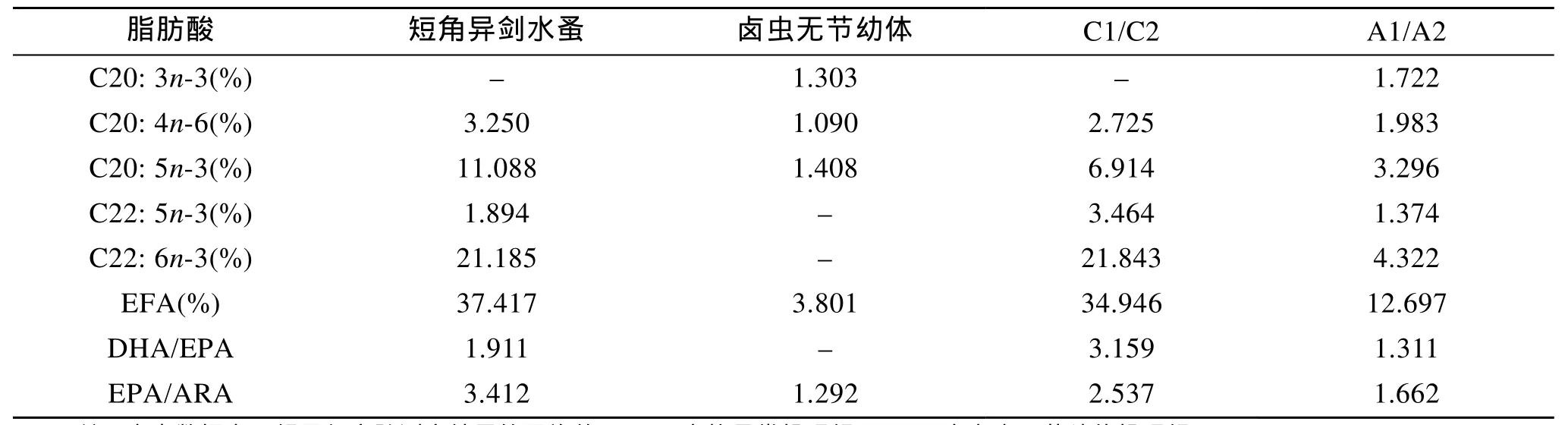
表1 短角异剑水蚤、卤虫无节幼体及实验克氏双锯鱼稚鱼脂肪酸含量的测定Tab.1 Fatty acids composition of Apocyclops royi, Artemia nauplii and juveniles of Amphiprion clarkii

表2 短角异剑水蚤和卤虫无节幼体对克氏双锯鱼稚鱼成活和生长的影响Tab.2 The survival and growth rate of Amphiprion clarkii juveniles fed with Apocyclops royi and Artemia nauplii respectively
3 讨论
生物饵料的开发和利用是海水鱼类苗种人工培育的关键技术。长期以来, 海水鱼类苗种培育主要依赖于轮虫和卤虫无节幼体作为生物饵料, 在多种鱼类苗种人工培育中取得了成效, 但由于二者个体大小范围有限、营养成分不稳定、缺乏高度不饱和脂肪酸等原因, 并非对所有经济鱼类都适用。桡足类作为海水鱼类仔稚鱼天然的饵料生物, 将其开发为生物饵料一直是海水鱼类苗种培育的研究热点之一。已有研究证实, 在使用轮虫作为海水鱼类仔鱼开口饵料的阶段结束之后, 使用桡足类替代卤虫无节幼体[2,19], 或是两者同时投喂都取得了较为满意的效果[2,20]。本实验中, 以轮虫作为克氏双锯鱼仔鱼的开口饵料, 稚鱼期单独投喂短角异剑水蚤的实验组稚鱼的成活率稍高于投喂卤虫无节幼体的实验组, 生长状态则显著优于后者, 与上述学者的研究结果相一致, 初步表明短角异剑水蚤作为海水鱼类仔稚鱼的生物饵料优于卤虫无节幼体。本实验中 2个实验组克氏双锯鱼稚鱼成活率均高于 75%, 与克氏双锯鱼苗种培育阶段死亡高峰出现在仔鱼期(孵化后 2~3日龄)有关[17]。
评价生物饵料优劣的标准除适口性(饵料大小)和运动能力外, 主要考虑其营养价值(如脂肪酸、蛋白质和自由氨基酸), 其中尤以多不饱和脂肪酸(PUFA)含量和组成为主要参数, 特别是 DHA、EPA和 ARA等海水仔稚鱼必需的高不饱和脂肪酸(HUFA)[21]。饵料中HUFA的数量和种类, 会直接影响海水仔稚鱼的生长速度、成活率、应激能力和体内相关成分的组成[22]。轮虫和卤虫作为传统生物饵料, 其体内缺乏海水鱼类仔稚鱼必需的HUFA, 需要富集饵料中 HUFA以满足海水鱼类仔稚鱼的营养需求。本实验中, 经海水小球藻强化的卤虫无节幼体仍未检出 DHA, 小球藻强化对卤虫无节幼体必需脂肪酸的组成和含量没有显著效果, 与黄旭雄等[23]所得结论一致。而仅使用海水小球藻强化的短角异剑水蚤DHA、EPA、ARA和n-3HUFA含量均较高, 暗示短角异剑水蚤可能具有自身合成 HUFA的能力, 这需要进一步实验验证, 但就必需脂肪酸种类和含量而言, 短角异剑水蚤营养价值高于卤虫无节幼体。
必需脂肪酸的比例也是衡量生物饵料脂肪酸品质的重要指标, 由于 PUFA在代谢方面存在竞争作用, 主要是DHA和EPA与ARA的竞争, 这3种重要的 HUFA的比例会直接影响海水仔稚鱼视网膜和脑的发育[24]。张其永等[25]研究鲆鲽类有眼侧色素沉积与 DHA、EPA和 ARA 的比例失调有关, 导致视网膜和脑不能正常发育, 严重影响视力; Reitan等[26]用DHA/EPA为2/1的饵料培育大菱鲆仔稚鱼, 有效地防止了大菱鲆白化的产生; McEvoy等[27]报道, 对大菱鲆和大西洋庸鲽而言, 饵料中DHA含量占总脂肪酸的6.5%~12.5%, 用EPA/ARA为4.2/1和20/1的乳化油强化活饵料, 仔稚鱼表现出正常的生长、成活率、色素和变态, 然而用EPA/ARA为1.5/1和0.5/1的乳化油强化活饵料, 仔稚鱼的色素和变态均不正常。此外, 多数海水鱼鱼卵和仔稚鱼体内, DHA/EPA的含量均为2/1左右, 而不同鱼类对ARA需求不同,欧洲鲈的 EPA/ARA的适宜值为 1/1, 大菱鲆和大西洋庸鲽的EPA/ARA的适宜比例为10∶1以上。本实验中短角异剑水蚤DHA/EPA为1.911, EPA/ARA为3.159, 均优于小球藻强化的卤虫无节幼体, 从必需脂肪酸比例分析短角异剑水蚤也更适于作为海水鱼类仔稚鱼的生物饵料加以开发利用。
本文通过分析短角异剑水蚤和卤虫无节幼体的脂肪酸组成及2种生物饵料对克氏双锯鱼稚鱼存活、生长和脂肪酸组成的影响表明, 短角异剑水蚤HUFA、DHA、EPA、ARA 含量高, DHA/EPA、EPA/ARA比值与海水鱼类仔稚鱼必需脂肪酸比例需求类似, 桡足类投喂组表现出较高的生长优势和成活率, 优于传统的生物饵料。综上所述, 短角异剑水蚤适于作为海水鱼类仔稚鱼的生物饵料, 在苗种培育产业中具有广阔的应用前景。
[1]Lee C, O'Bryen P J, Marcus N H.Copepods in Aquaculture[M].Ames, Iowa, USA: Blackwell Publishing, 2005.
[2]刘光兴, 徐东晖, 邱旭春, 等.火腿许水蚤对牙鲆仔稚鱼成活、生长及脂肪酸组成的影响[J].中国海洋大学学报(自然科学版), 2007, 37(2): 259-265.
[3]郑重, 李少菁, 连光山.海洋桡足类生物学[M].厦门: 厦门大学出版社, 1992.
[4]van der Meeren T.Selective feeding and prediction of food consumption in turbot larvae (Scophthalmus maximusL.) reared on the rotiferBrachionus plicatilisand natural zooplankton[J].Aquaculture, 1991, 93(1):35-55.
[5]Naess T, Germain-Henry M, Naas K E.First feeding of Atlantic halibut (Hippoglossus hippoglossus) using different combinations ofArtemiaand wild zooplankton[J].Aquaculture, 1995, 130(2-3): 235-250.
[6]A review on the status and progress in rearing copepods for marine larviculture: Advantages and disadvantages among calanoid, harpacticoid and cyclopoids copepods[C]//Avances en nutrición acuicola (Vol.Ⅷ).Mazatlán,Sinaloa, México: Memorías del Octavo Simposium Internacional de Nutrición Acuícola, 2006.
[7]Støttrup J G, Richardson K, Kirkegaard E, et al.The cultivation ofAcartia tonsaDana for use as a live food source for marine fish larvae[J].Aquaculture, 1986,52(2): 87-96.
[8]Støttrup J G, Norsker N H.Production and use of copepods in marine fish larviculture[J].Aquaculture,1997, 155(1-4): 231-247.
[9]Toledo J D, Golez M S, Ohno A.Use of Copepod Nauplii During Early Feeding Stage of GrouperEpinephelus coioides[J].Fisheries Science, 1999, 65(3):390-397.
[10]Deveney M R, Bayly T J, Johnson C J, et al.A parasite survey of farmed Southern bluetin tuna,Thunnus maccoyii(Castelnau)[J].Journal of Fish Diseases, 2005,28(5): 279-284.
[11]刘俊鹏, 赵文, 王珊, 等.短角异剑水蚤胚胎发育和幼体发育的研究[J].大连水产学院学报, 2007, 22(4):239-245.
[12]Lee K, Dahms H, Park H G, et al.Population growth and productivity of the cyclopoid copepodsParacyclopina nana,Apocyclops royiand the harpacticoid copepodTigriopus japonicusin mono and polyculture conditions: a laboratory study[J].Aquaculture Research, 2012: 1-5.
[13]张文炳.桡脚类短角异剑水蚤之生理生态学研究[D].中国台北: 台湾大学, 1992.
[14]许家兴.食物及温度对短角异剑水蚤生长及生殖的影响[D].中国台湾高雄: 中山大学, 1988.
[15]刘敏, 陈世杰.短角异剑水蚤的培养试验[J].福建水产, 1995(9): 19-22.
[16]孟振, 王国栋, 刘新富, 等.环境因素对短角异剑水蚤摄食的影响[J].海洋科学, 2013, 37(01): 81-86.
[17]鲍鹰, 张鹏, 祝承勇, 等.红小丑人工繁殖和育苗的初步研究[J].海洋科学, 2009, 33(2): 5-10.
[18]刘光兴, 崔建丽, 黄瑛.几种单胞藻对火腿许水蚤脂肪酸组成的影响[J].厦门大学学报: 自然科学版,2006, 45(A02): 250-255.
[19]Kraul S, Nelson A, Brittain K, et al.Evaluation of Live Feeds for Larval and Postlarval MahimahiCoryphaena hippurus[J].Journal of the World Aquaculture Society,1992, 4(23): 299-306.
[20]Leu M, Chou Y.Induced spawning and larval rearing of captive yellowfin porgy,Acanthopagrus latus(Houttuyn)[J].Aquaculture, 1996, 143(2): 155-166.
[21]汤保贵, 陈刚, 吴灶和.海水仔鱼开口生物饵料的研究进展[J].饲料研究, 2006(4): 43-44.
[22]许友卿, 庄丽, 丁兆坤.多不饱和脂肪酸对海水仔稚鱼生长发育的影响及机理[J].饲料工业, 2010, 31(14):13-18.
[23]黄旭雄, 王瑞, 吕耀平, 等.不同强化饵料对卤虫必需脂肪酸组成的影响[J].水产科学, 2005, 24(10):1-4.
[24]许友卿, 张海柱, 丁兆坤.二十二碳六烯酸和二十碳五烯酸的代谢研究[J].水产科学, 2007, 26(10):580-583.
[25]张其永, 洪万树.海洋养殖鱼类仔稚鱼摄食和营养研究的进展[J].台湾海峡, 2001, 20(z1): 1-10.
[26]Reitan K I, Rainuzzo J R, Olsen Y.Influence of lipid composition of live feed on growth, survival and pigmentation of turbot larvae[J].Aquaculture International, 1994, 2(1): 33-48.
[27]McEvoy L A, Estevez A, Bell J G, et al.Influence of dietary levels of eicosapentaenoic and arachidonic acid on the pigmentation success of turbot (Scophtalmus maximus) and halibut (Hippoglossus hippoglossus)[J].Bulletin of the Aquaculture Association of Canada,1998, 98: 17-20.
——以“不同咖啡因饮料对水蚤心率的影响”为例

