尤瑞克林对脑缺血再灌注大鼠脑组织中IGF-1和IGF-1R表达水平的影响及其机制
王杰华,李国前,杨小霞,洪诸权
(福建医科大学附属泉州第一医院神经内科,福建 泉州 362000)
脑缺血性损伤后机体组织中有一个复杂的、多基因作用的神经保护网络,其中胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)在该网络中起重要作用[1-2]。IGF-1作为一种特异性神经营养因子,可维持神经细胞生长、抑制其凋亡,并有助于神经细胞受损后的功能恢复[3]。尤瑞克林可以减少脑缺血损伤面积,减轻神经功能损伤[4],但其具体作用机制尚未明确。本研究采用线栓法建立大鼠脑缺血再灌注损伤模型,给予尤瑞克林进行干预,探讨尤瑞克林对IGF-1和胰岛素样生长因子1受 体(insulin-like growth factor 1receptor,IGF-1R)表达的影响和意义。
1 材料与方法
1.1 实验动物和主要试剂 成年雄性SD大鼠24只,体质量250~300g,由福建医科大学实验动物中心提供(使用许可证号:SCXK闽20042002)。注射用尤瑞克林(0.15PNAU/瓶,广东天普生化医药股份有限公司);Trizol试剂(美国Invitrogen公司);逆转录试剂盒及PCR试剂盒(立陶宛 MBI Fermentas公司);兔抗大鼠IGF-1和IGF-1R抗体(美国Santa Cruz公司);即用型免疫组织化学试剂盒(鼠/兔,福州迈新生物技术开发有限公司);β-actin和辣根酶标记IgG(北京中杉金桥生物技术有限公司);Beyo ECL和Western荧光检测试剂(中国碧云天生物技术公司);引物合成由上海生物工程有限公司完成。
1.2 动物分组及给药 24只大鼠随机分为假手术组、模型组和实验组,每组8只。模型组和实验组参考改良Longa线栓法[5]制备大鼠大脑中动脉栓塞模型。血流阻断2h后拔出线栓,形成再灌注。
假手术组大鼠接受相似手术处理,但是不插入线栓。实验组大鼠于再灌注后5min静脉注射尤端克林(用灭菌生理氯化钠溶液稀释至3.5×10-3PNAU·kg-1),剂量为1mL·kg-1。假手术组和模型组大鼠正常喂养。
1.3 模型处理和取材部位 大鼠再灌注48h后,以10%水合氯醛腹腔麻醉后,仰卧固定,迅速开胸暴露心脏。经左心室行主动脉插管,剪开右心耳作为灌注液流出口,在10~20min内经左心室灌注200mL生理盐水快速冲洗,取出全脑,滤纸吸去表面水分,去除嗅球、小脑和脑干。冰盘上迅速分离大脑半球,弃去左侧大脑半球,取右侧半球,取大鼠视交叉后6~11mm处的脑组织备用。
1.4 RT-PCR 法 检 测 大 鼠 脑组织 中 IGF-1和IGF-1RmRNA的表达 IGF-1上游引物序列:5′-TGCAAAGGAGAAGGAAAGGAAG-3′,下游引物序列:5′-TCAGCAGCCAAAATTCAGAGAG-3′,扩增产物长度为499bp;IGF-1R上游引物序列:5′-AAACGCTGACCTCTGTTACCTCTC-3′,下游引物序列:5′-GCGGATGAAGCCTGATGGAC-3′,扩增产物长度为505bp;内参β-actin上游引物序列:5′-ACCGTGAAAAGATGACCCAGAT-3′,下游引物序列:5′-AGCTGTGGTGGTGAAGCTGTAG-3′,扩增产物长度为269bp。取缺血侧脑组织按Trizol法提取总RNA并进行逆转录反应。PCR扩增反应条件:94℃、30s,64℃、30s,72℃、30s,共34个循环。反应完毕后扩增产物进行电泳,半定量分析电泳条带的吸光度(A)值,结果以目的基因与β-actin A值的比值表示。
1.5 免疫组织化学法检测大鼠脑组织中IGF-1和IGF-1R的表达水平 大鼠脑组织切片经脱蜡至水,30mL·L-1H2O2室温孵育5~10min,高压修复2~5min;加入一抗兔抗大鼠IGF-1和IGF-1R抗体(工作浓度约为1∶100),4℃湿盒孵育过夜;再加入滴加生物素化小鼠抗兔的二抗,室温30min,AEC显色10~20min(显微镜下控制显色程度);自来水充分冲洗,终止反应,苏木素复染;滴加水性封片剂,干燥后中性树胶封片。各步骤间用0.01mol·L-1PBS冲洗5min×3次,以阳性细胞计数表示IGF-1和IGF-1R的表达水平。阳性细胞计数:在400倍光学显微镜下分别随机选取5个视野,分别计数免疫反应阳性的细胞数。
1.6 Western blotting法检测大鼠脑组织中IGF-1和IGF-1R蛋白的表达水平 取大鼠缺血侧脑组织100mg置于玻璃匀浆器中,加入裂解液,严格按照说明书进行蛋白提取,然后采用BCA法测定蛋白浓度。取25μg蛋白,变性后垂直电泳,电转至PVDF膜,用含10%脱脂奶粉的TBS室温封闭2h,分别加入一抗(兔抗大鼠IGF-1和IGF-1R抗 体,1∶500;兔抗大鼠β-actin 抗体,1∶1500),4℃ 孵育过夜,用含0.1%Tween-20 的TBS洗涤3次,然后与辣根过氧化物酶标记的羊抗兔IgG(1∶2000)室温孵育1h,重复洗涤3次,最后用ECL液显色,X片显影、定影。采用Image J图像分析测定Western blotting条带的灰度值,结果以IGF-1、IGF-1R与β-actin灰度值的比值表示。
1.7 统计学分析 采用SPSS 17.0统计软件进行统计学分析。大鼠脑组织中IGF-1和IGF-1R mRNA和蛋白表达水平、IGF-1和IGF-1R阳性细胞数以表示,组间比较采用方差分析。
2 结 果
2.1 各组大鼠脑组织中IGF-1和IGF-1RmRNA表达水平 假手术组大鼠脑组织中IGF-1和IGF-1RmRNA呈低水平表达。实验组和模型组大鼠脑组织中IGF-1和IGF-1RmRNA表达水平高于假手术组(P<0.05)。实验组大鼠脑组织中IGF-1和IGF-1RmRNA表达水平高于模型组(P<0.05)。见表1和图1。
表1 各组大鼠脑组织中IGF-1和IGF-1RmRNA表达水平Tab.1 Expression levels of IGF-1and IGF-1RmRNA in brain tissue of rats in various groups (n=8,)

表1 各组大鼠脑组织中IGF-1和IGF-1RmRNA表达水平Tab.1 Expression levels of IGF-1and IGF-1RmRNA in brain tissue of rats in various groups (n=8,)
*P<0.05 vs sham operation group;△P<0.05 vs model group.
IGF-1mRNA IGF-1RmRNA Sham op Group eration 0.179±0.038 0.257±0.045 Model 0.320±0.054* 0.453±0.064*Experiment 0.425±0.062*△ 0.537±0.066*△
2.2 各组大鼠脑组织中IGF-1和IGF-1R阳性细胞数 IGF-1和IGF-1R阳性细胞胞浆染色呈浅红色或红色。假手术组大鼠脑组织切片中见少量散在IGF-1和IGF-1R阳性细胞。实验组和模型组大鼠脑组织切片中IGF-1和IGF-1R阳性细胞数高于假手术组(P<0.05)。实验组大鼠脑组织切片中IGF-1和IGF-1R阳性细胞数高于模型组(P<0.05)。见表2和图2(插页六)。
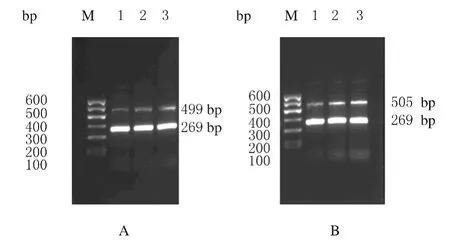
图1 各组大鼠脑组织中IGF-1(A)和IGF-1R(B)mRNA表达电泳图Fig.1 Electrophoregram of expressions of IGF-1(A)and IGF-1R(B)mRNA in brain tissue of rats in various groups
表2 各组大鼠脑组织中IGF-1和IGF-1R阳性细胞数Tab.2 Number of IGF-1and IGF-1Rpositive cells in brain tissue of rats in various groups (n=8,)

表2 各组大鼠脑组织中IGF-1和IGF-1R阳性细胞数Tab.2 Number of IGF-1and IGF-1Rpositive cells in brain tissue of rats in various groups (n=8,)
*P<0.05 vs sham operation group;△P<0.05 vs model group.
ositive cells Sham op Group No.of IGF-1 positive cells No.of IGF-1R p eration 13.24±2.94 12.52±3.45 Model 29.10±5.78* 34.54±6.35*Experiment 41.28±8.52*△ 56.41±9.28*△
2.3 各组大鼠脑组织中IGF-1和IGF-1R蛋白表达水平 假手术组大鼠脑组织中IGF-1和IGF-1R蛋白呈低水平表达。实验组和模型组大鼠脑组织中IGF-1和IGF-1R蛋白表达水平高于假手术组(P<0.05)。实验组大鼠脑组织中IGF-1和IGF-1R蛋白表达水平高于模型组(P<0.05)。见表3和图3。
表3 各组大鼠脑组织中IGF-1和IGF-1R蛋白表达水平Tab.3 Expression levels of IGF-1and IGF-1Rproteins in brain tissue of rats in various groups (n=8,)

表3 各组大鼠脑组织中IGF-1和IGF-1R蛋白表达水平Tab.3 Expression levels of IGF-1and IGF-1Rproteins in brain tissue of rats in various groups (n=8,)
*P<0.05 vs sham operation group;△P<0.05 vs model group.
rotein Sham op Group IGF-1protein IGF-1Rp eration 0.17±0.03 0.12±0.04 Model 0.35±0.05* 0.54±0.06*Experiment 0.71±0.09*△ 0.68±0.08*△

图3 各组大鼠脑组织中IGF-1(A)和IGF-1R(B)蛋白表达电泳图Fig.3 Electrophoregram of expressions of IGF-1(A)and IGF-1R(B)proteins in brain tissue of rats in various groups
3 讨 论
IGF-1是一种活性蛋白多肽物质,几乎可作用于所有的组织细胞[6],其与受体IGF-1R结合后启动胞内信号转导,可促进细胞增殖分化,有效地抑制细胞程序性死亡。IGF-1系大脑发育所必需,在正常脑组织的生长发育中发挥重要作用;IGF-1与IGF-1R的结合可防止神经细胞凋亡、增加血管发生和神经发生等多种途径减轻缺氧缺血对脑组织的损害[7-10]。IGF-1与IGF-1在正常脑组织有少量表达,而脑缺血损伤发生后,脑组织中IGF-1与IGF-1R表达水平即明显增加[11]。本研究采用线栓法建立大鼠脑缺血再灌注损伤模型,采用RT-PCR、免疫组织化学法和Western blotting法检测大鼠缺血区脑组织中IGF-1和IGF-1R表达的结果显示:在相应时间点各组大鼠脑组织中IGF-1和IGF-1RmRNA及蛋白表达趋势一致,大鼠脑缺血再灌注损伤后缺血区脑组织中IGF-1和IGF-1RmRNA及蛋白的表达明显升高,提示缺血性损伤应激可促进脑组织中IGF-1和IGF-1R的生成。
注射用尤瑞克林(人尿激肽原酶)是从人尿液中提取精制的糖蛋白,有效成分为人尿激肽原酶,是激肽释放酶-激肽系统的一个正向调节物质。脑组织缺血损伤后整个激肽释放酶-激肽系统,包括激肽原酶、激肽均会一过性地升高,激肽受体表达也上调,表明激肽原酶-激肽系统参与脑缺血病理生理过程[12]。注射用尤瑞克林除了可以通过激肽途径选择性扩张缺血区域脑血管,增加局部血液灌注而发挥作用外,还可以抑制神经元和神经胶质细胞的凋亡过程,减少局部炎性细胞的浸润,诱导神经干细胞(NSCs)的分化、迁移和成熟,增加局部血管的再生,促进侧支血管的建立和开放[13-14]。动物脑缺血模型研究[15]表明:静脉注射尤瑞克林对脑梗死、脑缺血再灌注损伤和急性脑缺血再灌注损伤恢复期动物均有改善作用,能显著缩小脑梗死面积,改善神经症状并减少脑组织含水量。本实验在大鼠脑缺血再灌注损伤模型的基础上,应用尤瑞克林进行干预,结果显示:实验组大鼠缺血区脑组织中IGF-1和IGF-1R的mRNA和蛋白的表达高于模型组,提示尤瑞克林可进一步促进内源性IGF-1和IGF-1R的合成与表达。IGF-1和IGF-1R的表达上调,可调控下游信号通路,从而减轻缺血性脑损伤病情的发展,发挥神经保护作用。
[1]刘 杨,苗宇船,郭继龙 .大鼠脑损伤早期胰岛素样生长因子-1和Bcl-2的表达变化[J].山西医药杂志,2012,41(3):222-224.
[2]Sharma HS.Neuroprotective effects of neurotrophins and melanocortins in spinal cord injury:an experimental study in the rat using pharmacological and morphological approaches[J].Ann N Y Acad Sci,2005,1053(1):407-421.
[3]Cao Y,Gunn AJ,Bennet L,et al.Insulin-like growth factor(IGF )-1suppresses oligodendrocyte caspase-3 activation and increase glial proliferation after ischemia in inear-term fetal shep [J].J Cereb Blood Flow Metab,2003,23(6):739-747.
[4]Emanueli C,Madeddu P.Angiogenesis therapy with human tissue kallikrein for the treatment of ischemic diseases [J].Arch Mal Coeur Vaiss,2004,97(6):679-687.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]张 云,王维群.胰岛素样生长因子-1(IGF-1)在运动性脊髓损伤中的作用 [J].运动人体科学,2013,3(6):22-23.
[7]Boucher M,Pesant S,Lei YH,et al.Simultaneous administrationof insulin-like growth factor-1and darbepoetin alfa protects the rat myocardium against myocardial infarction and enhances angiogenesis [J].Clin Transl Sci,2008,1(1):13-20.
[8]李文媛,王 莹,刘 洋.脂肪源性干细胞穴位注射对大鼠脑缺血再灌注后胰岛素样生长因子1及其受体表达的影响 [J].中国临床保健杂志,2012,15(4):397-400.
[9]Cui QL,Fragoso G,Miron VE,et al.Response of human oligodendrocyte progenitors to growth factors and axon signals[J].J Neuropathol Exp Neurol,2010,69(9):930-944.
[10]Serbedzija P,Madl JE,Ishii DN.Insulin and IGF-1prevent brain atrophy and DNA loss in diabetes [J].Brain Res,2009,1303(11):179-194.
[11]刘 楠,郑 安,陈玉玲,等.急性脑梗死患者血清胰岛素样生长因子1和胰岛素样生长因子结合蛋白3水平的变化 [J].中国动脉硬化杂志,2002,10(4):338-340.
[12]赵晓霞,胡风云.尤瑞克林对大鼠神经细胞凋亡的影响 [J].中国实用医刊,2013,40(1):1-4.
[13]凌 莉,曾进胜,裴 中,等.激肽释放酶促进实验性大鼠大脑皮质梗死后内源性神经干细胞的增殖、迁移和分化 [J].中华神经科杂志,2008,41(9):628-632.
[14]李国前,王杰华,杨小霞,等.尤瑞克林对大鼠脑缺血再灌注损伤Bcl-2和Bax表达的影响 [J].中国老年医学杂志,2011,30(9):770-773.
[15]赵晓霞,胡风云.激肽原酶-尤瑞克林治疗缺血性脑血管病研究进展 [J].中国实用医刊,2012,39(12):101-102.

