Wnt/β-catenin通路关键分子在NK/T细胞淋巴瘤组织中的表达及其临床意义
秦贝贝,李亚青,李小丽,路礼莎,张旭东,张明智
(1.郑州大学第一附属医院淋巴瘤诊疗中心,河南 郑州 450052;2.河南省高等学校临床医学重点学科开放实验室,河南 郑州 450052)
NK/T 细胞淋巴瘤(NK/T cell lymphoma,NKTCL)是非霍奇金淋巴瘤的一个亚型,其在亚洲和拉丁美洲发病率明显高于欧美国家。NKTCL的病理特征为血管中心性浸润与破坏,常伴明显的组织坏死,具有高度侵袭性、化疗不敏感和预后差的特点[1]。Wnt/β-catenin信号通路调控细胞生长增殖及凋亡等过程,其异常持续性激活参与了肿瘤的发生、侵袭及转移[2]。已有研究[3-5]证实:该通路在结直肠癌、乳腺癌、套细胞淋巴瘤、弥漫大B细胞淋巴瘤和白血病中有异常激活,但其在NKTCL中的作用鲜有报道。本研究拟分析 Wnt/β-catenin信号通路中关键分子β-catenin、c-myc和cyclinD1在NKTCL细胞株SNK-6、YTS 及NKTCL组织中的表达情况,并将其与NKTCL患者临床特征和预后进行相关性分析,进一步探讨Wnt/β-catenin信号通路在NKTCL发病过程中的临床意义。
1 资料与方法
1.1 一般资料 收集2011年1月—2013年8月郑州大学第一附属医院病理科病理明确诊断为NKTCL的石蜡包埋组织50例,其中男性32例,女性18例,年龄15~75岁,平均年龄46岁,病变均位于鼻腔。取同期的20例淋巴结反应性增生组织作为对照,男性12例,女性8例,年龄17~62岁,平均年龄40岁。NKTCL诊断依照2008年WHO标准:病理改变为瘤细胞血管中心性浸润并破坏血管,瘤细胞具有NK细胞表型或毒性T细胞表型以及细胞毒表型并与EB病毒感染密切相关。临床分期按照Ann Arbor分期,其中Ⅰ期5例,Ⅱ期29例,Ⅲ期10例,Ⅳ期6例。所有患者均未做过放疗和化疗,入院后行放疗、化疗或综合治疗。每例患者均登记临床资料,随访采用电话、查阅病案资料等方法,随访截止至2014年2月,生存期以确诊至死亡时间(完全数据)或至随访截止时间(截断数据)计算。
1.2 主要试剂 RPMI 1640培养基购自Solarbio生物医药公司;无支原体胎牛血清购自杭州四季青公司;总RNA提取试剂Trizol购自美国Invitrogen公司;反转录试剂盒购自美国Fermentas生物有限公司;SYBR Green Mixture购自北京康为世纪生物公司;PCR引物由上海生物工程有限公司合成;兔抗人β-catenin、c-myc单克隆抗体、免疫组织化学SP染色试剂盒和DAB显色剂均购自北京中杉金桥有限公司。
1.3 细胞培养 SNK-6和YTS细胞株为本实验室长期保存。用含1000U·mL-1白细胞介素2(IL-2)、1%非必需氨基酸和10%胎牛血清的RPMI 1640培养液培养细胞,于37℃、5%CO2培养箱中进行常规悬浮细胞培养,每2~3d传代1次,选取对数生长期细胞备用。
1.4 细胞系总RNA提取及反转录 取对数生长期的细胞,Trizol法提取RNA,经RNA纯度检测A260/A280均在1.80~2.00。参照 Fermentas逆转录试剂盒说明书逆转录合成cDNA,并于-20℃保存备用。
1.5 Real-time PCR法检测SNK-6、YTS和正常NK细胞中β-catenin、c-myc及cyclinD1mRNA 的相对表达水平 PCR反应体系:采用25μL体系,模板2.0μL,上、下游引物混均后取2.0μL,SYBR荧光酶12.5μL。反应条件为预变性95℃、10min,变性95℃、15s,变性/延伸 60℃、1min,共40个循环,最后延伸8min。同时以正常NK细胞作为对照,实验设置3个副孔且重复3次。采用ABI Prism 7500SDS Software软件进行数据处理,mRNA相对表达水平= 2-ΔΔCt,ΔΔCt=ΔCt细胞株-ΔCt正常NK=(Ct细胞株-Ctβ-actin)-(Ct正常NK-Ctβ-actin)。引物序列见表1。
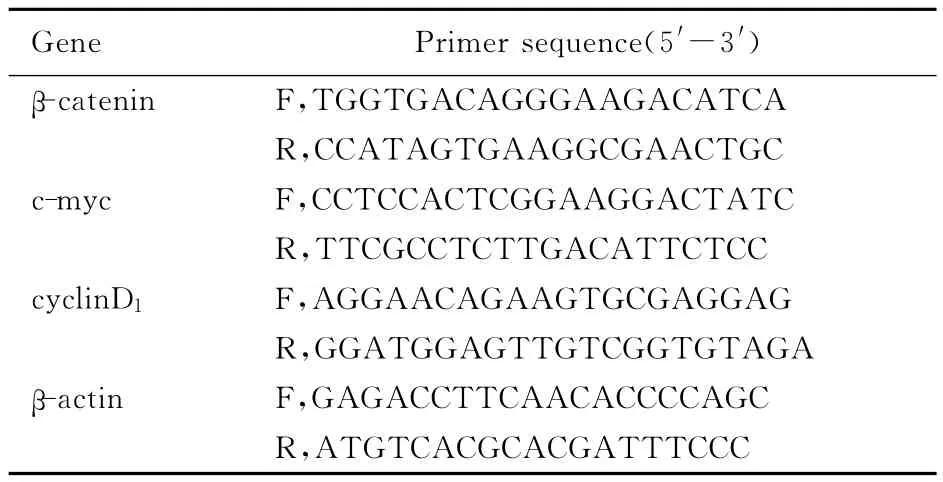
表1 基因的引物序列Tab.1 Primer sequences of genes
1.6 免疫组织化学SP法检测NKTCL组织和反应性增生的淋巴组织中β-catenin、c-myc蛋白的表达 调节SNK-6和YTS细胞浓度至1×106mL-1,细胞涂片(载玻片经多聚赖氨酸处理),室温下自然晾干,置于4%多聚甲醛固定液中固定30min,放入0.5%Triton溶液中20min,PBS液冲洗后,室温下自然凉干后4℃保存。石蜡切片常规脱蜡、水化,3%H2O2去除内源性过氧化物酶及微波炉修复抗原后,PBS冲洗3次,每次3min,10%正常山羊血清室温下孵育以减少背景非特异性染色,滴加一抗(1∶300稀释),4℃过夜,PBS漂洗后滴加二抗,室温孵育30min,DAB显色,苏木素复染,脱水、透明、封片。用PBS代替一抗作为阴性对照。
1.7 免疫组织化学结果判定标准 在显微镜下随机选择10个高倍镜视野(×400),每个视野计数100个细胞进行观察。β-catenin和c-myc均位于细胞核和(或)细胞浆,阳性染色呈棕黄色颗粒。根据肿瘤细胞阳性表达染色强度和阳性细胞数百分比评分。染色强度评分:无色或与背景均匀一致的淡黄色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分(细胞着色深浅需与同一切片背景着色对照)。阳性细胞数百分比评分:阴性为0分,小于10%为1分,10%~50%为2分,大于50%为3分。两积分乘积:0分为阴性(-),1~3分为弱阳性(+),4~6分为中等阳性(⧺),7~9分为强阳性(⧻)。所有染色结果由本院病理科2名医生采用双盲法判定,判断不一致时再共同进行观察。
1.8 统计学分析 采用SPSS 17.0软件进行统计学分析。β-catenin、c-myc、cyclinD1mRNA 的相对表达水平以表示,组间比较采用t检验;β-catenin和c-myc表达阳性率组间比较采用χ2检验;β-catenin和c-myc蛋白表达与患者临床特征的相关性分析采用Spearman等级相关分析;β-catenin表达与NKTCL患者中位总生存期的关系分析采用Kaplan-Meier法。
2 结 果
2.1 NKTCL细胞株SNK-6和YTS中β-catenin、c-myc和cyclinD1mRNA表达水平 细胞株SNK-6中β-catenin、c-myc和cyclinD1mRNA相对表达水平为 0.036±0.003、0.064±0.004和0.042±0.004,细胞株YTS中β-catenin、c-myc和cyclinD1mRNA 相对表达水平为0.022±0.002、0.040±0.003和0.035±0.004,其相对表达水平均高于正常 NK 细胞(0.010±0.002、0.026±0.003和0.008±0.001)(P<0.05)。
2.2 NKTCL组织和反应性增生的淋巴结组织中β-catenin、c-myc和cyclinD1的表达 β-catenin和c-myc均定位于细胞浆和(或细胞核)。在 YTS(图1A和B,见插页二)和SNK-6(图1C和D,见插页二)细胞中,β-catenin和c-myc均呈阳性表达,在正常NK细胞中则呈阴性表达(图1E和F,见插页二)。β-catenin在NKTCL组织中阳性表达率为24%(12/50),在20例反应性增生的淋巴结组织中未见阳性表达(图2A和B,见插页二)。NKTCL组织中c-myc阳性表达率为56%(28/50),反应性增生的淋巴结组织中c-myc阳性表达率为25%(5/20)(图2C和D,见插页二)。NKTCL组织中β-catenin和c-myc的阳性表达率明显高于反应性增生的淋巴结组织(P<0.05)。
2.3 不同临床特征NKTCL患者的β-catenin和c-myc蛋白表达 β-catenin蛋白表达与 Ann Arbor分期有关联(P<0.05),c-myc蛋白表达与 Ann Arbor分期、Ki-67水平有关联(P<0.05),而二者表达与其他临床指标均无关联(P>0.05)。见表2。
2.4 NKTCL患者中β-catenin和c-myc表达的相关性 28例c-myc阳性表达的患者中β-catenin阳性表达有9例;22例c-myc阴性表达的患者中β-catenin阳性表达有3例。经Spearman秩相关分析,β-catenin和c-myc在NKTCL患者中的表达呈正相关关系(r=0.770,P<0.05)。

表2 不同临床病理特征NKTCL患者β-catenin和c-myc蛋白表达Tab.2 Expressions ofβ-catenin and c-myc proteins of NKTCL patients with different clinicopathological features
2.5 β-catenin表达与NKTCL患者中位总生存期的关系 50例NKTCL患者中,可随访者41例,存活25例,死亡16例,生存随访期为6~36个月,平均生存期为29.714个月(95%CI:26.606~32.823),β-catenin阳性表达患者平均生存期为(23.662±2.768)个月,β-catenin阴性表达患者平均生存期为(31.656±1.780)个月,经Logrank检验,β-catenin表达阳性与阴性患者者平均生存期差异有统计学意义(χ2=5.193,P<0.05)。见图3。
3 讨 论
Wnt信号通路与多种肿瘤的发生发展有密切关联。正常情况下,细胞膜表面和细胞膜下有极少量β-catenin参与细胞间黏附。Wnt信号通路激活时,异常积累的β-catenin进入细胞核,与核内转录因子或淋巴细胞增强因子结合,激活下游靶基因c-myc、cyclinD1的转录,导致肿瘤细胞异常增殖、浸润和转移[6]。此外,β-catenin能诱导正常细胞向瘤性转化,因此β-catenin被认为是致癌基因[7]。

图3 β-catenin表达与NKTCL患者总体生存期关系的Kaplan-Meier曲线Fig.3 Kaplan-Meier curves for relationship between expression ofβ-catenin and overall survival rate of NKTCL patients
麦玉洁等[8]在多种白血病/淋巴瘤细胞株中检测到β-catenin的转录和表达水平升高以及细胞核的异常定位,其过量表达提示Wnt信号转导途径可能在淋巴瘤细胞中有异常激活。Bellei等[9]研究发现:弥漫大B细胞淋巴瘤患者组织中的β-catenin存在mRNA转录水平及蛋白表达水平的升高,并与患者的临床分期显著相关。
本研究结果显示:Wnt信号通路中关键组分β-catenin和下游靶基因c-myc、cyclinD1在SNK-6、YTS细胞和NKTCL组织中有不同程度表达,提示该通路可能在NKTCL组织中异常激活。c-myc基因属于原癌基因,当其表达增加时,可以刺激细胞增生和诱导细胞凋亡[10]。在淋巴反应性增生组织中亦检测到c-myc的阳性表达,表明其并不是恶性肿瘤的特有标志,只提示细胞增生的活跃程度。cyclinD1基因是细胞周期调节因子,调节细胞从G1期到S期的进程[11]。β-catenin与c-myc的相关分析结果显示:两者存在一定的关联,但并不是相互对应,因此 Wnt/β-catenin只是参与NKTCL发生发展的信号通路之一[12]。免疫组织化学结果显示:β-catenin的表达与Ann Arbor分期有关联,c-myc的表达与 Ann Arbor分期、Ki-67水平有关联,二者与患者年龄、性别、IPI评分、LDH水平、EBER和疗效等均无关联。Kaplan-Meier法分析结果显示:β-catenin阴性者比阳性者生存时间长,平均生存期分别约为31和23个月。
Wnt/β-catenin信号通路的异常激活,一定程度上促进了NKTCL的发生发展,因此其有望成为监测病情、评估预后的指标。该通路中的重要位点已经尝试被用于靶向治疗。抗真菌药环吡酮胺和利尿药依地尼酸可抑制经典Wnt通路在淋巴瘤LY-8和Raji细胞中的激活,并可导致其细胞活性降低及细胞凋亡发生[13]。栎精是黄酮类物质的典型代表,可以通过降解β-catenin、抑制β-catenin与核内转录因子蛋白结合、转录因子与特定基因位点的结合,进而发挥抗肿瘤作用,经栎精处理后多种淋巴瘤细胞株可观察到明显的增殖抑制和细胞凋亡现象[14]。
NK/T细胞淋巴瘤是一种具有高度侵袭性的恶性肿瘤,其确切的发病机制尚未清楚[15]。Wnt通路在淋巴细胞发育、分化以及在细胞黏附、极化和运动等方面发挥重要作用,但其与恶性淋巴瘤的发病、侵袭性及治疗方案等关系有待进一步研究。本研究结果显示:Wnt通路中关键分子在NKTCL组织中高表达,提示该通路的异常激活可能在NKTCL的发生发展中起一定作用,有利于进一步阐明其发病机制,并获得基于该通路的靶向治疗的可能。
[1]Suzuki R.Extranodal NK/T-cell lymphoma [J].Nihon Rinsho,2014,72(3):524-530.
[2]MacDonald BT,Tamai K,He X.Wnt/β-catenin signaling:components,mechanisms,and diseases [J].Dev Cell,2009,17(1):9-26.
[3]Ge X,Lv X,Feng L.High expression and nuclear localization ofβ-catenin in diffuse large B-cell lymphoma [J].SMol Med Rep,2012,5(6):1433-1437.
[4]Gelebart P,Anand M,Armanious H,et al.Constitutive activation of the Wnt canonical pathway in mantle cell lymphoma [J].Blood,2008,112(13):5171-5179.
[5]Kaveri D,Kastner P,Dembélé D,et al.β-Catenin activation synergizes with Pten loss and Myc overexpression in Notch-independent T-ALL [J].Blood,2013,122(5):694-704.
[6]Sharma A,Sen JM.Molecular basis for the tissue specificity ofβ-catenin oncogenesis [J].Oncogene,2013,32(15):1901-1909.
[7]Zhang XY,Wang X.Roles of signal transduction pathway in non-Hodgkin's lymphoma [J].Zhongguo Shi Yan Xue Za Zhi,2011,19(2):532-536.
[8]麦玉洁,邱录贵,李增军,等.β-catenin在白血病细胞系中表达的研究 [J].中国实验血液学杂志,2007,15(4):919-922.
[9]Bellei B,Pacchiarotti A,Perez M,et al.Frequent betacatenin overexpression without exon 3mutation in cutaneous lymphomas[J].Mod Pathol,2004,17(10):1275-1281.
[10]Huang X,Sun Q,Fu H,et al.Both c-Myc and Ki-67 expression are predictive markers in patients with Extranodal NK/T-cell lymphoma,nasal type:A retrospective study in China [J].Pathol Res Pract,2014,210(6):351-356.
[11]Ng SB,Selvarajan V,Huang G,et al.Activated oncogenic pathways and therapeutic targets in extranodal nasal-type NK/T cell lymphoma revealed by gene expression profiling [J].J Pathol,2011,223(4):496-510.
[12]Shao N,Zou J,Li J,et al.Hyper-activation of WNT/β-catenin signaling pathway mediates anti-tumor effects of histone deacetylase inhibitors in acute T lymphoblastic leukemia [J].Leuk Lymphoma,2012,53(9):1769-1778.
[13]Schmidt M,Sievers E,Endo T,et al.Targeting Wnt pathway in lymphoma and myeloma cells [J].Br J Haematol,2009,144(5):796-798.
[14]Kawahara T,Kawaguchi-Ihara N,Okuhashi Y,et al.Cyclopamine and quercetin suppress the growth of leukemia and lymphoma cells [J].Anticancer Res,2009,29(11):4629-4632.
[15]Li S,Feng X,Li T,et al.Extranodal NK/T-cell lymphoma,nasal type:a report of 73cases at MD Anderson Cancer Center[J].Am J Surg Pathol,2013,37(1):14-23.

