流式分析人脂肪组织中血管周围干细胞含量的方法探究
徐峰,刘舒云,王鑫,彭江,卢世璧,袁玫,许文静,郭全义
流式分析人脂肪组织中血管周围干细胞含量的方法探究
徐峰,刘舒云,王鑫,彭江,卢世璧,袁玫,许文静,郭全义
目的 建立人脂肪组织中分离血管周围干细胞(PSCs)的方法,并研究其在脂肪组织细胞中所占的比例,为血管周围干细胞作为骨和软骨组织工程新的种子细胞奠定基础。
方法 取人的脂肪组织分别用 I 型胶原酶和 II 型胶原酶消化得到血管基质成分(SVF),用细胞计数仪及流式细胞仪检测 SVF 中细胞密度、活细胞比例和 PSCs 细胞所占的比例。
结果 用细胞计数仪分析得出用 II 型胶原酶消化脂肪组织所得到的 SVF 中活细胞比例更高,且差异具有统计学意义(P < 0.01),而细胞密度有增高趋势(P = 0.18)。用流式细胞仪检测得出使用 II 型胶原酶消化脂肪组织所得 SVF 中 PSCs 比例更高,且差异具有统计学意义(P < 0.01)。使用 I 型胶原酶消化每 10 ml 脂肪组织中可以分离得到PSCs 活细胞为(7.98 ± 2.38)× 105个,使用 II 型胶原酶消化则每 10 ml 脂肪组织中可以分离得到 PSCs 活细胞为(16.68 ± 4.56)× 105个。
结论 使用 II 型胶原酶消化脂肪组织可以得到更多的血管周围干细胞 PSCs,其在脂肪组织中的含量可以满足骨和软骨损伤后自体细胞移植修复的需要。
血管周围干细胞; 流式细胞术; 种子细胞
干细胞作为组织工程的种子细胞是再生医学中重要的组成部分,目前应用于骨和软骨组织工程领域的种子细胞主要有骨髓干细胞[1]和脂肪干细胞[2]等,然而从目前常用方法分离出的干细胞往往不纯净和不均一[3-4],从而影响了其应用的效果,寻找来源较方便,获得量大且较纯的间质干细胞是目前组织工程研究的重要内容。
目前国家卫计委医疗管理规范不允许干细胞体外扩增后应用于临床,而从患者自体脂肪组织中分离的未经体外扩增的干细胞按照政策却可以应用于临床。最近被人们认识并大量研究的一种新型干细胞——血管周围干细胞(perivascular stem cells,PSCs)成为了骨和软骨组织工程种子细胞新的选择,其在患者脂肪组织中直接大量分离后有望应用于临床治疗中且符合国家政策[5-6]。血管周围干细胞 PSCs 被认为是纯净的间充质干细胞[7-8],其包括两种不同的干细胞亚群[8-9],分别为存在于毛细血管等最小血管周围的血管外周细胞和存在于较大血管周围的血管外膜细胞。血管外周细胞的细胞表面标记为 CD146+、CD45-、CD34-;血管外膜细胞的表面标记为 CD146-、CD45-、CD34+,根据表面抗原标记进行流式细胞分选是分离 PSCs 的主要方法[6]。然而目前血管外周细胞 PSCs 的分选方法尚不成熟。本研究旨在探索出一种较好的高效的PSCs 的分选方法,比较使用不同胶原酶消化脂肪组织对 PSCs 得率的影响,并研究 PSCs 及血管外周细胞和血管外膜细胞在脂肪组织中的含量,为PSCs 作为骨和软骨组织工程种子细胞和应用于临床治疗提供基础研究和理论支持。
1 材料与方法
1.1 材料
人腹部脂肪颗粒来自解放军总医院整形科20 ~ 40 岁行脂肪抽吸术女性(n = 10)(均经过患者本人同意);I 型胶原酶、II 型胶原酶购自美国Sigma 公司;DMEM、PBS 液、培养皿、50 ml 离心管均购自美国 Corning 公司;CD146-PE 荧光标记流式抗体、CD34-APC 荧光标记流式抗体、CD45-FITC 荧光标记流式抗体、70 目滤网、血细胞裂解液、流式管、流式细胞仪均购自美国 BD 公司;磁力搅拌器购自德国 IKA 公司;Cellometer Auto T4 全自动细胞计数分析仪购自深圳达科为生物技术有限公司。
1.2 方法
1.2.1 分离脂肪组织血管基质成分 行无菌的人抽脂术后脂肪颗粒样本 10 个,于 4 ℃ 小心保存备用。将每个标本平分为 2份,分别用 PBS 液清洗3 遍,以 2000 r/min 速度离心 5 min 后得到脂肪颗粒约 10 ml。将每个样本中的 2 份脂肪颗粒分别转移入无菌小玻璃瓶中,其中一份加入用 DMEM配制好的无菌的 1 mg/ml I 型胶原酶 20 ~ 30 ml,另一份加入用 DMEM 配制好的无菌 1 mg/ml,II 型胶原酶 20 ~ 30 ml,再放入磁力搅拌器转子,以 120 r/min 速度,在 37 ℃ 恒温箱中转子消化45 min。将所得液体以 1800 r/min 速度离心 5 min,去除上层的液体,将下层沉淀加入 5 ml 血细胞裂解液充分混匀,室温下静置 10 min 后用 1800 r/min离心,弃上清,加入 PBS 液将所得沉淀吹打悬浮后用 70 μl 滤网过滤后得到单细胞悬液,用 PBS液洗涤 3 遍后即得到脂肪组织血管基质成分(stromal vascular fraction,SVF)。
1.2.2 台盼蓝染色后用全自动细胞计数分析仪进行细胞得率分析 将每个样本所得两份 SVF 分别于 1800 r/min 离心 5 min 后加入 1 ml PBS 液重新悬浮,取其中 20 μl 液体用台盼蓝染色,用细胞计数仪按说明书操作分别进行细胞密度、活细胞比例分析。
1.2.3 用流式细胞仪鉴定血管外周干细胞 将每个样本所得的两份 SVF 都分别加入流式管中,再分别加入 CD146-PE、CD34-APC、CD45-FITC 荧光抗体,于室温下在无光处孵育 15 min,再加入1 ml PBS 液后充分混匀,以 1800 r/min 速度离心5 min 后弃上清,加入 500 μl PBS 液吹打为单细胞悬液,用流式细胞仪检测其中血管外周细胞(CD146+、CD45-、CD34-)和血管外膜细胞(CD146-、CD45-、CD34+)的比例。
1.3 统计学处理
采用 SPSS13.0 进行统计学处理。正态分布的连续变量以± s 描述,两组间的比较采用独立样本 t 检验;非正态分布的连续变量以 M(Q1 ~Q3)描述,组间比较采用 Mann-Whitney U 非参数检验进行统计学分析。P < 0.05 为差异具有统计学意义。
2 结果
2.1 全自动细胞计数分析仪分析两种胶原酶消化所得 SVF细胞密度和活细胞比例
细胞计数仪分析后进行统计分析(表 1):用I 型胶原酶消化脂肪组织所得的 SVF 中平均活细胞比例为(65.11 ± 6.73)%,平均细胞密度为(81.64 ± 7.54)× 105个/ml,每 10 ml 脂肪组织中平均可以得到(53.48 ± 9.28)× 105个活细胞。用 II 型胶原酶消化脂肪组织所得的 SVF 中平均活细胞比例为(75.16 ± 4.64)%,平均细胞密度为(85.89 ± 5.04)× 105个/ml,每 10 ml 脂肪组织中平均可以得到(64.55 ± 5.57)× 105个活细胞。由此可见,使用 II 型胶原酶消化脂肪组织与使用 I 型胶原酶相比得到的活细胞比例更高,且差异具有统计学意义(P < 0.05),得到的细胞密度和细胞总数有增高的趋势(P = 0.18)。在研究中有一个样本可能因保存、患者本身因素、取材部位影响或者操作出现问题等原因,使用 I 型胶原酶和 II 型胶原酶消化后活细胞的比例分别为 24.6% 和 23.8%,为避免这一极值的出现对研究结果的影响将其舍去,故只统计其余 9 个样本。

表1 血管基质成分SVF中的细胞密度和活细胞比例Table 1 The cell density and proportion of living cells analysis
2.2 流式细胞仪鉴定血管外周干细胞
用流式细胞仪检测两种胶原酶消化所得 SVF,图 1 A、图 2A 中方框所示分别为 I 型胶原酶、II型胶原酶消化所得 SVF 中CD45-细胞。图 1B、图 2B 中左上象限分别表示 I 型胶原酶、II 型胶原酶消化所得 CD45-SVF 细胞中 CD146+CD34-细胞,即血管外周细胞。图 1B、图 2B 中右下象限分别表示 I 型胶原酶、II 型胶原酶消化所得CD45-SVF 细胞中 CD146-CD34+细胞,即血管外膜细胞。
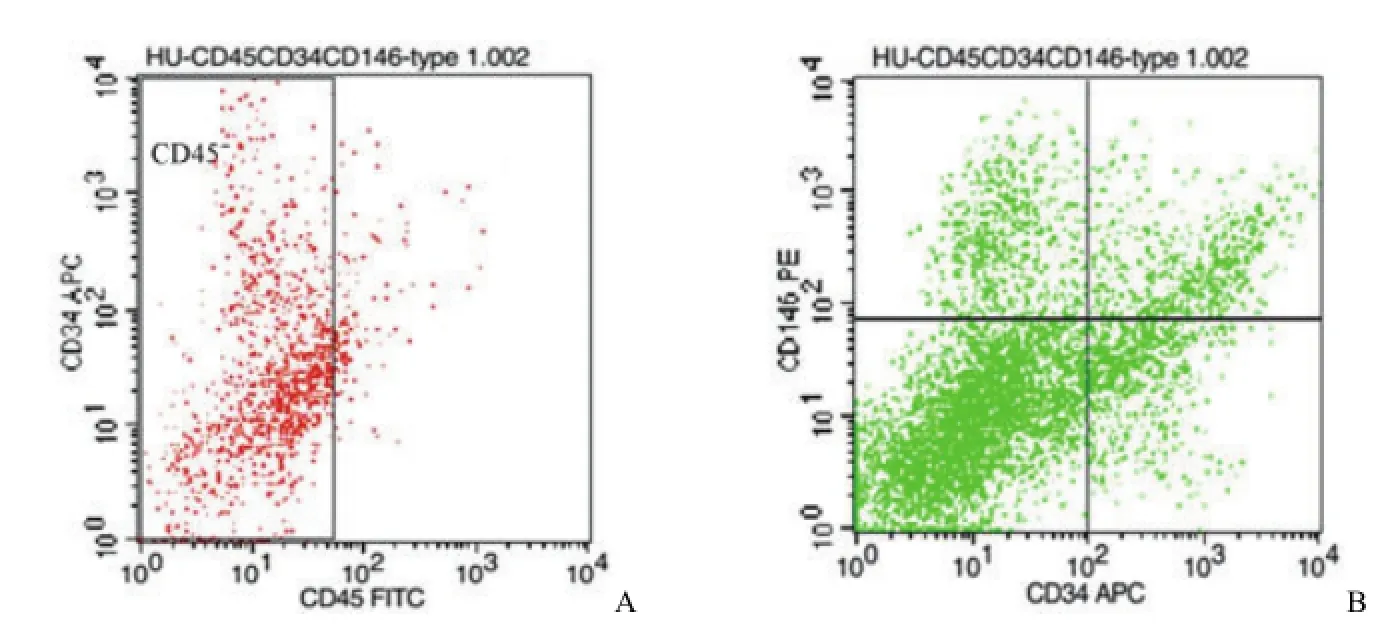
图1 I 型胶原酶消化组Figure 1 The proportion of PSCs digested by collagenase type I

图2 II 型胶原酶消化组Figure 2 The proportion of PSCs digested by collagenase type II

表2 血管外周干细胞在脂肪组织细胞中的含量Table 2 The content of PSCs in 10 ml human adipose tissue
通过流式细胞仪所得数据结合细胞计数仪所得细胞总数进行统计分析可以得出,使用两种胶原酶消化所得 SVF(n = 9)中细胞构成(表 2):使用 I 型胶原酶消化所得 SVF 中 CD45-细胞所占比例平均为(86.49 ± 3.59)%,血管外周细胞所占比例平均为(3.02 ± 2.32)%,血管外膜细胞所占比例平均为(11.83 ± 2.08)%,PSCs(即血管外周细胞与血管外膜细胞之和)所占比例平均为(14.85 ± 2.85)%,每 10 ml 脂肪组织中可以分离得到 PSCs活细胞为(7.98 ± 2.38)× 105个,血管外周细胞(1.69 ± 1.61)× 105个,血管外膜细胞(6.29 ± 1.38)× 105个。使用 II 型胶原酶消化所得 SVF 中CD45-细胞所占比例平均为(93.62 ± 3.97)%,血管外周细胞所占比例平均为(5.78 ± 2.48)%,血管外膜细胞所占比例为(20.01 ± 6.15)%,PSCs 所占比例为(25.79 ± 6.26)%,每 10 ml 脂肪组织中可以分离得到 PSCs 活细胞为(16.68 ± 4.56)× 105个,血管外周细胞为(3.69 ± 1.45)× 105个,血管外膜细胞(12.99 ± 4.51)× 105个。
总的来说,使用 II 型胶原酶消化脂肪组织与使用 I 型胶原酶相比得到的 PSCs、血管外周细胞和血管外膜细胞的比例更高、细胞数目更多,差异具有统计学意义(P < 0.05)。
3 讨论
目前,在骨和软骨组织工程中广泛应用的种子细胞分为骨髓来源的间充质干细胞 BMSCs、脂肪来源的间充质干细胞 ADSCs、滑膜来源的间充质干细胞 SMSCs 以及自体软骨细胞。虽然这些种子细胞在骨与软骨的组织工程修复中都发挥了良好的功能[10-12],甚至有些已经应用到了临床治疗中,然而实际应用中软骨细胞、骨髓间充质干细胞和滑膜干细胞依然存在着来源不足、获取过程要进行有创操作、体外培养难以快速获得修复缺损所需的大量细胞及长时间培养中细胞的去分化和老化等问题[13-15]。即使脂肪来源的间充质干细胞具有来源充足、取材方便、对人体造成的创伤较小且容易获得大量细胞等优势,但是所获的细胞为多种细胞的集合体,不纯的细胞对骨和软骨的修复效果影响很大[14],且细胞体外培养传代的过程中明显影响干细胞的基因变化[16],从而影响增殖分化等功能。
PSCs 被认为是一种纯净的间充质干细胞,其经过流式细胞仪分选后可不经过体外培养直接进行自体细胞移植,极大地保留了干细胞原有的功能和性质,克服了之前已有的种子细胞所存在的种种问题,且已经被美国食品药品管理局认证为安全有效可以应用于临床治疗[9]。而只有建立一种较好的高效的分选方法,PSCs 才能作为一种成熟的种子细胞进行实验和临床应用,其在脂肪组织中含量的多少、能否较容易地获得大量的细胞也是其能否作为组织工程种子细胞并临床应用的关键。
根据国内外文献,培养脂肪来源的干细胞ADSCs 需用 I 型胶原酶将脂肪组织消化得到血管基质成分 SVF[17-18]。血管周围干细胞 PSCs 作为ADSCs 中的一种成分,其分离方法根据文献[6,8-9]却需用 II 型胶原酶将脂肪组织消化得到血管基质成分 SVF。应用两种胶原酶消化脂肪组织所得 SVF的差异却无人研究。根据本实验的研究结果,使用II 型胶原酶消化脂肪组织所得的活细胞比例更高,所得细胞总数亦有增高的趋势,所得 PSCs、血管外周细胞和血管外膜细胞比例也更高。所以使用II 型胶原酶消化脂肪组织来分离 PSCs 更加合适。
文献中对于 PSCs 在脂肪组织中的含量的报道存在争议。James 等[8]认为在人脂肪组织的血管基质成分中血管周围干细胞 PSCs 所占比例平均为 43.2%,其中血管外周细胞所占比例平均为19.5%,血管外膜细胞所占比例平均为 23.8%。而Yoshimura 等[19]则认为人脂肪组织的血管基质成分中血管外周细胞的比例很低。通过本实验的研究发现脂肪组织中 PSCs 所占比例平均为 25.79%,血管外周细胞平均为 5.78%,血管外膜细胞平均为20.01%。虽然 PSCs 在脂肪组织中的含量不高,尤其是血管外周细胞含量更是极低,但每 10 ml 脂肪组织中平均可以得到(16.68 ± 4.56)× 105个血管周围干细胞 PSCs 或者(3.69 ± 1.45)× 105个血管外周细胞。根据软骨修复临床指南,修复 1 cm2软骨缺损需用 1 × 106个细胞,每修复 1 cm2软骨缺损只需要大约 30 ml 脂肪组织来获取 1 × 106个血管外周细胞,因此抽脂术完全可以满足需要。所以从脂肪组织中分离 PSCs 细胞可以满足骨和软骨损伤后移植自体干细胞修复所需的细胞量。
综上,本实验优选了从脂肪组织中分离血管周围干细胞 PSCs 的分离方法,研究了 PSCs 在人脂肪组织中的含量,为其在骨和软骨组织工程中作为种子细胞的临床应用奠定了基础。
[1]Shi CJ, Wang PF, Xin DS, et al. Bone marrow stromal cells seeded in acellular dermal matrix scaffolds for cartilage regeneration. Orthop J China, 2014, 22(12):1111-1118. (in Chinese)时长江, 王鹏飞, 辛大森, 等. 自体 BMSCs复合改建脱细胞真皮
基质体内构建组织工程软骨的实验研究. 中国矫形外科杂志, 2014,22(12):1111-1118.
[2]Zhang W, Zhang X, Wang S, et al. Comparison of the use of adipose tissue-derived and bone marrow-derived stem cells for rapid bone regeneration. J Dent Res, 2013, 92(12):1136-1141.
[3]Xu X, Gao J, Wu JC, et al. Study on proliferation and differentiation of various subpopulations in human mesenchymal stem cells. Sci Technol Eng, 2009, 9(20):5963-5967, 5986. (in Chinese)
许啸, 高杰, 吴家昌, 等. 人骨髓间充质干细胞不同亚群增殖分化的研究. 科学技术与工程, 2009, 9(20):5963-5967, 5986.
[4]Tallone T, Realini C, Bohmler A, et al. Adult human adipose tissue contains several types of multipotent cells. J Cardiovasc Transl Res,2011, 4(2):200-210.
[5]Crisan M, Yap S, Casteilla L, et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell,2008, 3(3):301-313.
[6]Corselli M, Chen CW, Sun B, et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev, 2012, 21(8):1299-1308.
[7]Chen CW, Montelatici E, Crisan M, et al. Perivascular multi-lineage progenitor cells in human organs: regenerative units, cytokine sources or both? Cytokine Growth Factor Rev, 2009, 20(5-6):429-434.
[8]James AW, Zara JN, Zhang X, et al. Perivascular stem cells: a prospectively purified mesenchymal stem cell population for bonetissue engineering. Stem Cells Transl Med, 2012, 1(6):510-519.
[9]James AW, Zara JN, Corselli M, et al. An abundant perivascular source of stem cells for bone tissue engineering. Stem Cells Transl Med, 2012, 1(9):673-684.
[10]Via AG, Frizziero A, Oliva F. Biological properties of mesenchymal stem cells from different sources. Muscles Ligaments Tendons J, 2012,2(3):154-162.
[11]Wang SP. The research progress on cell sources of cartilage tissue engineering. Chin J Aesthetic Med, 2012, 21(11):1655-1658. (in Chinese)
王师平. 组织工程软骨种子细胞研究进展. 中国美容医学, 2012,21(11):1655-1658.
[12]Zhao WJ, Xing GS, Yu SL. Application of synovium-derived mesenchymal stem cells in tissue engineering. Chin J Reparative Reconstr Surg, 2011, 25(12):1504-1507. (in Chinese)
赵文君, 邢国胜, 于顺禄. 滑膜间充质干细胞及其在组织工程中的应用. 中国修复重建外科杂志, 2011, 25(12):1504-1507.
[13]Fraser JK, Wulur I, Alfonso Z, et al. Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol, 2006,24(4):150-154.
[14]Hui JH, Li L, Teo YH, et al. Comparative study of the ability of mesenchymal stem cells derived from bone marrow, periosteum, and adipose tissue in treatment of partial growth arrest in rabbit. Tissue Eng, 2005, 11(5-6):904-912.
[15]Li JX, Sun HY, Yuan J, et al. Osteogenesis ability of purified hADSCs through flow cytometry sorting in vitro. J Tissue Eng Reconstr Surg,2010, 6(6):311-314. (in Chinese)
李俊宪, 孙恒赟, 袁捷, 等. 流式细胞仪分选纯化人脂肪干细胞体外成骨活性的实验研究. 组织工程与重建外科杂志, 2010, 6(6):311-314.
[16]SanMartin A, Johansson F, Samuelson L, et al. Microarray analysis reveals moderate gene expression changes in cortical neural stem cells cultured on nanowire arrays. J Nanosci Nanotechnol, 2014, 14(7):4880-4885.
[17]Fraser JK, Zhu M, Wulur I, et al. Adipose-derived stem cells. Methods Mol Biol, 2008, 449:59-67.
[18]Tian L, Sun XF, Liu HB, et al. Isolation, culture and biological characteristics of human adipose-derived stem cells in vitro. Chin J Tissue Eng Res, 2012, 16(32):5946-5952. (in Chinese)
田霖, 孙筱放, 刘海波, 等. 人脂肪干细胞的分离培养与生物学特性. 中国组织工程研究, 2012, 16(32):5946-5952.
[19]Yoshimura K, Shigeura T, Matsumoto D, et al. Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates. J Cell Physiol, 2006, 208(1):64-76.
Methods Stromal vascular fraction (SVF) was got from human adipose tissue that was digested by collagenase type I or collagenase type II. The cell density, proportion of living cells and proportion of PSCs in SVF were tested by the cell count and flow cytometry (FCM).
Results The proportion of living cells in SVF digested by collagenase type II was much higher through analyzing by the cell count and the difference was statistically significant (P < 0.01). The cellular density in SVF digested by collagenase type II tend to increase (P = 0.18). The proportion of PSCs in SVF digested by collagenase type II was much higher through analyzing by the flow cytometry,and the difference was statistically significant (P < 0.01). (7.98 ± 2.38) × 105PSCs were got in 10 ml human adipose tissue digested by collagenase type I, while (16.68 ± 4.56) × 105PSCs were got in 10 ml human adipose tissue digested by collagenase type II.
Conclusion A higher amount of PSCs can be got from human adipose digested by collagenase type II, and the content of PSCs in the adipose tissue can satisfy the needs of autologous cell transplantation for the bone and cartilage repair.
The method of sorting out perivascular stem cells from human adipose tissue through flow cytometry
XU Feng, LIU Shu-yun, WANG Xin, PENG Jiang, LU Shi-bi, YUAN Mei, XU Wen-jing, GUO Quan-yi
Objective To establish the method of sorting out perivascular stem cells (PSCs) from human adipose tissue and study the proportion of these cells in adipose tissue cells. This research is to explore new seed cells for the bone and cartilage tissue engineering.
Perivascular stem cells; Flow cytometry; Seed cells
GUO Quan-yi, Email:doctorguo@163.com
10.3969/cmba.j.issn.1673-713X.2015.03.006
国家自然科学基金(81472092);国家高技术研究发展计划(863 计划)(2012AA020502)
100853 北京,解放军总医院骨科研究所(徐峰、刘舒云、王鑫、彭江、卢世璧、袁玫、许文静、郭全义);830000 兰州军区乌鲁木齐总医院骨科(王鑫)
郭全义,Email: doctorguo@163.com
2015-03-12
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):223-227
Author Affiliations: Orthopaedic Research Institute, General Hospital of People's Liberation Army, Beijing 100853, China (XU Feng, LIU Shu-yun, WANG Xin, PENG Jiang, LU Shi-bi, YUAN Mei, XU Wen-jing, GUO Quan-yi); Urumqi General Hospital of Lanzhou Commend of PLA, Urumqi 830000, China (WANG Xin)
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):223-227

