使用Corning®Transwell®渗透支持物进行趋化性或侵袭试验的优化考虑
Hilary Sherman,Pilar Pardo,Todd Upton
·技术与方法·
使用Corning®Transwell®渗透支持物进行趋化性或侵袭试验的优化考虑
Hilary Sherman,Pilar Pardo,Todd Upton
趋化性和侵袭试验对于研究伤口愈合、细胞分化、细胞通讯、胚胎发育和肿瘤转移是有帮助的。由于这些生物体系的复杂性,对建立结构清晰、具重现性的研究模型进行优化是必不可少的。尽管已有对于已知的化学诱导物、细胞接种密度和孵育时间的资料可用,但是对于特定的模型系统所知信息仍然有限。以下内容着重讨论使用通透性支持物进行趋化性和侵袭试验时,优化实验和获取精确结果所需要考虑的重要因素。
选择正确的 Transwell 通透性支持物系统
趋化性和侵袭试验的一个最至关重要的因素就是选择合适的 Transwell 通透性支持物。其主要需考虑两个方面,哪种孔径可获得最理想的结果,哪种形式最适用于测试。孔径取决于使用的迁移细胞。如果孔径太小,将没有空间进行迁移,因为细胞不能简单地通过改变它们的形状来穿过孔。而另一方面,如果孔径太大,细胞可能直接从孔中落下造成不精确的迁移实验结果。一般来说,小细胞如白细胞推荐使用 3.0 μm 孔,更大细胞如内皮和上皮细胞用 5.0 μm 或者8.0 μm 孔。
选择合适的 Transwell 体系时,应考虑到想要获得有统计学意义的高质量数据需要多少孔(包括复孔和对照)。建议每个样品至少 3 个重复。正确的对照对于理解和证实实验结果同样重要。趋化性实验中,对照包括不含化学诱导物的孔(阴性对照)和带有已知化学诱导物的孔(阳性对照)。另外,使用含有非转移细胞的孔(内有化学诱导物)(如MCF7 在 FBS 中)也可有助于确定其中有无非自发性转移发生。操作侵袭试验时,对照包括不含细胞外基质蛋白屏障来评估迁移和侵袭的差别,此外,包含一个非侵袭细胞系的孔对于确定屏障确实阻止了侵袭也很重要(如 NIH3T3)。了解所需的对照和样品能够帮助确定选择何种 Transwell微孔板(如 24 孔 Transwell 嵌套或者高通量筛选 HTS Transwell-96 微孔板)。
计数迁移的细胞
选择合适的方法来计数迁移(侵袭)细胞是趋化性试验的重要部分。方法的选择取决于多种因素,包括可用的设备、试剂价格、细胞类型和分析的通量。如果细胞是非贴壁的,可简单地收集在储藏微孔板中,然后可用多种计数方法进行计数,如血球计数板、流式细胞仪或者活细胞染色试验(如MTT、荧光染色)。如果细胞是贴壁的,可轻轻擦拭通透性支持物膜的顶端移除未迁移的细胞,然后固定、染色迁移到膜下层的细胞。在膜上固定和染色细胞可使用显微镜进行计数确定迁移或侵袭百分比(图 1 和图 2)。使用这种方法计数时,应确保计数足够多的区域,才能正确代表细胞总数,因为有时细胞倾向迁移到嵌套的中心或者边缘。其他常见计数贴壁细胞的方法包括从膜上解离或者裂解细胞,然后使用不同的试剂或者试验试剂盒来计数迁移细胞(如钙黄绿素AM)。尽管第二种细胞计数方法成本更高,但是它速度更快,能够提高通量和减少差异。对于有关分离或标记细胞用来计数的更多信息请参考文献图书馆 http://www.corning. com/lifesciences 中的化学迁移和侵袭方案。
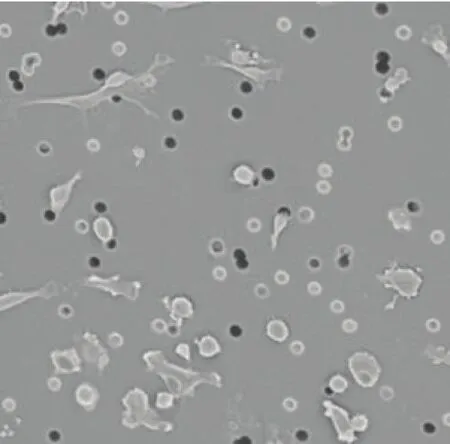
图1 HT1080 细胞扫描电镜图片(× 500)

图2 迁移细胞染色[HT1080 在 5.0 μm 聚碳酸酯膜上结晶紫染色(× 48)]
优化接种密度
使用最理想的接种密度是细胞迁移试验中的另一个重要的因素,可以确保获得最高的信噪比。如果使用细胞太少,由于样品数量太小,没有足够的细胞通过试验进行精确的计数。相反的是,如果细胞太多,孔中细胞过饱和,计数区域或者试验信号可能导致结果不精确。用已知的化学诱导物对细胞进行浓度梯度实验,确定用于分析和细胞计数最理想的细胞接种密度(图 3)。
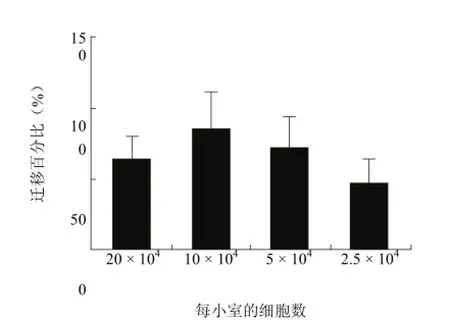
图3 迁移试验中接种密度的重要性(优化 HT1080 接种密度,用于 24 h 迁移穿过 8.0 μm 聚碳酸酯膜)
优化化学诱导物浓度
化学诱导物对于每一个迁移或者侵袭试验的成功至关重要。因而,当决定使用哪种化学诱导物时,测定多个浓度可能大有益处。可利用系列梯度稀释的化学诱导物来选择最佳浓度。此外,如果条件允许,可选择多个浓度进行趋化实验,以确保最终选择最佳实验体系(图 4)。
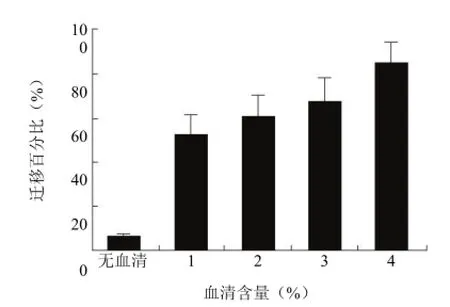
图4 化学诱导物浓度的重要性(优化血清密度,用于HT1080 24 h 内迁移穿过 8.0 μm 聚碳酸酯膜)
迁移(侵袭)时间
如果使用一个研究成熟的模型,迁移时间可能已有记录,否则,需要首先进行优化。有多个因素决定细胞穿过通透性支持物孔所需的时间。包括化学诱导物类型(浓度)、细胞的生物学性质和屏障厚度(浓度)。因而,优化用于特定条件的迁移时间很重要。对于某些应用,2 h 的迁移时间足够用来获得满意的结果,而其他应用可能需要 24 h 或者48 h。更长的孵育时间通常会导致更高的自发迁移,从而有可能会影响实验结果,这也很重要(图 5)。

图5 迁移(侵袭)时间对迁移的影响(优化 HT1080 24 h迁移穿过 8.0 μm 聚碳酸酯膜的迁移时间)
屏障类型和浓度
侵袭试验要求迁移通过某种生物学屏障。通常用于侵袭试验的屏障包括细胞外基质(如 BME 和 Matrigel™)、胶原蛋白、纤粘连蛋白和层粘连蛋白,以及其他成分明确复杂的细胞外基质或基底膜提取物。屏障选择取决于检测的模型和想要包被的浓度。为了测定正确的包被浓度,除了测试作为对照的无包被的孔,也测试不同的包被浓度。如果屏障起作用,未经包被孔的迁移细胞数与包被屏障孔的迁移细胞数将有统计学差异(图 6)。

图6 包被浓度的重要性(在 4 h 或者 24 h,HT1080 侵袭通过 8.0 μm 聚碳酸酯膜上不同胶原浓度)
制备用于趋化性试验的细胞
某些应用中,操作迁移试验前必须用血清饥饿细胞24 ~ 48 h。血清饥饿能够增加细胞对于化学诱导物的敏感性,因而增加迁移应答也能够减少潜在的差异。从培养瓶中移去培养基,用 PBS 或 HBSS 淋洗,然后用相同体积的无血清或者血清减少的培养基来代替使用。除了饥饿细胞,可能优化收获细胞的方法也是必需的。取决于使用的细胞类型和化学诱导物,某些蛋白酶(如胰蛋白酶)可能会因为损伤细胞或者细胞表面受体减少而抑制细胞迁移(图 7)。

图7 细胞收获溶液的重要性(用 Accutase® 和胰蛋白酶收获 HT1080 细胞的 24 h 迁移结果)
讨论
实验优化对于以细胞为基础的试验获得稳定的可重现结果至关重要。由于迁移和侵袭试验的复杂性,使得优化更为重要。细胞的总体健康状况、接种条件、化学诱导物浓度、膜孔径和迁移(侵袭)孵育时间,是迁移(侵袭)试验中需要考虑的几个至关重要的因素。这些至关重要的因素的优化不但会获得更精确的结果,而且能够节省时间和成本。
10.3969/cmba.j.issn.1673-713X.2015.03.016
200040 上海,康宁生命科学亚洲技术中心
2015-05-12

