抗丙型肝炎药物研究进展
——药物、靶点和耐药性
石星,葛庆华,岑山
综述
抗丙型肝炎药物研究进展
——药物、靶点和耐药性
石星,葛庆华,岑山
丙型肝炎为丙型肝炎病毒(hepatitis C virus,HCV)引起的全球性传染病。目前全球感染率约为 3%,感染者约2 亿人[1]。我国在 2010 年公布了一般人群的血清抗 HCV阳性率为 0.43%。丙型肝炎以输血为主要传播途径。15% ~40% 的感染者 6 个月内感染症状可自行消失[2-3],剩余60% ~ 85% 发展为慢性丙型肝炎[4],其中约 20% 的慢性丙型肝炎患者在慢性感染 HCV 后 20 年左右的时间内发展为肝硬化甚至肝脏衰竭或 HCV 相关的肝细胞癌(hepatocellular carcinoma,HCC)[5]。目前丙型肝炎的预防尚无疫苗可用。早期最有效的丙型肝炎标准治疗方案是聚乙二醇(PEG)化干扰素 α(PEG-IFN-α)与利巴韦林(ribavirin,RBV)联合应用 24 ~ 48 周,但只有 40% ~ 50% 的基因型为 1 型患者和约 80% 的基因型为 2 或 3 型患者得到有效治愈[6-8]。2011 年,新的标准三联疗法获美国 FDA 认证,该疗法在传统抗丙型肝炎标准方案(PEG-IFN-α 和利巴韦林联合用药)基础上加入了两种新批准的蛋白酶抑制剂中的一种,使得对 HCV 基因 1 型感染治愈率提高到约70%[9-10],但是其副反应、抗药性以及药物间相互作用等问题依然严重[11]。
1 抗丙型肝炎病毒药物和靶点
丙型肝炎病毒为有包膜单股正链 RNA 病毒,属黄病毒科丙型肝炎病毒属(Flaviviridae hepacivirus)。根据其基因序列的差异程度分为 7 个基因型以及多个亚型。HCV 基因组全长约为 9.6 kb,仅含有一个大的开放读码框,编码大约 3000 个氨基酸残基的多蛋白前体。该蛋白前体由宿主或病毒的水解酶加工成 10 个成熟的结构和非结构蛋白,从N 端到 C 端依次为 Core、E1、E2、P7、NS2、NS3、NS4A、NS4B、NS5A 和 NS5B。HCV 生活周期大致包括病毒吸附、进入细胞、脱衣壳、病毒多蛋白翻译、剪切、复制复合物组装、病毒基因组复制、病毒颗粒组装、成熟和释放等几个环节。理论上,HCV 生活周期的每一步都可以成为药物靶点[12]。目前,抗 HCV 药物的靶点多选择病毒的非结构蛋白,如 NS2、NS3、NS4A、NS5A 和 NS5B。NS2/3 蛋白水解酶负责 NS2 和 NS3 的分子内切割。切割释放后的NS2 以反式作用的方式与 NS5A 系统作用参与感染性病毒颗粒的形成。NS3 则在切割后其 N-端具有丝氨酸蛋白酶活性得以释放,可切开 NS3/4A、NS4A/4B、NS4B/5A、NS5A/5B 的连接部位,使得非结构蛋白成熟。NS3 C 端结构域具有的 NTP 酶(NTPase)和 RNA 解旋酶活性为HCV 复制所必需。NS4A 为疏水性蛋白,由 54 个氨基酸组成,可与 NS3 的 N 端丝氨酸蛋白酶结构域结合,稳定NS3 的蛋白酶构型,NS3/4A 可切割宿主抗病毒天然免疫中关键蛋白。NS5A 为多功能高度磷酸化蛋白,其参与了病毒复制复合物的形成、病毒的产生及释放和干扰细胞内重要信号通路等。NS5B 分子量为 68 kD,为 RNA 依赖的 RNA聚合酶(RdRp),主要生物学功能为合成 HCV 基因组或与之互补的负链 RNA。
目前已有多种直接作用病毒和以宿主为靶点的药物进入临床前阶段或正在进行临床试验。直接作用抗病毒药物(direct-acting agent,DAA)主要通过抑制 HCV 编码的酶或蛋白的功能来发挥抗病毒作用。宿主靶向药物(host-targeting agents,HTAs)是通过增强宿主天然免疫或干预发病机制所需的宿主因素,间接影响 HCV 复制的一类药物。
抗丙肝病毒药物疗效的评价指标主要包括快速病毒学应答(rapid virological response,RVR)、早期病毒学应答(early virological response,EVR)和持续病毒应答(sustained virological response,SVR)[13-14]。RVR、EVR 和 SVR 一般分别代表抗病毒治疗第 4 周、12 周、治疗结束及随访期间的病毒学应答。RVR 指治疗 4 周时血清 HCV RNA 的PCR 结果阴性,SVR 指血清 HCV RNA 在治疗结束及随访期间 PCR 检查均阴性。SVR12 指治疗终点后 12 周随访时 HCV RNA 阴性(一般应用于 FDA 接受的临床试验终点)。本文主要对已经进入临床阶段的药物进行总结。
2 直接作用抗病毒药物
2.1 NS3/4A 蛋白酶抑制剂
此类药物主要为多肽模拟物,作用靶点为 HCV NS3/4A蛋白酶活性位点,目前已研发到第二代。药物通过与NS3/4A 的结合阻断其剪切病毒多蛋白,影响病毒非结构蛋白的成熟。该类抑制剂在服用数天后可使 HCV RNA 下降3.5 ~ 4.5 log10IU/ml。特拉瑞韦(telaprevir)、波普瑞韦(boceprevir)、司美匹韦(simeprevir,TMC435)和 faldaprevir(图 1)为第一代 NS3/4A 蛋白酶抑制剂,前三种药物已经获得美国 FDA 认证,faldaprevir 的研究也已进入临床III 期阶段。
特拉瑞韦和波普瑞韦对基因 1 型 HCV 产生 SVR 比率分别提高到 75% 和 67%。司美匹韦单独给药 150 mg/d或与 IFN/RBV 联合应用,SVR24(治疗后 24 周持续病毒应答)分别为 67% ~ 80% 和 81% ~ 86%,而 IFN/RBV 组只有 23%[15]。虽然 NS3/4A 蛋白酶抑制剂的加入大幅度提高了 IFN/RBV 的 SVR 比率,但由于 HCV 复制过程中可产生大量突变,第一代药物在服用后极短时间(几天到数周)内,单一药物治疗便会产生抗药性[16-17],常见的 NS3 突变位点有 Q80K、R155K、V36M/R155K、A156T 和 D168A。目前第二代药物的研发正朝着减少药物间相互作用、剂量减少、疗程缩短和减弱副作用的方向进行。MK-5172 是其中比较有潜力的药物,该药物已进入临床 II 期试验阶段。相较于第一代蛋白酶抑制剂,MK-5172 副反应相对较弱,对于 HCV 基因 1 型和 3 型有效,400 mg/d 连续服用 7 d,HCV RNA 分别下降了 5.4 和 3.98 log10IU/ml,患者的IL28B 基因型对其 SVR24 无影响,且对于临床常见 NS3 R155 突变有较强抗性[18]。
2.2 NS5A 抑制剂
鉴于 HCV NS5A 在病毒复制和组装过程中有重要作用[19-20],该类抑制剂在与 IFN/RBV 联合用药时可以显著减少 HCV RNA 并增强 SVR[21]。目前该类药物极有潜力成为对 HCV 所有基因型有效的药物。本文以达卡他韦(daclatasvir,BMS-790052)和雷迪帕韦(ledipasvir,GS-5885)为例介绍该类化合物(图 2)。
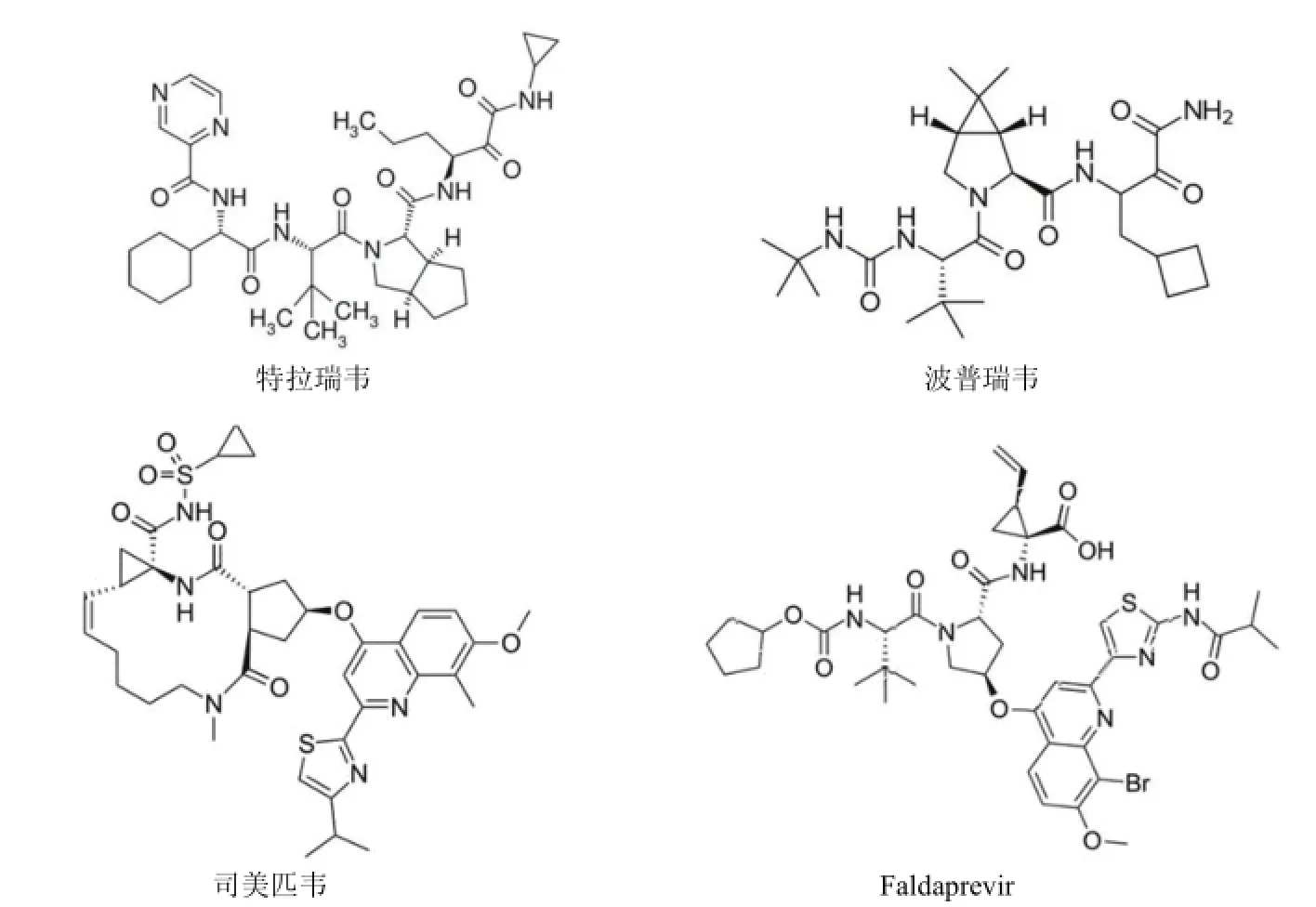
图1 第一代 NS3/4A 蛋白酶抑制剂
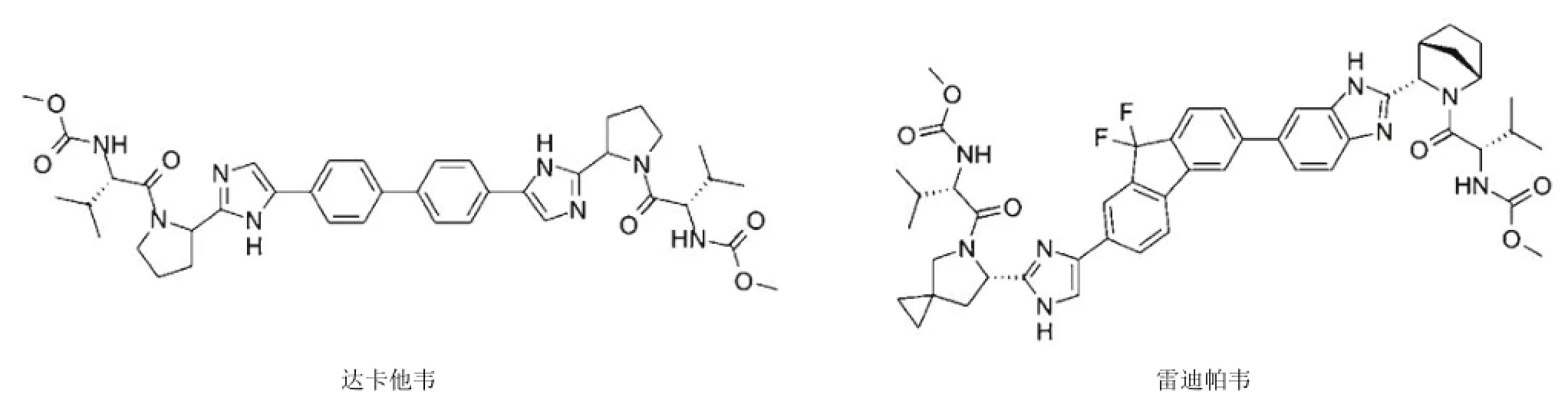
图2 NS5A 抑制剂
达卡他韦是第一个进入临床试验阶段的 NS5A 抑制剂。体外试验表明,该药物对 HCV 所有基因型均表现出较高抗病毒活性。达卡他韦作用于 NS5A 蛋白 N 端结构域 I,该结构域对 NS5A 寡聚化至关重要。达卡他韦独特的回文结构正好与 NS5A 二聚体互补,其结合于两个NS5A 分子 N 端结构域 I 固相片段(36-198 和 33-191氨基酸残基)形成二聚体的界面,处于推定的 RNA 结合结构域反向[22-24]。达卡他韦有可能通过干扰 NS5A 二聚体的精确结合,使得空间结构发生轻微扭曲,从而影响 NS5A 功能[21]。目前认为,达卡他韦影响了 HCV 生活周期的两个阶段——病毒 RNA 合成和病毒颗粒组装/分泌过程[25]。I 期临床试验表明,服用达卡他韦 100 mg 6 h 后病毒载量就有平均 1.95 log10IU/ml 的下降,这比目前任何抗病毒药物都要快。临床 II 期试验结果显示,HCV 基因 1 型患者在接受达卡他韦 3、10 和 60 mg 与 IFN/RBV 连用治疗后,RVR 分别为 42%、83% 和 75%[26]。虽然达卡他韦对所有 HCV 基因型有效,但耐药性依然存在,早期实验中已发现达卡他韦单一疗法很快会有抗药病毒株出现,常见突变位点为 M28T、Q30H/R、L31M/V、Y93H/C 等[21]。由于目前尚未发现抗达卡他韦和其他 DAA 的交叉耐药株,因此达卡他韦在无 IFN 的治疗方案中有较好前景[27]。
雷迪帕韦目前处于 III 期临床试验阶段,是泛基因型抗HCV 药物。体外试验表明,雷迪帕韦可有效抑制 HCV 基因型 1a、1b、2、3、4a 和 6a,细胞毒性低且其抗 HCV 有特异性[28]。I 期临床试验表明,HCV 基因 1 型患者日服30 mg,共服用 3 d,HCV RNA 下降 3.3 log10IU/ml。未见有严重不良反应报道[29]。但体外复制子实验发现雷迪帕韦的抗药株,例如基因 1a 型的 NS5A Q30H 和 Y93H 突变株[28]。
除了上述两个药物,ACH-3102 是另外一个极有潜力的第二代泛基因型 HCV NS5A 抑制剂,已进入 II 期临床试验。临床前和 I 期临床试验表明,ACH-3102 对 HCV 基因 1 型的主要耐药株及 HCV 基因 2 ~ 6 型,以及携有L31M 突变的基因 2 型抗性株均有显著疗效。同时,ACH-3102 半衰期长达 250 h,远优于达卡他韦(13 ~ 15 h)、雷迪帕韦(22 ~ 50 h)和 ABT-267(25 ~ 32 h)[30]。
2.3 RNA 依赖的 RNA 聚合酶抑制剂(NS5B 抑制剂)
NS5B 是 RNA 依赖的 RNA 聚合酶(RdRp),是 HCV复制的关键酶。NS5B 抑制剂分为两类:一类为核苷/核苷酸类抑制剂(NPIs),另一类为非核苷类抑制剂(NNPIs)。
2.3.1 核苷/核苷酸类 NS5B 抑制剂 该类抑制剂竞争性结合到 NS5B 聚合酶活性位点,导致新生病毒基因组合成的终止,从而抑制 HCV 的复制[31]。NS5B 活性位点在所有 HCV 基因型高度保守,因此 NPIs 具有泛基因型的特点,且不易产生耐药性,但是该类药物往往有较大毒性(图 3)。
索非布韦(sofosbuvir,GS-7977)于 2013 年获美国FDA 批准[32]。索非布韦是一种药物前体,在肝内代谢转化为活性抗病毒剂 2'-脱氧-2'-α-氟-β-C-甲基尿苷-5'-三磷酸酯,然后与核苷酸竞争 HCV NS5B 活性位点,最终导致HCV 早期 RNA 链合成的终止[33-34]。I 期临床试验结果表明,单独服用索非布韦 400 mg/d 连续 3 d可使 HCV RNA下降 3.9 log10IU/ml,且对 HCV 所有基因型有效。II 期临床试验也表明,索非布韦(400 mg/d)与 IFN/RBV 联合用药治疗 12 周对 HCV 基因 1、2、3、4 和 6 型 SVR 比率大于 87%。对于初治无肝硬化的基因 1 型患者,索非布韦(400 mg/d)与 IFN/RBV 联合用药治疗 12 周,SVR 比率为 91%,此外 IL28B 基因多态性对治疗效果无影响[35-36]。索非布韦的抗病毒作用不受患者感染 HCV 基因型、种族、IL28B 基因型及有无肝硬化等因素的影响。患者对索非布韦副反应有较好耐受性。
Mericitabine(RG7128)为一胞嘧啶核苷酸类似物的前药,因其耐受性和安全性好,是极具潜力的抗丙型肝炎药物。临床试验表明,mericitabine 对基因 1、2、3 和 4 型有效且不易产生耐药性[18]。当治疗周期延长至 24 周时,SVR 率上升到 56.8%,且患者有较好耐受性[37]。
2.3.2 非核苷类 NS5B 抑制剂 NNPIs 作为单一疗法的抑制剂抗病毒能力低于 NS3 蛋白酶抑制剂。NS5B 上有4 个该类化合物的结合结构域——拇指结构域 1 和 2 以及手掌结构域 1 和 2。该类化合物只对 HCV 基因 1 型有效,病毒较易对此类药物产生抗性(图 4)。
Deleobuvir(BI-207127)是口服类 NNPI,靶点为 NS5B拇指结构域 1,目前已进入临床 III 期试验。在基因型 1b HCV 感染者中,应用 deleobuvir 的 SVR12 达到了 56% ~85%,比 1a 基因型要高,后者为 11% ~ 47%[38]。该药物与IFN/RBV 联合治疗耐受性较好,不良反应多为轻度皮疹、恶心和腹泻等[39-40]。
VX-222 也是口服类 NNPI,靶点为 NS5B 拇指结构域 2。I 期临床表明,HCV 基因 1 型患者接受每天 2 次,750 mg/次给药,治疗 3 d后,HCV RNA 水平平均下降3.7 log10IU/ml,且药物耐受性好,无严重不良反应,一般为疲劳和肠胃不适。当 VX-222 以高剂量与 RBV 和特拉瑞韦三联治疗或加入 PEG-IFN 四联治疗 HCV 基因 1 型患者时,三联疗法在治疗第二周 HCV 检测即为阴性,四联疗法 SVR12 率达到 90%[41]。
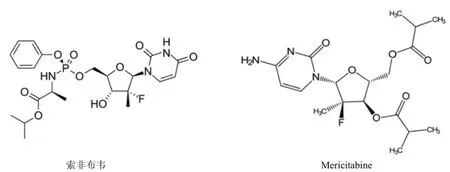
图3 核苷/核苷酸类 NS5B 抑制剂
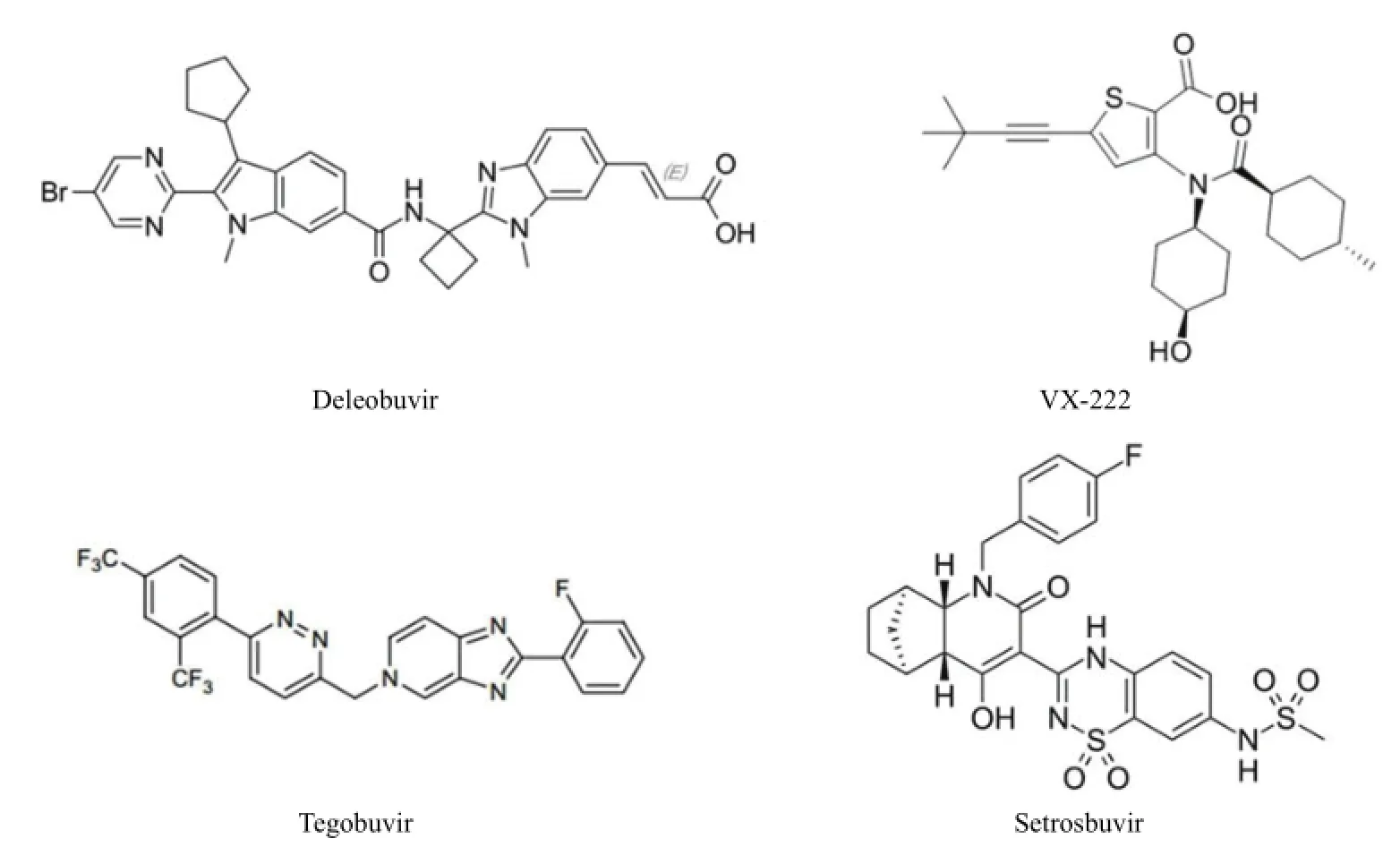
图4 非核苷类 NS5B 抑制剂
Tegobuvir(GS-9190)靶点为 NS5B 手掌结构域 2,可使 HCV RNA 下降 1.7 log10IU/ml。临床 II 期试验将tegobuvir 与 IFN/RBV 联合用于基因型 1 患者治疗,SVR率可达 100%[42]。
Setrosbuvir 的靶点为 NS5B 的手掌结构 1,HCV 基因 1 型患者接受每天 2 次,800 mg/次给药,治疗 3 d 后,HCV RNA 水平平均下降 2.9 log10IU/ml,但体外研究显示,HCV 基因 2 型和 3 型对其具有一定抗性。
3 以宿主为靶点的药物
研发增强宿主天然免疫或干预发病机制所需的宿主因素的药物(host-targeting agents,HTAs)是 HCV 感染防治的重要手段之一。该类药物大致分为两类:一类为多靶点HTAs,通过触发固有免疫反应促使宿主处于抗病毒状态,包括 IFNα、IFNλ 以及 Toll 样受体(toll like receptor,TLR)抑制剂等;另一类为单靶点 HTAs,主要针对 HCV 生活周期中必需的关键宿主酶和因子,例如亲环素A(CypA)、脂肪酸合酶(FASN)、HMGCoA 脱氢酶和 miRNA-122 等[43]。
ITX-5061 在体外抑制 HCV 侵入细胞过程的关键受体SR-B1,从而阻止 HCV 的复制。该药早先作为治疗炎症疾病药物—— p38 MAPK 抑制剂研发的,但是其抗病毒作用并不依赖于其 p38 MAPK 抑制活性,目前已进入 II 期临床试验。HCV E2 蛋白 N415D 和 G451R 突变株对ITX-5061 产生显著耐药性,但是却对于中和抗体更为敏感[44]。
Alisporivir(DEBIO-025)和 SCY-635 靶点为 HCV 复制过程中必需的肽酰脯氨酰顺反异构酶——亲环素A,阻止亲环素 A 与 NS5A 结构域 II 上的脯氨酸结合,影响CypA 与 NS5A 之间相互作用,从而抑制 HCV 在宿主细胞内的复制。Alisporivir 还可以通过与亲环素 D 结合,抑制线粒体通透性变换,从而拯救由 HCV 引起的线粒体功能紊乱[45]。此外,SCY-635 还可以通过诱导 I 型和 III 型干扰素及 ISGs 增强天然抗病毒免疫[46]。临床试验中,由于受试者有几例急性胰腺炎患者出现,因此 alisporivir 的临床试验目前已经暂停。
Miravirsen 是锁核酸修饰的硫代反义寡核苷酸,靶标是肝脏内特异表达并对 HCV 基因组的稳定性和复制所必需的 miR-122[47-49]。它可与 miR-122 形成高度稳定的杂交双链,从而抑制其功能[50-51]。临床 II 期研究表明,miravirsen用于慢性 HCV 1 型感染患者表现出长期剂量依赖性地减少 HCV-RNA 水平的效应。皮下注射剂量为 3、5 或7 mg/kg的 miravirsen 治疗组患者的平均 HCV-RNA 最大值(log10IU/ml)自基线水平的减少量分别为 1.2、2.9 和 3.0。同时未观察到剂量限制性的不良反应事件及病毒抵抗性。
4 结语
二十多年来,随着对丙型肝炎病毒研究的日益深入,新药物新疗法不断出现。特别是近几年,抗 HCV 药物和新策略发展十分迅速[52-55]。尽管新的 DAA 药物已成为临床治疗的一线药物,慢性丙型肝炎的治疗依然面临诸多挑战,例如疾病预防、病毒耐药性、药物交叉反应、新药安全性和有效性等。新的抗 HCV 药物、多个靶点药物混合制剂以及泛基因型抗病毒药物将会是未来治疗慢性丙型肝炎及药物研发的趋势。
[1]Suriawinata A, Xu R. An update on the molecular genetics of hepatocellular carcinoma. Semin Liver Dis, 2004, 24(1):77-88.
[2]Alter MJ, Margolis HS, Krawczynski K, et al. The natural history of community-acquired hepatitis C in the United States. The Sentinel Counties Chronic non-A, non-B Hepatitis Study Team. N Engl J Med,1992, 327(27):1899-1905.
[3]Jauncey M, Micallef JM, Gilmour S, et al. Clearance of hepatitis C virus after newly acquired infection in injection drug users. J Infect Dis, 2004, 190(7):1270-1274.
[4]National Institutes of Health. National Institutes of Health Consensus Development Conference Statement: Management of hepatitis C:2002--June 10-12, 2002. Hepatology, 2002, 36(5 Suppl 1):S3-S20.
[5]Lauer GM, Walker BD. Hepatitis C virus infection. N Engl J Med,2001, 345(1):41-52.
[6]European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol, 2011, 55(2):245-264.
[7]Ghany MG, Strader DB, Thomas DL, et al. Diagnosis, management,and treatment of hepatitis C: an update. Hepatology, 2009,49(4):1335-1374.
[8]Ghany MG, Nelson DR, Strader DB, et al. An update on treatment of genotype 1 chronic hepatitis C virus infection: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology, 2011, 54(4):1433-1444.
[9]Jacobson IM, McHutchison JG, Dusheiko G, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med,2011, 364(25):2405-2416.
[10]Poordad F, McCone J Jr, Bacon BR, et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med, 2011, 364(13):1195-1206.
[11]Sarrazin C, Hézode C, Zeuzem S, et al. Antiviral strategies in hepatitis C virus infection. J Hepatol, 2012, 56 Suppl 1:S88-S100.
[12]Scheel TK, Rice CM. Understanding the hepatitis C virus life cycle paves the way for highly effective therapies. Nat Med, 2013, 19(7):837-849.
[13]Jensen DM, Morgan TR, Marcellin P, et al. Early identification of HCV genotype 1 patients responding to 24 weeks peginterferon alpha-2a (40 kd)/ribavirin therapy. Hepatology, 2006, 43(5):954-960.
[14]Berg T, Sarrazin C, Herrmann E, et al. Prediction of treatment outcome in patients with chronic hepatitis C: significance of baseline parameters and viral dynamics during therapy. Hepatology, 2003,37(3):600-609.
[15]Fried MW, Buti M, Dore GJ, et al. Once-daily simeprevir (TMC435)with pegylated interferon and ribavirin in treatment-naïve genotype 1 hepatitis C: the randomized PILLAR study. Hepatology, 2013,58(6):1918-1929.
[16]Kieffer TL, Sarrazin C, Miller JS, et al. Telaprevir and pegylated interferon-alpha-2a inhibit wild-type and resistant genotype 1 hepatitis C virus replication in patients. Hepatology, 2007, 46(3):631-639.
[17]Sarrazin C, Kieffer TL, Bartels D, et al. Dynamic hepatitis C virus genotypic and phenotypic changes in patients treated with the protease inhibitor telaprevir. Gastroenterology, 2007, 132(5):1767-1777.
[18]Pockros PJ, Jensen D, Tsai N, et al. JUMP-C: a randomized trial of mericitabine plus pegylated interferon alpha-2a/ribavirin for 24 weeks in treatment-naïve HCV genotype 1/4 patients. Hepatology, 2013,58(2):514-523.
[19]Evans MJ, Rice CM, Goff SP. Phosphorylation of hepatitis C virus nonstructural protein 5A modulates its protein interactions and viral RNA replication. Proc Natl Acad Sci U S A, 2004, 101(35):13038-13043.
[20]Tellinghuisen TL, Foss KL, Treadaway J. Regulation of hepatitis C virion production via phosphorylation of the NS5A protein. PLoS Patho, 2008, 4(3):e1000032.
[21]Gao M, Nettles RE, Belema M, et al. Chemical genetics strategy identifies an HCV NS5A inhibitor with a potent clinical effect. Nature,2010, 465(7294):96-100.
[22]Tellinghuisen TL, Marcotrigiano J, Rice CM. Structure of the zinc-binding domain of an essential component of the hepatitis C virus replicase. Nature, 2005, 435(7040):374-379.
[23]Love RA, Brodsky O, Hickey MJ, et al. Crystal structure of a novel dimeric form of NS5A domain I protein from hepatitis C virus. J Virol,2009, 83(9):4395-4403.
[24]Appel N, Schaller T, Penin F, et al. From structure to function: new insights into hepatitis C virus RNA replication. J Biol Chem, 2006,281(15):9833-9836.
[25]Guedj J, Dahari H, Rong L, et al. Modeling shows that the NS5A inhibitor daclatasvir has two modes of action and yields a shorter estimate of the hepatitis C virus half-life. Proc Natl Acad Sci U S A,2013, 110(10):3991-3996.
[26]Pol S, Ghalib RH, Rustgi VK, et al. Daclatasvir for previously untreated chronic hepatitis C genotype-1 infection: a randomised,parallel-group, double-blind, placebo-controlled, dose-finding, phase 2a trial. Lancet Infect Dis, 2012, 12(9):671-677.
[27]Bronowicki JP, Pol S, Thuluvath PJ, et al. Randomized study of asunaprevir plus pegylated interferon-α and ribavirin for previously untreated genotype 1 chronic hepatitis C. Antivir Ther, 2013, 18(7):885-893.
[28]Link JO, Taylor JG, Xu L, et al. Discovery of ledipasvir (GS-5885): a potent, once-daily oral NS5A inhibitor for the treatment of hepatitis C virus infection. J Med Chem, 2014, 7(5):2033-2046.
[29]Lawitz EJ, Gruener D, Hill JM, et al. A phase 1, randomized,placebo-controlled, 3-day, dose-ranging study of GS-5885, an NS5A inhibitor, in patients with genotype 1 hepatitis C. J Hepatol, 2012,57(1):24-31.
[30]Nettles RE, Gao M, Bifano M, et al. Multiple ascending dose study of BMS-790052, a nonstructural protein 5A replication complex inhibitor, in patients infected with hepatitis C virus genotype 1. Hepatology, 2011, 54(6):1956-1965.
[31]Pawlotsky JM, Najera I, Jacobson I. Resistance to mericitabine, a nucleoside analogue inhibitor of HCV RNA-dependent RNA polymerase. Antivir Ther, 2012, 17(3):411-423.
[32]Albert ML, Casrouge A, Chevaliez S, et al. Interferon induced protein 10 remains a useful biomarker of treatment failure in patients stratified for the interleukin-28B rs12979860 haplotype. Hepatology, 2011,53(4):1410-1411.
[33]Lam AM, Murakami E, Espiritu C, et al. PSI-7851, a pronucleotide of beta-D-2'-deoxy-2'-fluoro-2'-C-methyluridine monophosphate, is a potent and pan-genotype inhibitor of hepatitis C virus replication. Antimicrob Agents Chemother, 2010, 54(8):3187-3196.
[34]Sofia MJ, Bao D, Chang W, et al. Discovery of a β-d-2'-deoxy-2'-α-fluoro-2'-β-C-methyluridine nucleotide prodrug (PSI-7977) for the treatment of hepatitis C virus. J Med Chem, 2010,53(19):7202-7218.
[35]Kowdley KV, Lawitz E, Crespo I, et al. Sofosbuvir with pegylated interferon alfa-2a and ribavirin for treatment-naive patients with hepatitis C genotype-1 infection (ATOMIC): an open-label,randomised, multicentre phase 2 trial. Lancet, 2013, 381(9883):2100-2107.
[36]Lawitz E, Lalezari JP, Hassanein T, et al. Sofosbuvir in combinationwith peginterferon alfa-2a and ribavirin for non-cirrhotic,treatment-naive patients with genotypes 1, 2, and 3 hepatitis C infection: a randomised, double-blind, phase 2 trial. Lancet Infect Dis,2013, 13(5):401-408.
[37]Larrey D, Lohse AW, Trepo C, et al. Antiviral effect, safety, and pharmacokinetics of five-day oral administration of Deleobuvir (BI 207127), an investigational hepatitis C virus RNA polymerase inhibitor, in patients with chronic hepatitis C. Antimicrob Agents Chemother, 2013, 57(10):4727-4735.
[38]Zeuzem S, Soriano V, Asselah T, et al. Faldaprevir and deleobuvir for HCV genotype 1 infection. N Engl J Med, 2013, 369(7):630-639.
[39]Larrey D, Lohse AW, de Ledinghen V, et al. Rapid and strong antiviral activity of the non-nucleosidic NS5B polymerase inhibitor BI 207127 in combination with peginterferon alfa 2a and ribavirin. J Hepatol,2012, 57(1):39-46.
[40]Zeuzem S, Asselah T, Angus P, et al. Efficacy of the protease inhibitor BI 201335, polymerase inhibitor BI 207127, and ribavirin in patients with chronic HCV infection. Gastroenterology, 2011, 141(6):2047-2055, quiz e14.
[41]Di Bisceglie AM, Sulkowski M, Gane E, et al. VX-222, a non-nucleoside NS5B polymerase inhibitor, in telaprevir-based regimens for genotype 1 hepatitis C virus infection. Eur J Gastroenterol Hepatol, 2014, 26(7):761-773.
[42]Zeuzem S, Buggisch P, Agarwal K, et al. The protease inhibitor,GS-9256, and non-nucleoside polymerase inhibitor tegobuvir alone,with ribavirin, or pegylated interferon plus ribavirin in hepatitis C. Hepatology, 2012, 55(3):749-758.
[43]Zeisel MB, Lupberger J, Fofana I, et al. Host-targeting agents for prevention and treatment of chronic hepatitis C - perspectives and challenges. J Hepatol, 2013, 58(2):375-384.
[44]Zhu H, Wong-Staal F, Lee H, et al. Evaluation of ITX 5061, a scavenger receptor B1 antagonist: resistance selection and activity in combination with other hepatitis C virus antivirals. J Infect Dis, 2012,205(4):656-662.
[45]Quarato G, D'Aprile A, Gavillet B, et al. The cyclophilin inhibitor alisporivir prevents hepatitis C virus-mediated mitochondrial dysfunction. Hepatology, 2012, 55(5):1333-1343.
[46]Hopkins S, DiMassimo B, Rusnak P, et al. The cyclophilin inhibitor SCY-635 suppresses viral replication and induces endogenous interferons in patients with chronic HCV genotype 1 infection. J Hepato, 2012, 57(1):47-54.
[47]Jopling CL, Yi M, Lancaster AM, et al. Modulation of hepatitis C virus RNA abundance by a liver-specific MicroRNA. Science, 2005,309(5740):1577-1581.
[48]Jangra RK, Yi M, Lemon SM. Regulation of hepatitis C virus translation and infectious virus production by the microRNA miR-122. J Virol, 2010, 84(13):6615-6625.
[49]Machlin ES, Sarnow P, Sagan SM. Masking the 5' terminal nucleotides of the hepatitis C virus genome by an unconventional microRNA-target RNA complex. Proc Natl Acad Sci U S A, 2011,108(8):3193-3198.
[50]Shimakami T, Yamane D, Jangra RK, et al. Stabilization of hepatitis C virus RNA by an Ago2-miR-122 complex. Proc Natl Acad Sci U S A,2012, 109(3):941-946.
[51]Li Y, Masaki T, Yamane D, et al. Competing and noncompeting activities of miR-122 and the 5' exonuclease Xrn1 in regulation of hepatitis C virus replication. Proc Natl Acad Sci U S A, 2013,110(5):1881-1886.
[52]Kohli A, Shaffer A, Sherman A, et al. Treatment of hepatitis C: a systematic review. JAMA, 2014, 312(6):631-640.
[53]Macías J, Neukam K, Merchante N, et al. Latest pharmacotherapy options for treating hepatitis C in HIV-infected patients. Expert Opin Pharmacother, 2014, 15(13):1837-1848.
[54]Rehermann B, Bertoletti A. Immunological aspects of antiviral therapy of chronic hepatitis B virus and hepatitis C virus infections. Hepatology, 2015, 61(2):712-721.
[55]Feeney ER, Chung RT. Antiviral treatment of hepatitis C. BMJ, 2014,348:g3308.
10.3969/cmba.j.issn.1673-713X.2015.03.011
十二五“重大新药创制”国家科技重大专项(2012ZX09301002-001-015、2012ZX09301002-005-002)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所免疫生物学室
岑山,Email:shancen@imb.pumc.edu.cn
2015-03-05

