哺乳动物细胞灌流培养技术的开发与应用
李尤,周航,李锦才,张玉彬
哺乳动物细胞灌流培养技术的开发与应用
李尤,周航,李锦才,张玉彬
动物细胞培养始于 20世纪初,发展至今已成为生物、医学等领域广泛采用的技术方法。同微生物细胞相比,动物细胞表达蛋白质因具有蛋白空间折叠和糖基化修饰等功能而备受青睐[1-2]。近年来,蛋白药物的上市和带来的巨大经济效益,掀起了哺乳动物细胞培养的热潮。对于倍增时间长、对外界环境敏感、培养难度大的动物细胞,如何完善其培养工艺,提高细胞蛋白表达量,并有效投入大规模生产,成为国内外研究的热点。
1 灌流培养的特点与应用
常用的动物细胞培养方法有批次培养、补料批次培养、灌流培养等。其中,灌流培养能使体系中的培养基不断被更新,及时满足细胞对营养物质的需求,同时移除乳酸、铵等有害代谢产物,给与细胞较优良和稳定的生长环境。这种方法有效地提高了动物细胞密度和活率,延长了细胞的培养时间,并使得蛋白产量大幅上升。对该法的早期研究主要集中于贴壁细胞的床层培养,对于悬浮细胞,需要结合细胞截留设备完成灌流操作[3-5]。
相比于补料批次培养,灌流培养的高细胞密度、高细胞活率、高产量的特点使其能够凭借小型生物反应器规模达到补料批次培养大规模生产所得的蛋白量,实现了培养规模小型化,增加了操作的灵活度。但灌流操作培养基消耗量大,对设备要求高,长期培养染菌风险增大。
目前,对于动物细胞培养方法选取,主要决定于细胞生长的特性和目的蛋白的性质。灌流培养的显著优势在于蛋白可以随着培养基及时地被分离出,蛋白在反应器内停留时间短,较少受到培养体系内各种水解酶的降解作用,有利于蛋白质量的提高。这一特点,对于化学性质不稳定的蛋白,例如酶、凝血因子等生产极为有利。而当细胞生长和蛋白质量不受培养方式限制时,例如对于化学性质相对稳定的抗体等药物生产而言,是选择细胞灌流培养还是补料批次培养,需综合衡量成本、效益、规模、风险、操作灵活性等因素[6]。表 1 列举了运用灌流技术进行生产的部分生物药物。
2 细胞截留设备
随着悬浮细胞的大规模应用,悬浮细胞灌流培养技术也日益发展。细胞截留是悬浮细胞灌注培养的工艺要素之一,如何有效地截留细胞而不会对细胞造成损害成为工艺的重点和挑战。目前的细胞截留设备主要基于过滤、沉降、离心原理设计,包括旋转过滤器、涡流过滤器、倾斜沉降器、旋液分离器等。基于过滤原理设计的细胞截留设备,可以100% 分离细胞,但滤膜容易被细胞碎片、消泡剂等堵塞,最终导致灌流培养终止。对细胞进行离心分离,可能引起细胞损伤。沉降和离心均不能完全截留细胞,细胞分离效果还会受到灌流速率的影响。除此之外,能否简单而有效地进行放大也成为大部分细胞截留设备应用的限制条件[7]。
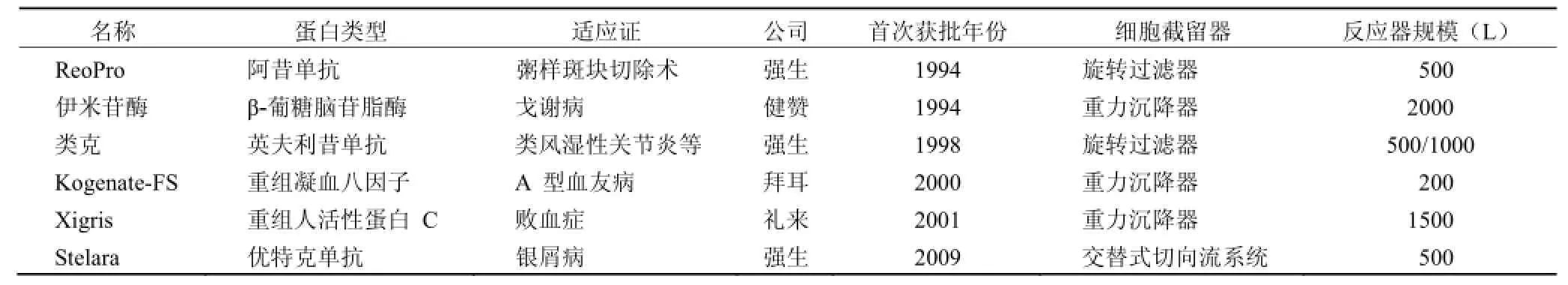
表1 利用灌流技术生产的生物药物[6]
基于中空纤维柱截留原理而设计的交替式切向流(alternating tangential flow,ATF)系统具有有效缓解滤膜堵塞,剪切力低等优点,是目前较优良的细胞截留设备[8-10]。如图 1 所示,中空纤维柱通过一根管道与反应器相连,另一侧由高压空气泵入与真空泵抽负压的反复交替切换带动硅胶隔膜泵运动,使得动物细胞培养液通过中空纤维柱进出反应器。这一过程同时实现了低剪切力情况下充分地冲洗中空纤维柱,有效地降低了中空纤维柱滤饼堆积效应产生的堵塞影响。利用 ATF 系统,可以在较高的灌流速率下达到较高的细胞密度和较高的蛋白产量,还可以通过培养体积与中空纤维柱膜面积比有效放大到大规模生产中。
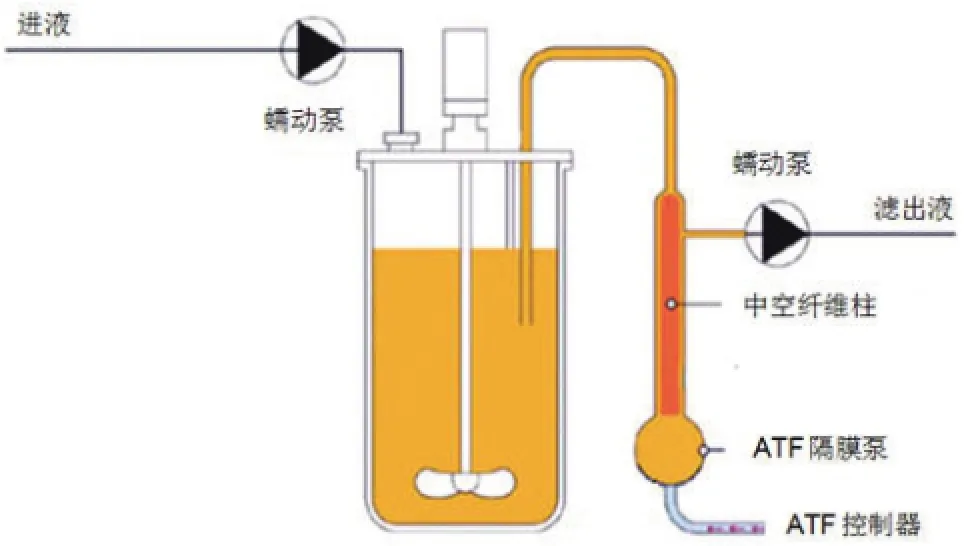
图1 ATF 运行示意图[10]
3 灌流工艺开发
哺乳动物细胞灌流培养工艺开发的要点在于以较低的灌流速率,实现细胞高密度、高活率、高产量,同时维持培养体系稳态,蛋白质量均一。其开发方法涉及培养基筛选、培养温度优化和灌流速率调节等。
3.1 培养基筛选
培养基筛选是细胞灌流培养工艺开发过程中的一个重要环节,培养基的成本和用量与灌流培养上游工艺开发费用密切相关。在灌流培养中,可以使用营养丰富或浓缩的培养基,提供细胞足够的营养物质,一方面可以获得更高的细胞密度,更多的蛋白产量;另一方面,可以降低灌流速率,减少培养基消耗[3, 11]。这种适用于灌流的培养基,旨在能够以1 ~ 2 vvd(容器体积/天)的灌流速率支持高于 50 × 106个/ml的细胞密度,此外还要求该培养基能维持细胞高活率,保证蛋白质量不受影响[12]。
灌流培养基的开发方法类似于补料批次培养培养基的开发,主要基于人们对细胞生长代谢以及营养需求的了解,在培养基中添加必要的营养成分。目前商业培养基主要针对补料批次培养,在实际应用时,也可用于细胞灌流培养。对于灌流培养基的优化与营养富集,也可通过在基础培养基中添加补料批次培养使用的补料。
3.2 培养温度优化
哺乳动物细胞适宜的生长温度一般为 37 ℃,大量研究表明,降低培养温度,细胞的生长代谢减慢,细胞活率能够得到更好的维持[13]。据文献报道,细胞在低温下(一般为30 ~ 35 ℃)表达量会提高,可能是由于 G0/G1 期的细胞比率增加[14];也有文献报道,降温后,mRNA 的稳定性增加[15]。
降温策略常见于细胞密度较低的补料批次培养,同样也可应用于细胞密度较高的灌流培养。常用的方法是在细胞生长的不同阶段采用不同的温度培养。前期在常规温度下培养,细胞能快速生长并达到较高的密度,对数生长中后期降低温度,可以减缓细胞代谢,维持细胞活率,提高细胞表达量。Ahn 等[16]灌流培养 CHO 细胞生产 EPO,当培养温度降至 32 ℃ 时,与 37 ℃ 相比,活率提高了 10% 以上,单细胞产量提高了 4 倍左右。Rodriguez 等[17]从 37 ℃ 降温至 32 ℃ 灌流培养 CHO-K1 细胞生产 β-IFN,单细胞产量提高了 3 ~ 5 倍,此外降温与灌流操作大大降低了 β-IFN的聚合度,提高了蛋白质量。
但降温对细胞活率和产量的影响因克隆而异,此外还与降温时间,降低的温度以及培养方式等有关[18]。Chen 等[19]在降温实验中发现,细胞培养降温至 31 ℃ 一段时间后,流式细胞仪下凋亡的细胞比例反而增加。在对细胞进行稳态灌流培养时还需注意,细胞维持以一定速率生长和蛋白生产速率,温度过低引起细胞生长减缓,容易导致生长速度低于凋亡速度,出现细胞活率下降的现象。
3.3 灌流速率的控制和优化
灌流速率是灌流工艺开发的又一要素。较高的灌流速率,培养基消耗量大,成本增加,细胞截留设备压力加大,产品大量稀释,纯化负担加重,不利于工业应用。一般在前期物料生产时,可以采用相对保守的灌流速率培养细胞,简单而快速地提供研究所需的材料,同时不用考虑蛋白降解的问题。在研发以及大生产过程中,应在不影响细胞生长和蛋白产量、质量的前提下,尽量降低灌流速率[3, 12, 20],实现低灌流速率下的稳态操作。
通常,在细胞对数生长期,应逐渐提高灌流速率,满足细胞的生长需要,尽快达到较高的细胞密度。进入平台期后,可结合调节温度、pH 等策略减缓细胞生长,降低灌流速率。灌流速率还可与在线糖耗、氧耗等参数偶联,进行动态控制,从而更加科学地进行细胞培养。但是这种做法需要严格控制细胞密度,防止细胞过度生长。
降低灌流速率后,收获液中的蛋白得以浓缩,但也容易出现单位体积的蛋白产量随着降低。这可能是由于提供细胞的营养物质不足或者细胞代谢副产物增加,对生长表达造成影响。此外,不同的灌流速率,还可能引起细胞截留设备的性能改变(如滤膜通透性改变等),而对产量造成影响。因此,在选取灌流速率时,还需考虑细胞截留设备的运行能力。Meuwly 等[20]以 2.6 vvd 速率灌流培养 CHO 细胞,当灌流速率下降 25% 后,单位体积蛋白产量并未下降,蛋白质量也未受影响。但当灌流速率下降 50% 后,蛋白产率下降了 30%。Kamthan 等[21]利用旋转过滤器灌流培养杂交瘤细胞生产抗体,当灌流速率为 1.125 ml/min 时,抗体产量达到 (793 ± 22.2)mg/L,而灌流速率分别为 0.625 和1.5 ml/min 时,抗体产量仅达到(454 ± 25.5)和(432 ± 22.2)mg/L。
4 反应器灌流培养与下游纯化结合
动物细胞灌流培养技术发展已有几十年,在实际应用过程中,通常将生物反应器与细胞截留设备连接,经细胞截留设备分离出的培养液经收集后,通过传统的批次培养采用的下游纯化工艺处理[12]。近年来,将下游纯化系统与反应器灌流培养相结合的连续操作逐渐兴起[12, 22-23]。这种做法的优势在于可以利用细胞截留设备的细胞分离作用,及时纯化灌流产生的大量细胞培养液,移除了中间装液容器和澄清装置,更重要的是能够减小层析柱的体积,减少缓冲液的用量。
现已存在将反应器灌流与初步蛋白吸附偶联的半连续操作[22]。另外在纯化方面,也存在对批次培养下游进行部分连续纯化的操作。但连续生产技术仍处于初级发展阶段,特别是完全的上下游一体化连续操作在生产中还未实现。由于各部分技术发展程度不同,尤其在纯化方面,人们对生产规模的蛋白纯化连续操作经验较少。虽然已经有一些厂商提供中小规模的连续层析系统,但这些设备还需要花费大量时间进行评估与验证[24]。除此之外,人们对这种细胞灌流培养与蛋白纯化一体化结合方式的放大也缺乏经验。
5 展望
近年来,动物细胞灌流培养的优势逐渐引起工业界和学术界的关注,与此同时,美国 FDA 也对其发展作出了鼓舞性的引导[12, 25]。虽然目前细胞补料批次培养仍是工业界的主流做法,在面对生物药物日益增加的市场需求量,各大生物制药公司依靠建立 1 ~ 2 万升规模的生物反应器予以应对,但大型生物反应器同样耗资巨大,且利用率较低。同时,随着生物药物的种类逐渐增多,生物制药公司需要同时对需求量大(如抗体)与需求量小(如孤儿药)的药物进行生产,这要求生物反应器在使用上更加灵活。相比之下,能够比拟大规模补料批次培养的中、小规模灌流培养,占地面积小,设备的利用率也较高,应用范围更广,还可实现高度自动化操作,节约人力。加之一次性反应器的投入使用,为灌流技术的发展开辟了更为广阔的天地。随着灌流培养工艺的平台化以及更加优良的灌流培养基问世,细胞灌流培养的投入资金将大大减少,必将赋予其更强的市场竞争力。
在细胞灌流培养技术极具发展潜力的同时,市场对于灌流操作、设备等诸多方面也提出了更高的要求。特别是一体化连续生产概念的提出,需要整合上下游细胞培养技术,对仪器设备等有效衔接,在此基础上建立适用于所有蛋白药物(包括稳定或不稳定的蛋白)的同一生产线。完全一体化连续生产已成为灌流技术发展的目标和方向。
[1]Butler M, Medneses-Acosta A. Recent advances in technology supporting biopharmaceutical production from mammalian cells. Appl Microbial Biotechnol, 2012, 96(4):885-894.
[2]Lim Y, Wong NS, Lee YY, et al. Engineering mammalian cells in bioprocessing - current achievements and future perspectives. Biotechnol Appl Biochem, 2010, 55(4):175-189.
[3]Ozturk S, Hu WS. Cell culture technology for pharmaceutical and cell-based therapies. New York: CRC Press, 2006:387-388.
[4]Kadouri A, Spiner RE. Some myths and messages concerning the batch and continuous culture of animal cells. Cytotechnology, 1997,24(2):89-98.
[5]Chu L, Robinson DK. Industial choices for protein production by large-scale cell culture. Curr Opin Biorechol, 2001, 12(2):180-187.
[6]Pollock J, Ho SV, Farid SS. Fed-batch and perfusion culture processes:economic, environmental, and operational feasibility under uncertainty. Biotechnol Bioeng, 2013, 110(1):206-219.
[7]Voisard D, Meuwly F, Ruffieux PA, et al. Potential of cell retention techniques for large-scale high-density perfusion culture of suspended mammalian cells. Biotechnol Bioeng, 2003, 83(7):751-765.
[8]Kelly W, Scully J, Zhang D, et al. Understanding and modeling alternating tangential flow filtration for perfusion cell culture. Biotechnol Prog, 2014, 30(6):1291-1300.
[9]Clincke MF, Mölleryd C, Zhang Y, et al. Very high density of CHO cells in perfusion by ATF or TFF in WAVE bioreactorTM. Part I. Effect of the cell density on the process. Biotechnol Prog, 2013,29(3):754-767.
[10]Bonham-Carter J, Shevitz J. A brief history of perfusion biomanufacturing: how high-concentrated cultures will characterize the factory of the future. Bioprocess Int, 2011, 9(9):24-30.
[11]Ozturk SS. Development of high effective cell culture perfusion bioreactors for commercial production of biologicals: past, present and future (invited lecture). In 3rd Recombinant Protein Production Meeting, Tavira, Algarve, Portugal, 2004.
[12]Konstantinov KB, Cooney CL. White paper on continuous bioprocessing. May 20-21, 2014 Continuous Manufacturing Symposium. J Pharm Sci, 2015, 104(3):813-820.
[13]Schatz SM, Kerschbaumer RJ, Gerstenbauer G, et al. Higher expression of Fab antibody fragments in a CHO cell line at reduced temperature. Biotechnol Bioeng, 2003, 84(4):433-438.
[14]Hendrick V, Winnepenninckx P, Abdelkafi C, et al. Increased productivity of recombinant tissular plasminogen activator (t-PA) by butyrate and shift of temperature: a cell cycle phases analysis. Cytotechnology, 2001, 36(1-3):71-83.
[15]Oguchi S, Saito H, Tsukahara M, et al. pH condition in temperature shift cultivation enhances cell longevity and specific hMab productivity in CHO culture. Cytotechnology, 2006, 52(3):199-207.
[16]Ahn WS, Jeon JJ, Jeong YR, et al. Effect of culture temperature on erythropoietin production and glycosylation in a perfusion culture of recombinant CHO cells. Biotechnol Bioeng, 2008, 101(6):1234-1244. [17]Rodriguez J, Spearman M, Tharmalingam T, et al. High productivity of human recombinant beta-interferon from a low-temperature perfusion culture. J Biotechnol, 2010, 150(4):509-518.
[18]Yoon SK, Hwang SO, Lee GM. Enhancing effect of low culture temperature on specific antibody productivity of recombinant Chinese hamster ovary cells: clonal variation. Biotechnol Prog, 2004, 20(6):1683-1688.
[19]Chen ZL, Wu BC, Liu H, et al. Temperature shift as a process optimization step for the production of Pro-urokinase by a recombinant Chinese hamster ovary cell line in high-density perfusion culture. J Biotechnol Bioeng, 2004, 97(4):239-243.
[20]Meuwly F, von Stockar U, Kadouri A. Optimization of the medium perfusion rate in a packed-bed bioreactor charged with CHO cells. Cytotechnology, 2004, 46(1):37-47.
[21]Kamthan S, Gomes J, Roychoudhury PK. Production of monoclonal antibodies for breast cancer by HB8696hybridoma cells using novelperfusion system. Enzyme Microb Technol, 2014, 64(65):44-51.
[22]Warikoo V, Godawat R, Brower K, et al. Integrated continuous production of recombinant therapeutic proteins. Biotechnol Bioeng,2012, 109(12):3018-3029.
[23]Vogel JH, Nguyen H, Giovannini R, et al. A new large-scale manufacturing platform for complex biopharmaceuticals. Biotechnol Bioeng, 2012, 109(12):3049-3058.
[24]Napadensky B, Shinkazh O, Teella A, et al. Continuous countercurrent tangential chromatography for monoclonal antibody purification. Separation Sci Technol, 2013, 48(9):1289-1297.
[25]Moore C. Continuous manufacturing - FDA perspective on submissions and implementation. 3rd Symposium on continuous flow reactor technology for industrial applications, Lake Como, Italy, 2011. [2015-2-12]. http://www.pqri.org/workshops/SampleSize/ Moore.pdf.
10.3969/cmba.j.issn.1673-713X.2015.03.014
210009 南京,中国药科大学生命科学与技术学院(李尤、张玉彬);200131 上海药明康德新药开发有限公司生物制药与生物工艺部(周航、李锦才)
张玉彬,Email:yubinzhang66@yahoo.com
2015-02-15

