甘草悬浮培养细胞对芦荟大黄素的选择性糖基化
张德武,陶小宇,余利岩,戴均贵
甘草悬浮培养细胞对芦荟大黄素的选择性糖基化
张德武,陶小宇,余利岩,戴均贵
目的 研究甘草悬浮培养细胞对芦荟大黄素的生物转化。
方法 将芦荟大黄素与甘草细胞悬浮培养细胞共孵育 7 d后,培养液经由大孔吸附树脂处理,细胞用甲醇提取,合并两部分浸膏后依次采用 Sephadex LH-20 凝胶柱色谱、正相硅胶柱色谱、反相半制备 HPLC 等技术进行分离纯化,利用质谱和核磁共振波谱技术进行结构鉴定。
结果 分离得到了一个芦荟大黄素的选择性糖基化产物——芦荟大黄素-(3-羟甲基)-O-β-D-葡萄糖苷。
结论 甘草悬浮培养细胞对芦荟大黄素具有位置选择性糖基化能力。
芦荟大黄素; 甘草; 糖基化; 悬浮培养细胞
芦荟大黄素(aloe-emodin)是蓼科植物掌叶大黄的根和块茎中的一种活性成分,属于蒽醌类化合物。作为来源于传统中药的一种重要的活性成分,该化合物具有抗炎、抗菌、抗氧化、抗肿瘤、清除自由基等多种药理活性,但水溶性不足使其应用受限[1-7]。通过生物转化往往能获得化学合成难以得到的新颖结构,并且在位置选择方面具有明显的优势,此技术在天然产物及化学合成药物的结构改造方面的研究越来越受到药物学家的重视[8-10]。植物生物转化是利用植物细胞中的酶体系使底物结构发生改变的过程。研究表明,离体植物细胞培养体系具有糖基化、去糖基化、酯化、氧化、甲基化、水解、异戊烯基化等多种生物转化能力[11-14]。目前,尚无利用植物细胞悬浮培养体系对芦荟大黄素进行生物转化方面的研究报道。本文首次采用甘草细胞悬浮培养体系对芦荟大黄素进行生物转化研究。
1 材料与方法
1.1 材料
1.1.1 植物细胞 甘草种子采自宁夏,由中央民族大学杨林副教授鉴定为乌拉尔甘草(Glycyrrhiza uralensis Fisch)。种子细胞由本实验室诱导,继代培养,并保藏于本实验室。
1.1.2 仪器 AutoSpec Ultima-TOF 质谱仪为美国应用生物系统公司产品;MP-400 及 ARX-500型核磁共振波谱仪为美国布鲁克公司产品;岛津LC-6AD 型半制备型高效液相色谱仪为日本岛津公司产品;Adsorbosphere XL C18(250 mm × 10 mm,5 μm)反相半制备色谱柱为美国 WR Grace 公司产品。
1.1.3 试剂 分析纯的乙醇、甲醇、氯仿、丙酮、石油醚为北京化工厂生产;色谱级甲醇和乙腈为美国 Burdick & Jackson 公司生产;柱色谱用硅胶和GF254硅胶板为烟台市化学工业研究所生产;Sephadex LH-20 由美国 GE 公司生产。
1.1.4 细胞培养基 MS 培养基:NH3NO31.65 g/L、KNO31.90 g/L、KH2PO40.17 g/L、MgSO4·7H2O 0.37 g/L、CaCl2·H2O 0.44 g/L、KI 0.83 mg/L、H3BO36.20 mg/L、CoCl2·6H2O 0.025 mg/L、Na2MoO4·2H2O 0.25 mg/L、MnSO4·4H2O 22.30 mg/L、CuSO4·5H2O 0.025 mg/L、ZnSO4·7H2O 8.60 mg/L、FeSO4·7H2O 27.80 mg/L、EDTA-Na237.30 mg/L、肌醇 100 mg/L、VB60.50 mg/L、VB10.10 mg/L、甘氨酸 2 mg/L、烟酸 0.50 mg/L、蔗糖 40 g/L、萘乙酸 0.2 mg/L、2,4-二氯苯氧乙酸 0.5 mg/L、6-苄氨基腺嘌呤0.5 mg/L。
1.2 方法
1.2.1 细胞培养 将甘草种子浸泡在盛满清水的培养皿中,置于 4 ℃ 冰箱里 1 ~ 2 d,挑选饱满、颜色偏绿、较为鲜亮的种子,用 70% 的乙醇表面灭菌 30 s 后,用 0.1% 氯化汞溶液表面灭菌10 min,然后用 5 倍量的蒸馏水漂洗 3 次,用无菌滤纸将水吸干。将灭菌后的种子接种在 MS 固体培养基上,在光照条件下培养。待无菌苗长高至约 5 cm 后,于超净台上进行愈伤组织的诱导,并进行甘草悬浮细胞培养体系的建立,具体方法参照文献[12]。
1.2.2 生物转化 将生长在 500 ml 三角瓶中、状态良好的甘草细胞转接至 1000 ml 三角瓶中,接种量 2 g/瓶(细胞干重),于(25 ± 1)℃,120 r/min条件下培养 10 d,投入底物 100 μl/瓶(300.0 mg 芦荟大黄素溶于 1200 μl 二甲基甲酰胺中)。之后将细胞继续于(25 ± 1)℃ 黑暗条件下摇床培养,转速 120 r/min,7 d 后收获。
1.2.3 提取分离 将细胞和培养液抽滤分离,通过 HPLC 分析,发现产物大部分存在于细胞中,少量出现在培养液部分。将培养液部分过大孔吸附树脂柱吸附 2 次,分别用 50%、75% 和 100% 乙醇洗脱,洗脱液减压回收后合并得浸膏 1.0 g。甘草细胞置于 56 ℃ 烘箱中烘干,而后用 400 ml 甲醇超声提取 3 次,每次 50 min,将甲醇部分减压蒸干得到 5.8 g 浸膏。将两部分浸膏合并后经过Sephadex LH-20 凝胶柱色谱分离得到 13 个流分(Fr.1 ~ Fr.13),TLC 检测发现产物存在于 Fr.3 ~Fr.8 中,合并后共 3.7 g。进一步通过硅胶柱色谱(200 ~ 300 目)梯度洗脱,得9个流分(Fr.3-1 ~Fr.3-9),经过 TLC检测合并含有目的化合物的流分,减压蒸馏后的浸膏通过反相半制备 HPLC(甲醇:水 = 53:47,v/v,2 ml/min)分离得到粗产物 4.5 mg,进一步通过反相半制备 HPLC(乙腈:水 = 18:82,v/v,4 ml/min)得到目的化合物。
2 结果
2.1 生物转化结果
300.0 mg 芦荟大黄素在 4.0 L 甘草悬浮细胞体系中经过 7 d 的转化,通过 TLC 和 HPLC-UV检测转化产物(图 1),运用多种色谱技术分离得到一个糖基化产物(图 2)。
2.2 结构鉴定
目的化合物为黄色粉末,其 ESI-MS 显示 m/z:433.3 [M+H]+,表明其分子量为 432,比芦荟大黄素的分子量增加了 162,推测该化合物可能是芦荟大黄素的糖基化产物。在13C-NMR 谱中多了一组明显的葡萄糖信号(δC102.5, 77.2, 76.7, 73.6, 70.1,61.2),以及1H-NMR 谱中的端基氢质子信号,δH4.29(1H, d, J = 7.6 Hz, H-1'),确定该糖为葡萄糖。以上光谱数据与文献[15]报道的芦荟大黄素-3-(羟甲基)-O-β-D-葡萄糖苷的数据一致。故鉴定该化合物为芦荟大黄素-3-(羟甲基)-O-β-D-葡萄糖苷。
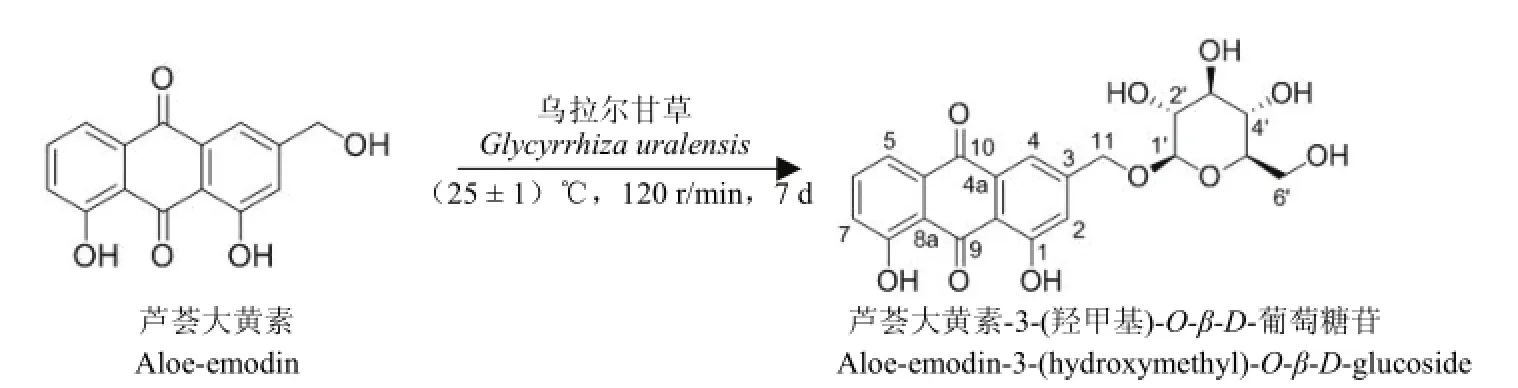
图2 甘草悬浮细胞系对芦荟大黄素的转化反应Figure 2 The biotranformation of aloe-emodin by G. uralensis cell suspension cultures
3 讨论
本研究首次利用甘草细胞悬浮培养体系对芦荟大黄素进行生物转化研究,并获得了一个具有位置选择性的糖基化产物——芦荟大黄素-3-(羟甲基)-O-β-D-葡萄糖苷,表明甘草细胞中含有能对芦荟大黄素的 3 位羟甲基进行位置选择性糖基化的生物酶。本研究为蒽醌和其他酚类化合物的定向结构改造提供了新思路,同时,该研究中位置选择性糖基化反应的发现为从甘草培养细胞中获得糖基转移酶提供了信息。
[1]Kuo PL, Lin TC, Lin CC. The antiproliferative activity of aloe-emodin is through p53-dependent and p21-dependent apoptotic pathway in human hepatoma cell lines. Life Sci, 2002, 71(16):1879-1892.
[2]Pecere T, Gazzola MW, Mucignat C, et al. Aloe-emodin is a new type of anticancer agent with selective activity against neuroectodermal tumors. Cancer Res, 2000, 60(11):2800-2804.
[3]Jin RC, Xie WX, Pang Y, et al. Studies on the chemical components and pharmacological actions of Rhubarb. Nat Prod Res Dev, 2007,19(B11):548-551, 502. (in Chinese)
金汝城, 谢伟雪, 逄艳, 等. 大黄的化学成分及药理作用研究进展.天然产物研究与开发, 2007, 19(B11):548-551, 502.
[4]Fu XS, Chen F, Liu XH, et al. Progress in research of chemical constituents and pharmacological actiona of Rhubarb. Chin J New Drugs, 2011, 20(16):1534-1538, 1568. (in Chinese)
傅兴圣, 陈菲, 刘训红, 等. 大黄化学成分与药理作用研究新进展.中国新药杂志, 2011, 20(16):1534-1538, 1568.
[5]Park MY, Kwon HJ, Sung MK. Evaluation of aloin and aloe-emodin as anti-inflammatory agents in aloe by using murine macrophages. Biosci Biotechnol Biochem, 2009, 73(4):828-832.
[6]Huang LY, Lin XH, Chen W, et al. Study of aloe-emodin and emodin scavenging oxy-free radicals. Chin Hosp Pharm J, 2006, 26(1):12-14. (in Chinese)黄丽英, 林新华, 陈伟, 等. 芦荟大黄素、芦荟素清除氧自由基作用的研究. 中国医院药学杂志, 2006, 26(1):12-14.
[7]Vargas F, Díaz Y, Carbonell K. Antioxidant and scavenging activity of emodin, aloe-emodin, and rhein on free-radical and reactive oxygen species. Pharm Biol, 2004, 42(4-5):342-348.
[8]Pervaiz I, Ahmad S, Madni MA, et al. Microbial biotransformation: a tool for drug designing (Review). Prikl Biokhim Mikrobiol, 2013,49(5):435-449.
[9]Gao F, Zhang JM, Wang ZG, et al. Biotransformation, a promising technology for anti-cancer drug development. Asian Pac J Cancer Prev,2013, 14(10):5599-5608.
[10]Chigorimbo-Murefu NT, Njoroge M, Nzila A, et al. Biotransformation and biocatalysis: roles and applications in the discovery of antimalarials. Future Med Chem, 2012, 4(18):2325-2336.
[11]Dai J, Qu R, Zou J, et al. Structural diversification of taxanes by whole-cell biotransformation. Tetrahedron, 2008, 64(35):8102-8116.
[12]Yin YZ, Chen RD, Zhang DW, et al. Regio-selective prenylation of flavonoids by plant cell suspension cultures of Cudrania tricuspidata and Morus alba. J Mol Catal B: Enzym, 2013, 89:28-34.
[13]Dai J, Ye M, Guo H, et al. Regio- and stereo-selective biotransformation of 2α,5α,10β,14β-tetra-acetoxy-4(20), 11-taxadiene by Ginkgo cell suspension cultures. Tetrahedron, 2002, 58(28):5659-5668.
[14]Suga T, Hirata T. Biotransformation of exogenous substrates by plant cell cultures. Phytochemistry, 1990, 29(8):2393-2406.
[15]Wei YH, Wu XA, Zhang CZ, et al. Studies on chemical constituents of Rheum glabricaule Sam.(II). Chin Pharm J, 2006, 41(4):253-254. (in Chinese)魏玉辉, 武新安, 张承忠, 等. 光茎大黄化学成分研究(II). 中国药学杂志, 2006, 41(4):253-254.
Methods Aloe-emodin was added into cell suspension cultures of Glycyrrhiza uralensis and incubated for another 7 d. To obtain residues, the culture medium was processed by a macroporous adsorbent resin column or the cells was extracted with MeOH, and then these two residues was separated and purified by Sephadex LH-20 column chromatography, silica gel column chromatographyand reversed-phase semi-preparative HPLC, successively. Through the processes, a metabolite was achieved. The structure of the metabolite was elucidated on the basis of spectroscopic analyses.
Results A regio-selectively glycosylated product, aloe-emodin-3-(hydroxymethyl)-O-β-D-glucoside, was isolated from the biotransformation of aloe-emodin by G. uralensis cell suspension cultures.
Conclusion The result indicates that the G. uralensis cell suspension cultures possess the regio-selective glycosylated capacity for aloe-emodin.
Regio-selective glycosylation of aloe-emodin by cell suspension cultures of Glycyrrhiza uralensis
ZHANG De-wu, TAO Xiao-yu, YU Li-yan, DAI Jun-gui
Objective To investigate the biotransformation of aloe-emodin by cell suspension cultures of Glycyrrhiza uralensis.
ALOE-EMODIN; Glycyrrhiza uralensis; Glycosylation; Suspension cultured cells
DAI Jun-gui, Email: jgdai@imm.ac.cn
10.3969/cmba.j.issn.1673-713X.2015.03.010
十二五“重大新药创制”国家科技重大专项(2012X 09301002-001-005)
100050 北京,中国医学科学院北京协和医学院药物研究所(张德武、陶小宇、戴均贵),医药生物技术研究所(张德武、余利岩)
戴均贵,Email:jgdai@imm.ac.cn
2015-03-25
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):248-251
Author Affiliations: Institute of Materia Medica (ZHANG De-wu, TAO Xiao-yu, DAI Jun-gui), Institute of Medicinal Biotechnology (ZHANG De-wu, YU Li-yan), Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):248-251

