氧化应激及抗氧化防御系统在慢性牙周炎中的作用
张馨艺, 李 萌, 隋秉东 综述; 刘 琪, 赵信义 审校
(1. 遵义医学院附属口腔医院牙周科, 贵州 遵义 563003;2. 第四军医大学口腔医院 军事口腔医学国家重点实验室 口腔修复科, 陕西 西安 710032 3. 第四军医大学口腔医院 军事口腔医学国家重点实验室 口腔材料教研室, 陕西 西安 710032)
氧化应激及抗氧化防御系统在慢性牙周炎中的作用
张馨艺1, 李 萌2, 隋秉东3综述; 刘 琪1, 赵信义3审校
(1. 遵义医学院附属口腔医院牙周科, 贵州 遵义 563003;2. 第四军医大学口腔医院 军事口腔医学国家重点实验室 口腔修复科, 陕西 西安 710032 3. 第四军医大学口腔医院 军事口腔医学国家重点实验室 口腔材料教研室, 陕西 西安 710032)
近年来研究发现,氧化应激与抗氧化防御系统的失衡在慢性牙周炎中发挥重要作用,牙周组织受到细菌刺激产生的过量活性氧可造成和加重牙周组织的损伤。本文就炎性条件下过量活性氧对牙周组织的损害,以及氧化应激与抗氧化防御系统在慢性牙周炎发生发展中的作用和机制作一综述。
氧化应激; 活性氧; 抗氧化物; 慢性牙周炎
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.01.011
[Chinese Journal of Conservative Dentistry,2015,25(1): 52]
慢性牙周炎是一种由特定细菌引起的慢性感染性疾病,其特点是牙周支持组织的进行性破坏,可造成牙龈、牙周膜、牙槽骨和牙骨质的不可逆性损害[1]。近年来,在与牙周炎发生和发展相关的危险因素中,由过量活性氧产生的氧化应激越来越受到人们的关注。牙菌斑中存在许多细菌病原体,这些病原体可刺激宿主细胞释放各种促炎细胞因子,吸引中性粒细胞、巨噬细胞等机体防御细胞到牙周炎症部位。这些炎性细胞可通过产生活性氧来抵御细菌的侵袭,但同时也极易产生过量的活性氧,从而导致牙周局部的氧化应激,并进而加重牙周损伤[2]。机体内存在着天然的抗氧化防御系统,包括维生素A、维生素C、超氧化物歧化酶、过氧化氢酶、髓过氧化物酶等多种组成部分[3]。抗氧化系统可通过分解活性氧而对机体组织起到保护作用,生理条件下与氧化应激构成动态平衡,炎性条件下由于过量活性氧的产生可导致二者的失衡,并将对组织产生损害作用[4]。目前,有研究证实,氧化应激与抗氧化防御系统在体内的失衡与牙周炎的发病密切相关,但其造成牙周炎损害的具体机制尚不明确。本文就氧化应激及抗氧化防御系统在牙周炎发生和发展中的作用作一综述。
1 氧化应激与活性氧
1.1 氧化应激与活性氧的产生
活性氧(reactive oxygen species, ROS)是生物体内与氧代谢有关的含氧自由基以及易形成自由基的过氧化物的总称,包括超氧化物自由基(O22-)、羟自由基(·OH)、一氧化氮自由基(·NO)、单线态氧(O2)和过氧化氢(H2O2)等[3]。ROS在许多生理过程中均起重要作用,例如:可依靠其强氧化作用杀灭细菌、病毒等致病微生物;可作为第二信使参与细胞的信号转导等[5]。在炎性条件下,机体防御细胞可产生过量的ROS,当ROS在体内蓄积过多时则形成氧化应激,并通过氧化各种细胞和组织的生物分子,从而加重炎症对组织的损害[6]。
促使炎性条件下体内产生氧化应激的因素是来源于内源性和外源性环境中的多种氧化剂。外源性来源包括:发热、外伤、紫外线、吸烟、辐射、感染和某些药物等[7],其中绝大多数是慢性牙周炎的危险因素。内源性来源主要是:①由于线粒体电子传递系统的紊乱而产生的超氧化物;②机体防御细胞应激性产生的ROS[8]。这种氧化应激在牙周组织的破坏中发挥着重要的作用。
1.2 活性氧对于组织的损害及衡量方法
ROS在多种生理或病理条件下均可产生。虽然大多数的ROS寿命短暂,但是它们可造成组织和细胞重要成分(如核酸、蛋白质、脂质)的氧化损害[9]。这些破坏目前可通过测量脂质过氧化、DNA和蛋白损伤的方法进行评估。
1.2.1 脂质过氧化的标志物及衡量方法
当ROS与不饱和脂肪酸相互作用时就可生成过氧化脂质等脂自由基,并形成连锁反应破坏细胞膜[9]。目前用于测量过氧化脂质的标志物有以下几种:硫代巴比妥酸反应物(包括丙二醛)、异前列烷、乙烷/戊烷等烃类物质。一般的硫代巴比妥酸反应物由于缺乏特异性,在标记ROS损伤的测量中已经不再常用[10];而丙二醛(malondialdehyde, MDA)则可直接测量,或间接通过高压液相色谱法进行测量,并且比硫代巴比妥酸反应物更具特异性,可直接作为标志物反映脂质过氧化情况[11]。目前认为,脂质过氧化反应的最佳标志物是异前列烷,它可进一步导致多不饱和脂肪酸侧链脂质的继发性过氧化反应[12]。乙烷和戊烷由于难以收集,就目前的技术很难实现其精确的测量。
1.2.2 DNA和蛋白质损伤的标志物及衡量方法
ROS及其产生的羟自由基可引起DNA链断裂,并攻击DNA碱基和脱氧核糖,可通过高压液相色谱或抗体等方法对其进行衡量[9]。但目前还没有单一的反应产物可作为DNA损伤的指标,仅8-脱氧核糖鸟嘌呤核苷酸最为常用[13]。
目前对于蛋白质氧化损伤的检测指标主要有2个,分别是蛋白羰基生成和二酪氨酸的生成,也即酪氨酸残基的硝基化。ROS氧化蛋白质后所产生的相对稳定的终产物是蛋白质羰基基团,可通过羰基法进行测定;且因其更加稳定,作为氧化应激的标志物比脂质过氧化产物更具优势[14]。然而,蛋白质羰基基团并非ROS损伤的特异性生物标志物,由于醛和糖化基团也能同时被检出[10],故仅能作为衡量组织内ROS损伤的一般方法。硝基酪氨酸是蛋白质硝基化的主要产物,体内硝化应激源自氧化应激产生的氧化亚硝酸阴离子(ONOO-),其性质活泼,能迅速与周围物质发生反应[15]。由于ONOO-在体内的半衰期很短,硝基酪氨酸作为蛋白质被ONOO-攻击后留下的“分子指纹”,目前已被广泛应用于ROS及其产生的氧化/硝化应激的衡量[16]。
2 机体抗氧化防御系统
2.1 抗氧化防御系统的组成与抗氧化机制
抗氧化剂是以较低浓度存在却可有效抑制ROS产生氧化应激的物质。机体在不可避免地产生ROS的同时,也产生着多种抗氧化剂以抵消自由基对细胞的氧化攻击,从而形成了在体内具有与免疫系统相似的复杂的抗氧化防御系统[17]。人体内的抗氧化剂主要包括酶促抗氧化剂(如超氧化物歧化酶、过氧化氢酶、髓过氧化物酶等)和非酶促抗氧化剂(如多种维生素、谷胱甘肽等)[11],其中非酶促抗氧化剂可以从饮食中摄取。由于这些抗氧化剂在消除ROS的功能上类似,故可通过相互补充和协作而构成一个完善的系统。
抗氧化剂可通过以下3种方式抑制氧化应激:①预防氧自由基的形成;②通过清除自由基活性代谢产物并将其转换为较不活泼的分子;③修复ROS造成的损害,同时为系统内的其它抗氧化剂发挥作用和互相再生提供有利环境[4]。依赖不同的机制,不同抗氧化剂抵御ROS损伤机体的能力亦不同,如何衡量抗氧化防御的作用和效果,已成为学术界共同关注的问题。
2.2 抗氧化防御的作用与衡量方法
抗氧化防御系统对体内氧化应激的应答是动态的,在一定程度下可与氧化应激形成平衡。机体的抗氧化系统高度集成而复杂,抗氧化剂普遍存在于细胞内外,从而使重要的生物大分子得到实质性的保护[4]。目前认为,相对于分别测量每种抗氧化剂的存在和效果,将总抗氧化能力(total antioxidant capacity, TAOC)作为整体性的指标更加经济省时,因此测量机体的整体抗氧化防御效应已被广泛应用[18-22]。不仅如此,TAOC的测量结果还可同时反映一些可能尚未被发现的或目前技术上尚难以衡量的抗氧化剂的效应。牙周组织中的抗氧化防御系统的状态,可以通过从唾液和龈沟液中提取样本进行测量[19-22];其测量结果与血清相比,更能说明抗氧化防御系统在牙周疾病活动中的精确状态。
3 氧化应激-抗氧化防御失衡在牙周炎发病中的分子机制
ROS是机体正常代谢过程中的产物,在正常生理条件下,ROS的产生及其被抗氧化防御系统消除两者间处于一个动态平衡的过程,故不会对机体造成危害;而在慢性牙周炎情况下,由于牙周组织内产生的ROS过多,抗氧化防御系统不能将其及时清除,从而使ROS在牙周组织内蓄积,并进而造成或加重牙周组织的损伤[23]。
慢性牙周炎组织中的氧化应激-抗氧化防御失衡与致病性细菌和宿主之间的免疫反应密切相关。细菌内的DNA和脂多糖(Lipopolysaccharides, LPS)可作用于牙龈成纤维细胞,通过其上的CD14和toll样受体-4(toll like receptor-4, TLR-4)引起其激活蛋白-1(activating protein- 1, AP- 1)的活化和NF- κB信号通路的激活,并同时产生炎性细胞因子[24];细菌和炎性细胞因子可通过引起巨噬细胞和中性粒细胞应答的激活,从而加速ROS的产生。另一方面,NF- κB和AP- 1的活化还会导致破骨细胞的激活,并增加其分泌基质金属蛋白酶(matrix metalloproteinases, MMP)的浓度,从而造成牙周组织损伤[25]。牙周组织损伤后,又进而引起脂质过氧化物、炎性介质和氧化蛋白的过度生成,并进一步激活巨噬细胞、中性粒细胞和牙龈成纤维细胞产生更多的ROS;当ROS逐步蓄积到超过抗氧化防御的抵抗能力时,就会导致氧化应激的形成,进一步加重牙周组织的损伤[6]。总之,由于慢性牙周炎中牙周致病菌的存在,使得ROS参与菌斑-宿主免疫反应并形成恶性循环,最终造成和加重牙周组织的破坏。将上述关系总结如图(图1)。
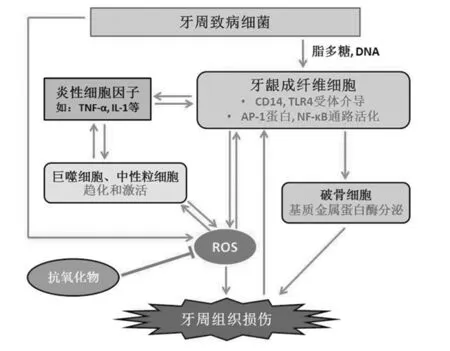
图1 ROS参与菌斑-宿主免疫反应,形成恶性循环,并在炎性条件下造成和加重牙周损伤。抗氧化物可抵御由ROS形成的氧化应激
4 氧化应激-抗氧化防御失衡在牙周炎发病中的表现
4.1 活性氧对牙周组织的破坏
慢性牙周炎导致的牙周组织破坏是微生物菌斑与宿主之间发生异常炎症/免疫反应的结果[1-2]。ROS可通过多种途径参与和介导菌斑-宿主免疫反应,并在炎症条件下造成和加重牙周组织损伤。
目前对于ROS与牙周组织损伤方面的研究主要集中于ROS对于脂质的过氧化效应,其中硫代巴比妥酸反应物和MDA作为脂质过氧化的标志物已在慢性牙周炎中被检测。Panjamurthy等在对25例慢性牙周炎患者和健康对照者进行临床检测时发现,硫代巴比妥酸反应物在慢性牙周炎患者的牙周局部组织中有所升高,表明慢性牙周炎患者脂质过氧化水平高于牙周健康的对照组[11]。Wei等(2010)测量了48名慢性牙周炎患者牙周治疗前后的唾液和龈沟液中的MDA,并以牙周健康者作为对照,结果显示:慢性牙周炎组治疗前的MDA水平显著高于健康对照组,但经过牙周治疗后,其唾液和龈沟液中的脂质过氧化水平则较基础水平有所降低[19]。同年,D'Aiuto等为探索慢性牙周炎中宿主免疫反应与ROS的相互作用,对145例慢性牙周炎患者和56例健康对照者进行了病例-对照研究,结果显示:与健康对照组相比,患有严重牙周炎患者的血清样本中表现出较高的反应性氧代谢物水平,并且与宿主免疫反应相关的C-反应蛋白和白介素-6水平及牙周损伤相关指标高度相关[26]。
在ROS相关的DNA损伤方面,日本的研究团队曾采用酶联免疫吸附法测定了唾液样本中的8- 脱氧核糖鸟嘌呤核苷酸的含量,并发现其在慢性牙周炎患者唾液样本中的表达水平显著高于牙周健康对照组,提示ROS对牙周组织的DNA存在氧化损伤[13]。近年来,关于ROS对牙周组织蛋白质损伤的研究也逐渐开展,多个研究团队分别以结扎法诱导的大鼠慢性牙周炎模型为对象,并通过蛋白印迹法检测其牙周组织中相关蛋白的表达量,结果显示:结扎侧3-硝基酪氨酸呈阳性表达,免疫组化定位发现,结扎侧牙周组织中炎症细胞和硝基酪氨酸阳性的细胞含量均高于对照侧;提示,慢性牙周炎与ROS介导的菌斑-宿主免疫反应密切相关[15]。此外,Sculley、Langley-Evans等在对120名常规口腔检查者的相关资料进行统计时发现,牙周健康状况与唾液蛋白质羰基浓度升高有关[14]。
4.2 抗氧化防御与牙周炎
鉴于氧化应激-抗氧化防御系统的失衡与慢性牙周炎组织破坏之间可能存在的密切联系,在慢性牙周炎中检测宿主抗氧化水平已被广泛采用。
目前的检测主要针对衡量机体整体抗氧化防御能力的指标TAOC。Guarnieri等(1991)报道慢性牙周炎患者龈沟液中的TAOC水平与健康对照组相比并无明显差异[27]。Diab- Ladki等(2003)通过病例-对照研究发现,慢性牙周炎患者唾液中的TAOC水平降低[21]。Pavlica等(2004)分别检测了犬上颌第四前磨牙龈沟液和血液样品中的TAOC水平,发现发生慢性牙周炎的前磨牙龈沟液中的TAOC水平升高,但在血液样本中其浓度反而有所降低[20]。Wei等(2010)对48名慢性牙周炎患者的唾液和龈沟液样本中的TAOC水平进行检测时发现,慢性牙周炎组的TAOC水平显著高于健康对照组;但经过牙周治疗后,其TAOC水平较基础水平显著下降,与脂质过氧化指标MDA水平的变化存在高度的相关性[19]。同年,Kim等也证实,重度慢性牙周炎患者唾液中的TAOC水平高于健康受试者或经刮治及根面平整术后牙周炎得到控制的患者[22]。以上结果表明,机体抗氧化防御系统对牙周氧化应激存在一定的保护性反应。但各结果之间尚存在一定的差异,可能是因所采用的牙周炎模型、受试样本或检测方法的不同而导致。
除整体性指标外,学者们还逐步探索明确了慢性牙周炎中不同抗氧化剂的存在情况和效果。Tsai等分别收集13例慢性牙周炎患者和9名健康对照者的唾液和龈沟液样本,并采用分光光度法测定了其中谷胱甘肽浓度,结果显示:慢性牙周炎患者样本中的谷胱甘肽浓度较对照组明显降低,但通过牙周初步治疗后,其浓度有所回升;提示此种抗氧化剂与慢性牙周炎的发病呈负相关[28]。Linden等(2009)在调查1 258名60~70岁的西欧男性牙周健康和抗氧化剂血清水平之间的关联时发现,β-胡萝卜素等类胡萝卜素的低血清水平也可增加慢性牙周炎的患病率[29]。然而,Wei等(2010)在慢性牙周炎患者唾液和龈沟液样本检测过程中发现,超氧化物歧化酶的水平显著高于健康对照组,且经牙周治疗后,其水平较治疗前水平显著下降[19]。Panjamurthy等对慢性牙周炎患者牙周组织中的各类抗氧化剂的水平做了全面的检测,发现超氧化物歧化酶等酶促抗氧化剂活性显著升高,而维生素C、维生素E和谷胱甘肽等非酶促抗氧化剂水平显著降低[11]。以上一系列研究结果表明,在慢性牙周炎中不同类型的抗氧化剂针对牙周氧化应激可能具有不同的保护或损伤效应,进而决定牙周组织的整体抗氧化水平。牙周抗氧化效应的差异与牙周炎的严重程度相关联,牙周氧化应激-抗氧化防御的失衡是牙周组织损伤的关键因素。
综上所述,氧化应激-抗氧化防御平衡与慢性牙周炎牙周状况密切相关,其失衡在慢性牙周炎的发病机制和相关的牙周组织损伤中发挥重要作用。在慢性牙周炎的发生发展过程中,菌斑-宿主免疫反应可产生ROS并形成氧化应激,在ROS过量或抗氧化剂不足的条件下,过量的ROS又可直接参与菌斑-宿主免疫反应,在牙周组织损伤的致病机理中处于关键地位。基于以上研究,我们从维持和恢复氧化应激-抗氧化防御平衡的角度为预防和治疗慢性牙周炎提出如下建议:①尽量避免吸烟、感染等促进ROS生成的因素;②妥善治疗糖尿病等易产生过量ROS的疾病;③鼓励摄取非酶促抗氧化剂如维生素C、维生素E、β-胡萝卜素等以预防牙周组织抗氧化能力的降低;④可考虑辅助使用抗氧化剂以提高牙周各种手术和非手术治疗的效果。目前的研究依然存在以下两点不足:①尚未使用ROS的直接检测手段,多采用脂质过氧化、DNA和蛋白质损伤的相关指标间接说明氧化应激在慢性牙周炎中的参与情况;②临床和动物实验尚未证实通过改善氧化应激或抗氧化状态后,是否可使慢性牙周炎得以缓解。日后如采用荧光探针技术对ROS进行直接检测[3],同时开展靶向过量ROS或抗氧化剂不足的牙周干预性临床实验和动物研究,将会更加明确氧化应激和抗氧化防御系统在慢性牙周炎发病过程中的作用,为今后更加有效地预防和治疗慢性牙周炎提供有力的理论依据。
[1]Otomo- Corgel J, Pucher JJ, Rethman MP,etal. State of the science: chronic periodontitis and systemic health[J].JEvidBasedDentPract, 2012,12(3 Suppl):20-28.
[2]Ohnishi T, Bandow K, Kakimoto K,etal. Oxidative stress causes alveolar bone loss in metabolic syndrome model mice with type 2 diabetes[J].JPeriodontalRes, 2009, 44(1):43-51.
[3]Sui BD, Xu TQ, Liu JW,etal. Understanding the role of mitochondria in the pathogenesis of chronic pain[J].PostgradMedJ, 2013, 89(1058):709-714.
[4]Halliwell B, Gutteridge JM. The antioxidants of human extracellular fluids[J].ArchBiochemBiophys, 1990, 280(1):1-8.
[5]Nickel A, Kohlhaas M, Maack C. Mitochondrial reactive oxygen species production and elimination[J].JMolCellCardiol, 2014.
[6]Walczak- Jedrzejowska R, Wolski JK, Slowikowska- Hilczer J. The role of oxidative stress and antioxidants in male fertility[J].CentEuropeanJUrol, 2013, 66(1):60-67.
[7]Canakçi CF, Ciçek Y, Canakçi V,etal. Reactive oxygen species and human inflammatory periodontal diseases[J].Biochemistry(Mosc) , 2005, 70(6):619-628.
[8]Sugano N, Kawamoto K, Numazaki H,etal. Detection of mitochondrial DNA mutations in human gingival tissues[J].JOralSci, 2000, 42(4):221-223.
[9]Liochev SI. Reactive oxygen species and the free radical theory of aging[J].FreeRadicBiolMed, 2013,60:1-4.
[10]Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? [J].BrJPharmacol, 2004, 142(2):231-255.
[11]Panjamurthy K, Manoharan S, Ramachandran CR,etal. Lipid peroxidation and antioxidant status in patients with periodontitis[J].CellMolBiolLett, 2005, 10(2):255-264.
[12]Roberts LJ 2nd, Morrow JD. Products of the isoprostane pathway: unique bioactive compounds and markers of lipid peroxidation[J].CellMolLifeSci, 2002, 59(5):808-820.
[13]Takane M, Sugano N, Iwasaki H,etal. New biomarker evidence of oxidative DNA damage in whole saliva from clinically healthy and periodontally diseased individuals[J].JPeriodontol, 2002, 73(5):551-554.
[14]Sculley DV, Langley- Evans SC. Periodontal disease is associated with lower antioxidant capacity in whole saliva and evidence of increased protein oxidation[J].ClinSci(Lond) , 2003, 105(2):167-172.
[15]Lohinai Z, Stachlewitz R, Virág L. Evidence for reactive nitrogen species formation in the gingivomucosal tissue[J].JDentRes, 2001, 80(2):470-475.
[16]Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health and disease[J].PhysiolRev, 2007, 87(1):315-424.
[17]Halliwell B.Reactive oxygen species in living systems: source, biochemistry, and role in human disease[J].AmJMed, 1991, 91(3C):14S-22S.
[18]Brock GR, Butterworth CJ, Matthews JB,etal. Local and systemic total antioxidant capacity in periodontitis and health[J].JClinPeriodontol, 2004, 31(7):515-521.
[19]Wei D, Zhang XL, Wang YZ,etal. Lipid peroxidation levels, total oxidant status and superoxide dismutase in serum, saliva and gingival crevicular fluid in chronic periodontitis patients before and after periodontal therapy[J].AustDentJ, 2010, 55(1):70-78.
[20]Pavlica Z, Petelin M, Nemec A,etal. Measurement of total antioxidant capacity in gingival crevicular fluid and serum in dogs with periodontal disease[J].AmJVetRes, 2004, 65(11):1584-1588.
[21]Diab- Ladki R, Pellat B, Chahine R. Decrease in the total antioxidant activity of saliva in patients with periodontal diseases[J].ClinOralInvestig, 2003, 7(2):103-107.
[22]Kim SC, Kim OS, Kim OJ,etal. Antioxidant profile of whole saliva after scaling and root planing in periodontal disease[J].JPeriodontalImplantSci, 2010, 40(4):164-171.
[23]Dahiya P, Kamal R. Rotary instruments in the treatment of chronic periodontitis: A randomized clinical trial[J].JIndianSocPeriodontol, 2013, 17(6):748-752.
[24]Walter C, Zahlten J, Schmeck B,etal. Porphyromonas gingivalis strain- dependent activation of human endothelial cells[J].InfectImmun, 2004, 72(10):5910-5918.
[25]Yates S, Rayner TE. Transcription factor activation in response to cutaneous injury: role of AP- 1 in reepithelialization[J].WoundRepairRegen, 2002, 10(1):5-15.
[26]D'Aiuto F, Nibali L, Parkar M,etal. Oxidative stress, systemic inflammation, and severe periodontitis[J].JDentRes, 2010, 89(11):1241-1246.
[27]Guarnieri C, Zucchelli G, Bernardi F,etal. Enhanced superoxide production with no change of the antioxidant activity in gingival fluid of patients with chronic adult periodontitis[J].FreeRadicResCommun, 1991, 15(1):11-16.
[28]Tsai CC, Chen HS, Chen SL,etal. Lipid peroxidation: a possible role in the induction and progression of chronic periodontitis[J].JPeriodontalRes, 2005, 40(5):378-384.
[29]Linden GJ, McClean KM, Woodside JV,etal. Antioxidants and periodontitis in 60-70-year- old men[J].JClinPeriodontol, 2009, 36(10):843-849.
Oxidative stress and antioxidant defense system in the development of chronic periodontitis
ZHANG Xin- yi*, LI Meng, SUI Bing- dong, LIU Qi, ZHAO Xin- yi
(*Dept.ofPeriodontics,SchoolofStomatology,TheAffiliatedHospitalofZunyiMedicalCollege,Zunyi563003,China)
Reactive oxygen species (ROS) overproduction by periodontal tissues under bacterial stimuli can cause and aggravate the damages of periodontal tissues. This review focuses on the damages of periodontal tissues induced by ROS overproduction under inflammatory condition, as well as the roles and related mechanisms of oxidative stress and antioxidant defense system in the development of chronic periodontitis.
oxidative stress; reactive oxygen species; antioxidants; chronic periodontitis
2014-04-18
国家自然科学基金(81360168)
张馨艺(1987-),女,汉族,辽宁朝阳人。硕士生(导师:刘琪)
刘 琪, E-mail: liuqi1964@hotmail.com;
赵信义, E-mail: zhaoxinyi@fmmu.edu.cn
R781.4
A
1005-2593(2015)01-0052-05

