同一个体来源正常与炎性牙周膜干细胞生物学性能的比较
张琳琳, 毕春升, 陈发明, 金 岩
(第四军医大学口腔医院 军事口腔医学国家重点实验室: 1. 牙周科; 2. 组织工程研发中心, 陕西 西安 710032)
·基础研究·
同一个体来源正常与炎性牙周膜干细胞生物学性能的比较
张琳琳1, 毕春升1, 陈发明1, 金 岩2
(第四军医大学口腔医院 军事口腔医学国家重点实验室: 1. 牙周科; 2. 组织工程研发中心, 陕西 西安 710032)
目的: 比较同一个体来源正常与炎性牙周膜干细胞的生物学性能。方法:分别分离培养同一个体来源正常牙周膜干细胞(hPDLSCs)及炎性牙周膜干细胞(i- hPDLSCs)。流式细胞仪鉴定两种干细胞表面抗原标记;MTT法、克隆形成率检测并比较两者的增殖能力;茜素红染色及油红O染色检测并比较其分化能力;RT- PCR检测成骨相关基因COL- 1、Runx- 2、BSP- mRNA及成脂相关基因LPL与PPAR γ mRNA的表达水平。 结果: i- hPDLSCs及hPDLSCs均具有间充质干细胞特性,i- hPDLSCs增殖能力强于hPDLSCs,但分化能力明显弱于hPDLSCs(P<0.05); 两者成脂能力比较无统计学差异(P>0.05)。结论:炎症微环境对牙周膜干细胞的生物学性能有一定的影响。
牙周膜干细胞; 炎性牙周膜干细胞; 增殖; 分化
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.01.001
[Chinese Journal of Conservative Dentistry,2015,25(1): 1]
牙周病是一种慢性进行性疾病,其最终结果会导致牙齿脱落缺失,在我国牙周病的发病率高达90%以上,已成为我国成年人失牙的首要因素。因此,牙周病的治疗越来越引起广大学者的关注。随着组织工程及再生医学的发展,牙周组织再生被认为是牙周组织缺损治疗的更好选择,而人牙周膜干细胞(human periodontal ligament stem cell,hPDLSCs)作为牙周再生的重要种子细胞也引起了公众的更多关注,已经证实hPDLSCs是良好的干细胞来源。有学者在动物实验中发现,hPDLSCs在牙周损伤处可形成牙周膜、牙槽骨和牙骨质,达到牙周修复和再生的目的[1]。近年来,转化医学的发展将基础研究与临床应用紧密结合到一起。转化医学作为一种新的理念,旨在推动基础研究成果快速向临床转化并应用于疾病的诊断、预防和治疗[2]。在此理论基础上,Feng等[3]将牙周膜祖细胞(类似hPDLSCs)应用于3例患者身上,对患者进行随访研究,并在探诊深度、牙龈退缩和附着水平3个方面进行了评估。此研究从临床试验角度为牙周膜细胞在人类牙周炎治疗中的安全性和有效性提供了有利证据。现用于实验研究的hPDLSCs多取自患者正常第三磨牙或正畸牙,这就限制了hPDLSCs的来源,给临床应用造成了一定的局限,因此寻求更广阔的种子细胞来源就成为人们进一步追求的目标。牙周炎最终会导致牙槽骨吸收,牙齿松动脱落,近期Park等[4]从炎症性牙周组织中提取出hPDLSCs命名为i-hPDLSCs(inflammatory human periodontal ligament stem cells,i- hPDLSCs),并证实其保留了成牙骨质及成牙周膜的能力,是否可以使用炎症来源的牙周膜细胞来进行牙周再生治疗成为近年来广大学者普遍关注的动向。本研究主要比较同一患者来源正常hPDLSCs及,i- hPDLSCs的生物学性能,为,i- hPDLSCs的临床应用及牙周病的治疗提供理论依据。
1 材料和方法
1.1 主要材料、试剂和设备
α- MEM培养基、胎牛血清(FBS,杭州四季青公司);L- 谷氨酰胺、青、链霉素(Gibco,美国);I型胶原酶(Sigma,美国); Dispase(Roche,美国)2.5 g/L胰蛋白酶(Amresco,美国);地塞米松、β-甘油磷酸钠、维生素C、吲哚美辛、IBMX、胰岛素、MTT、二甲基亚砜(DMSO)、茜素红(上海化学试剂采购供应站)、油红O;抗CD31、抗CD45、抗CD90、抗CD105、抗CD146(R&D Systems,美国);二氧化碳恒温孵箱(Heraeus,德国);YJ- 875 型超净工作台(苏州净化设备厂);离心机(Kub- ota 2100,日本);倒置相差显微镜及照相系统(Olympus,日本);流式细胞仪(ELITE ESO型,BecKman- Coulter,美国);6孔培养板、平底96孔板(Falcon,美国);逆转录试剂盒(TaKaRa)、RT- PCR试剂盒(TaKaRa)、超声震荡仪(上海生源器械厂);酶联免疫检测仪(BIO- TEK, 美国);紫外分光光度计(Eppendorf,德国); Real time PCR仪(Applied biosystems,美国)。
1.2 方法
收集我院牙周病科同一患者因牙周炎导致松动的无保留价值牙及因阻生新鲜拔除的健康第三磨牙,患者知情同意。
1.2.1 i- hPDLSCs及hPDLSCs的培养
i- hPDLSCs的培养:含双抗的PBS浸泡10 min,PBS反复冲洗,锐利刀片刮取根面牙周膜组织,PBS清洗离心,弃上清,加入 3 mg/mL的Ⅰ型胶原酶和4 mg/mL的Dispase,以 1 ∶1 比例混合均匀,放入37 ℃ 、50 mL/L CO2孵箱中消化30 min,800 r/min 离心5 min,弃上清,加入5 mL PBS清洗离心,弃除上清。收集组织并滴加少量培养液接种于6孔板中,上置盖玻片,加入2 mL含100 mL/L胎牛血清的α- MEM 培养液,置于37 ℃、50 mL/L CO2、饱和湿度条件下培养,每隔2~3 d换液并观察。hPDLSCs的培养:PBS冲洗 3遍,刮取根中1/3 区的牙周膜组织,并用PBS清洗离心。将收集的组织按上述步骤分离培养。当两种细胞生长汇合达到8O%时各自消化传代。
1.2.2 有限稀释法克隆分离hPDLSCs和i- hPDLSCs
hPDLSCs和i- hPDLSCs的克隆分离方法基本相同。取对数生长的第1代上述细胞,消化后稀释为10~15/mL的单细胞悬液,接种于96孔板中,每孔加入0.1 mL,保证每个孔不多于1个细胞,常规培养24 h,待细胞贴壁后在显微镜下挑出单个细胞孔并标记,补加0.1 mL培养基,每隔3 d换液。当孔内细胞形成克隆集落并长至孔底1/2后,胰蛋白酶消化并扩大培养,即得到相应的hPDLSCs和i- hPDLSCs。
1.2.3 流式细胞仪检测干细胞表面标志物
分别取对数生长的第3代细胞,制成单细胞悬液,调整密度为1×106/mL。用含30 mL/L胎牛血清的PBS清洗后移至EP管中,加入CD146、CD90、CD105、CD31、CD45抗体,置4 ℃ 冰箱中孵育0.5 h,用含30 mL/L FBS的PBS清洗3遍,送流式细胞仪检测,操作过程需避光。其中CD146、CD105为FITC标记,CD90、CD31、CD45为PE标记。比较两种干细胞表面标志物的表达率。
1.2.4 两种细胞克隆形成能力的比较
取对数生长的第3代hPDLSCs和i-hPDLSCs,分别制成单细胞悬液,将1×103个细胞接种于90 mm 的培养皿中常规培养14 d;弃培养液,PBS浸洗2遍,40 g/L多聚甲醛固定30 min,甲苯胺蓝染色,镜下观察,以大于50个细胞的集落记为1个克隆。计算比较两种细胞的克隆形成率(colony forming unit- fibroblastic,CFU- F)。

1.2.5 MTT法比较两种细胞的生长曲线
分别取hPDLSCs和i- hPDLSCs的第3代细胞消化,重悬,调整细胞密度至1×104/mL,以200 μL 细胞悬液/孔加入96孔板,即每孔含2×103个细胞。共设8块96孔板,每板每种细胞设8个复孔,每隔3 d换液。次日开始检测,每天同一时间点加入5 mg/mL的MTT 20 μL, 4 h后吸去培养液,加150 μL二甲基亚砜,振荡器低速震荡10 min后用酶联免疫检测仪分别检测490 nm波长处的吸光度(OD)值,绘制两种细胞的生长曲线并比较。
1.2.6 两种细胞成骨分化能力的比较
分别取第3代的hPDLSCs和i-hPDLSCs,制成单细胞悬液并调整密度为5×104/mL,接种于6孔板中,当细胞长至70% 时,换成骨诱导液(含 5 mmol/L β-甘油磷酸钠、50 mg/L维生素C、1×10-8mol/L地塞米松、100 mL/L FBS的α-MEM 培养液)培养,每2~3 d换液,培养至第10、30天时分别进行如下检测。
1.2.6.1 成骨基因检测
培养至第10天时分别收集两种细胞,采用TRIzol一步法提取总RNA,紫外分光光度计对样本RNA的纯度和浓度进行测定,A260/280为1.8~2.0 可用于实验。采用PrimeScriptTMRT- PCR Kit(Perfect Real Time)(Takara 公司)试剂盒合成cDNA。然后以cDNA为模板, GAPDH作为内参,Real- time PCR定量分析各成骨相关基因BSP、RUNX- 2、Col- 1的表达水平。PCR反应体系、反应条件以及各操作步骤均严格按照RT- PCR试剂盒说明进行特异性扩增; 所用引物由上海生物工程公司设计并合成,各引物序列见表1。
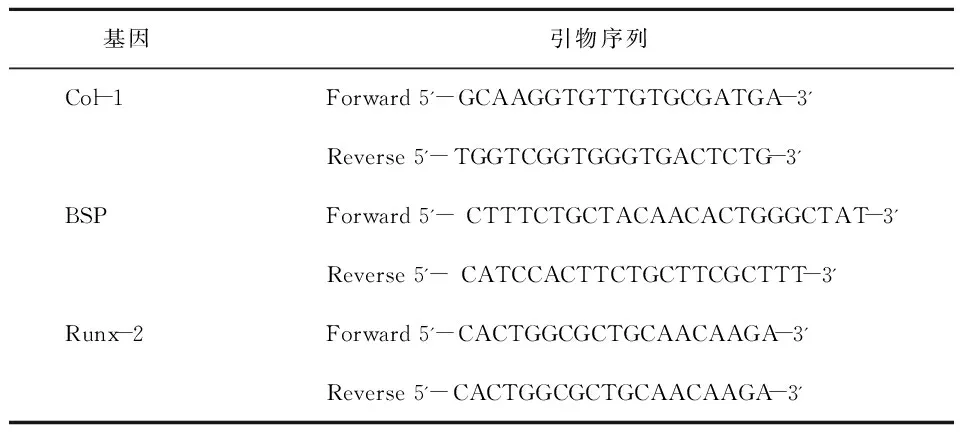
表1 Real- Time PCR各引物序列
1.2.6.2 茜素红染色
培养至30 d时,镜下观察可见细胞呈复层生长并出现圆形结节,弃培养液,PBS浸洗后40 g/L多聚甲醛固定,茜素红染色,镜下观察并拍照。然后再于每孔加入1%氯化十六烷基吡啶1 mL,待矿化结节溶解后,每孔取200 μL溶解液转移至96孔板中,酶标仪检测590 nm波长处的吸光度值,进行矿化结节的定量分析。
1.2.7 两种细胞成脂分化能力的比较
分别取第3代的hPDLSCs和i- hPDLSCs,制成单细胞悬液并调整密度为5×104/mL,接种于6孔板中,当细胞生长至70%时换成脂诱导液(含1 μmol/L 地塞米松,0.5 mmol/L IBMX,10 μg/mL 胰岛素,100 mmol/L 吲哚美辛,100 mL/L FBS的α- MEM培养液)。每2~3 d换液,培养至第10天及21 d时分别进行如下检测:
1.2.7.1 成脂基因检测
培养至第14天时分别收集两组细胞,采用1.2.6.1 的方法检测成脂相关基因LPL和PPAR γ的表达水平。所用引物由上海生物工程公司设计并合成,各引物序列见表2。
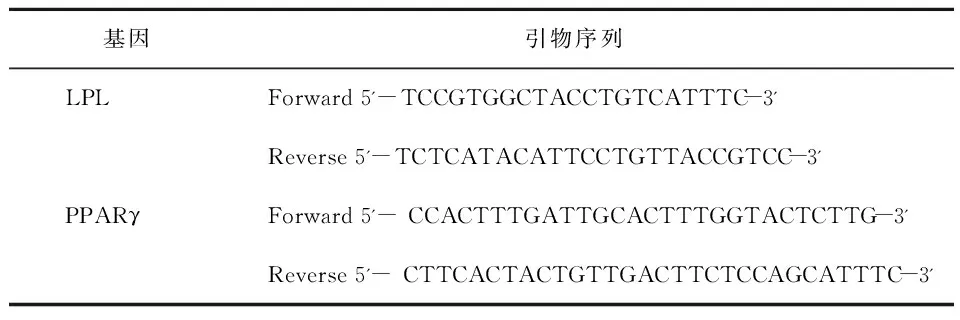
表2 Real- time PCR各引物序列
1.2.7.2 油红O染色
培养至21 d时镜下观察可见脂滴形成,弃培养液后PBS浸洗,40 g/L多聚甲醛固定,油红O染色,镜下观察并照相。将异丙醇溶液加入6孔板中,待脂滴溶解后,测540 nm处吸光度值,比较两种细胞的脂滴形成量。
1.2.8 统计学分析
2 结果
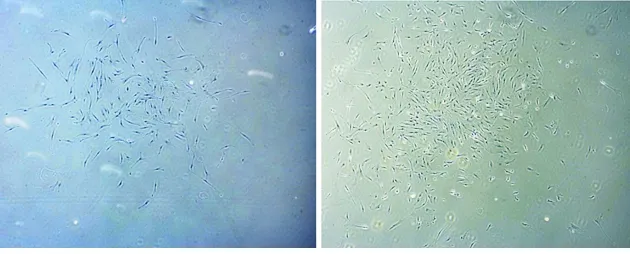
2.1 两种细胞的原代培养
经酶消化法分离得到的i- hPDLSCs培养7 d左右,有细胞从组织块边缘爬出,梭形及多角形细胞呈片状生长,胞体丰满,胞浆均匀,细胞核圆,核仁清晰;14 d 左右细胞生长为80%左右,胰酶消化传代。正常组织来源hPDLSCs经相同方法培养 10 d 左右有细胞爬出,细胞多为梭形细胞,有突起,细胞核居中,2~3周达到80%汇合(图1)。
2.2 两种干细胞表面抗原比较
流式细胞仪检测两种干细胞表面标记物,表达基本一致。阳性表达干细胞特异性表面标记CD146、CD105、CD90;阴性表达内皮细胞特异性表
面标记CD31及造血系干细胞特异性表面标记CD45。PDLSCs检测表面标记物表达如下: CD146为12.5%、 CD105为90.6%、 CD90为99.9%、CD45为0.7%、 CD31为1.1%。i- PDLSCs检测表面标记物表达如下:CD146为56.8%、CD105为92.4%、CD90为99.9%、CD45为0.2%、CD31为0.4%(图2)。

hPDLSCs i- hPDLSCs
图1 两种细胞原代培养12 d(倒置相差显微镜,×40)
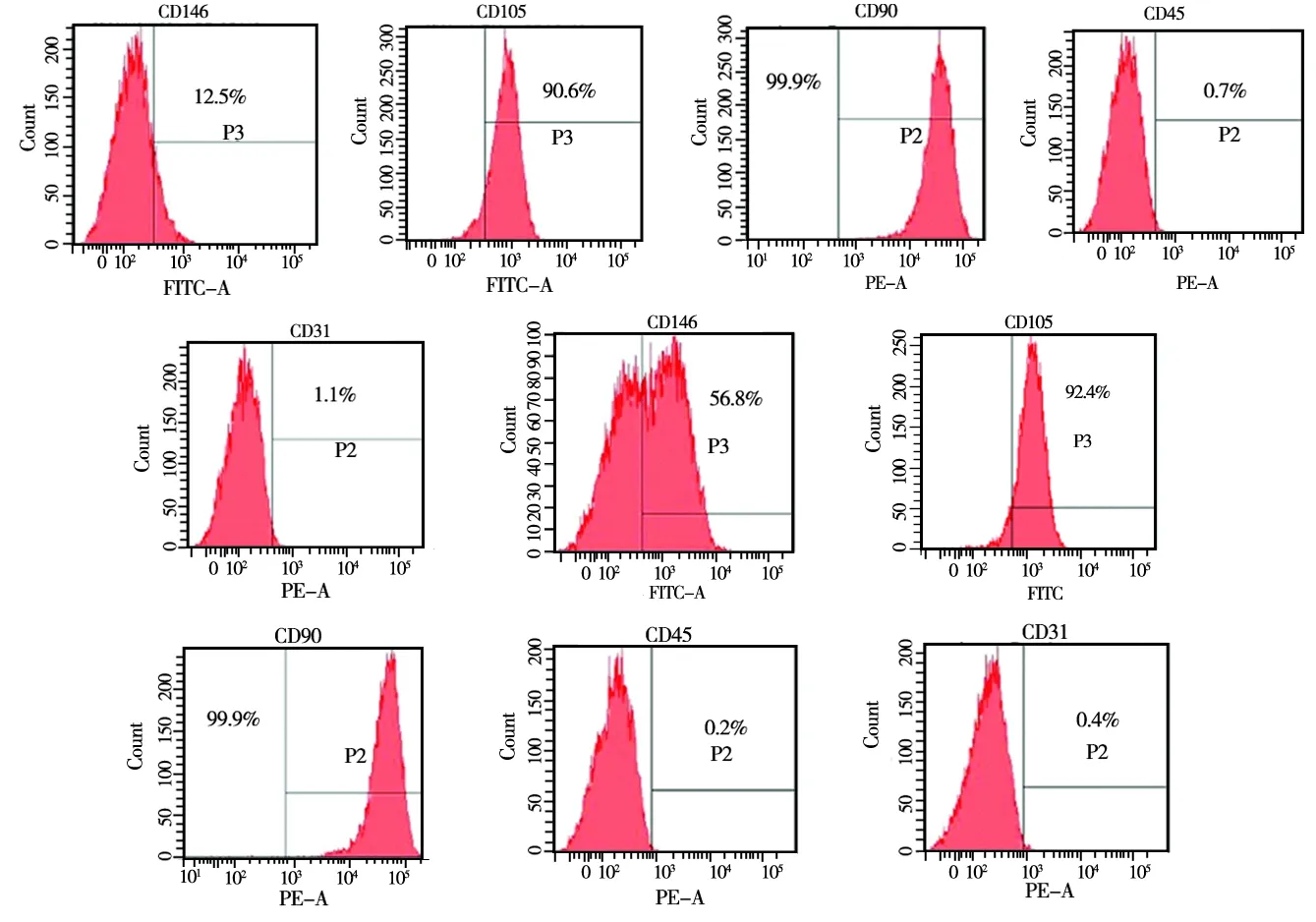
图2 流式细胞仪检测结果
2.3 两种干细胞克隆形成能力比较
分别将1×103个i- hPDLSCs和hPDLSCs接种于90 mm 的培养皿中常规培养, 4 d时可以观察到i- hPDLSCs有细胞集落形成,7 d时可以观察到hPDLSCs有细胞集落形成。镜下观察细胞集落呈漩涡状生长,排列紧密,细胞密度随时间增长。培养14 d,甲苯胺蓝染色后计算克隆形成率。 i- hPDLSCs克隆形成率约为 (33.02±1.8)%,高于hPDLSCs( 19.28±1.4 )%,两者比较具有统计学差异(P<0.05)(图3)。
hPDLSCs i- hPDLSCs
图3 两种细胞培养14 d时形成的单细胞克隆
(倒置相差显微镜,×40)
2.4 两种干细胞生长曲线比较
MTT检测结果显示:两种干细胞在1~2 d时均处于“潜伏期”,从第3天开始,进入“对数生长期”,自第7天以后,两种干细胞逐渐进入“平台期”。对第1、4、7天两种细胞的吸光度值进行比较,第1天,初始两种细胞接种数一致(P>0.05)。第4、7天i- hPDLSCs的增殖能力明显快于hPDLSCs(P<0.05)(图4)。
2.5 两种干细胞成骨能力比较
PDLSCs 成骨诱导10 d左右,细胞开始呈复层
生长,细胞形态呈长梭形;诱导21 d,镜下可见复层生长细胞出现褐色圆形结节,结节逐渐增大。i- hPDLSCs成骨诱导8 d左右,细胞开始复层生长,细胞密度逐渐增大,细胞呈长梭形;诱导24 d,镜下可见复层生长细胞中出现少量褐色圆形结节。诱导30 d后,茜素红染色显示,hPDLSCs矿化结节面积及数量均明显高于i- hPDLSCs。氯化十六烷基吡啶溶液溶解矿化结节,酶标仪检测540 nm处吸光度值,定量结果显示hPDLSCs成骨能力明显强于i- hPDLSCs(P<0.05)(图5)。
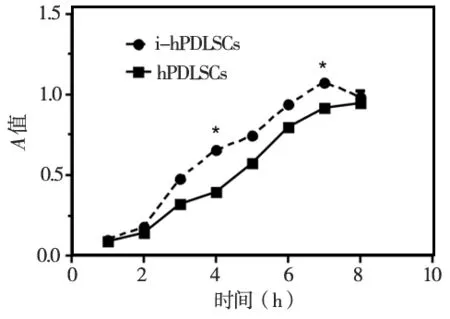
图4 两种细胞的生长曲线(2种细胞4、7 d相比P<0.05)

hPDLSCs i- hPDLSCs
图5 两种细胞成骨诱导30 d (*与hPDLSCs组相比P<0.05)
两种干细胞成骨诱导10 d,收集样本,Real- time PCR 检测成骨相关Runx- 2基因的表达水平,结果显示hPDLSCs中BSP、Runx2及Col- 1 mRNA的表达明显高于i- hPDLSCs组(P<0.05)(图6)。
2.6 两种干细胞成脂能力比较
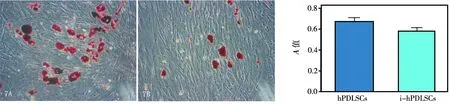
两种细胞诱导10 d左右,观察发现细胞形态较培养初期饱满,出现小脂肪滴,随着培养继续,脂肪滴逐渐增大并连接成片。培养21 d行油红O染色,镜下观察发现两者均有脂肪滴形成,并且hPDLSCs组脂肪滴形成面积较i- hPDLSCs组大。异丙醇溶解后比较两种细胞脂肪滴形成量,结果显示
两组细胞的成脂分化能力无统计学差异(P>0.05)(图7)。
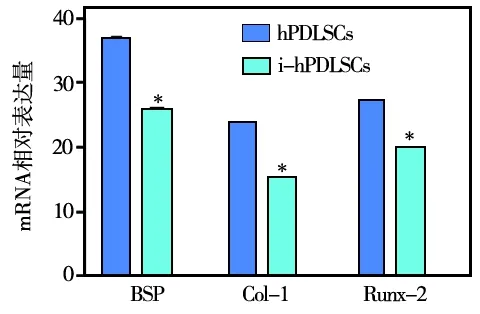
(*与hPDLSCs组相比P<0.05)
hPDLSCs i- hPDLSCs
图7 两种细胞成脂诱导21 d(倒置相差显微镜,×200)
两种细胞成脂诱导14 d时,收集样本,Real-time PCR 检测成脂相关基因LPL及PPAR γ mRNA表达水平,成脂相关基因在hPDLSCs中的表达高于i- hPDLSCs,但无统计学差异(P>0.05)(图8)。
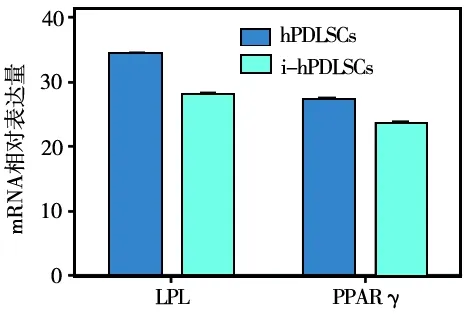
图8 两种细胞成脂相关基因的表达水平比较
3 讨论
牙周病是一类常见的口腔疾病,其主要原因是细菌侵犯牙槽骨、牙周膜和牙骨质等牙周支持组织,如未及时治疗,最终将导致牙齿松动甚至脱落[5]。现阶段牙周病的治疗方法主要有洁治术、翻瓣术以及引导性组织再生术等。近年来,再生医学与组织工程技术的研究取得突飞猛进的发展,给牙周再生带来新的机遇和挑战,牙周组织再生技术的发展也进入了一个新时期。组织工程需要具备三大要素:种子细胞、支架材料及信号分子。近年来发现的成体干细胞是组织工程理想的种子细胞,现已在机体许多成熟组织器官中发现成体干细胞。目前常用的牙周组织工程种子细胞主要包括牙周膜细胞(periodontal ligament cells, PDLCs) 、骨髓基质细胞( bone marrow stromal cells, BMSCs)和脂肪基质细胞( adipose tissue derived stromal cells, ADSCs) 。其中对牙周膜细胞的研究目前较为深入,越来越多的证据表明PDLCs具有良好的牙周组织再生潜能[6]。施松涛等[7]在人牙周组织中发现了PDLSCs ,并发现其在一定条件下可以分化形成成骨细胞、成牙骨质细胞和脂肪细胞,但PDLSCs数量有限,较难用于大面积缺损的修复。而且现在临床转化医学中常用的PDLSCs多为患者因阻生而拔除的第三磨牙或正畸牙,这就限制了其来源,并且由于此种方法取材有创,不易被患者接受。因此寻求来源广泛、易获得的干细胞成为牙周再生的首要问题。近期Park等[4]从炎症性牙周组织中提取出hPDLSCs,并证实其保留了成牙骨质及成牙周膜的能力。该i- hPDLSCs是否可以用来进行牙周再生治疗成为广大学者关注的焦点。陆续有学者将其与正常组织来源hPDLSCs进行了比较[8],然而,Zhang等[9]发现, hPDLSCs扩增、迁移及分化能力均随年龄增长而降低。为尽可能地降低各种影响因素,本实验提取同一患者PDLSCs与i- hPDLSCs分别进行分离培养及鉴定,并对两者的生物学性能进行了比较。
口腔本身是一个污染的环境,取材很容易受到污染,炎性组织中混有细菌等污染源,增加了细胞分离的难度;另外患者本身的个体差异也会对细胞的成功分离造成影响。我们在取材前对患牙进行洁治,尽量去除牙石等污染源;实验中用含双抗的PBS对所取组织进行反复冲洗,尽量降低细菌等污染源的影响。本实验共取材11例,其中i- hPDLSCs培养成功7例,hPDLSCs培养成功10例,共同培养成功5例。将成功培养的同一患者来源i- hPDLSCs 和hPDLSCs进行了增殖及分化能力的比较,发现i- hPDLSCs具有较强的增殖能力,但其分化能力不及hPDLSCs,可能是由于炎症微环境的刺激引起细胞发生了相应的改变。两种干细胞对干细胞标志物CD146、CD105、CD90均呈阳性表达,而对造血系标志物CD45及内皮系标志物CD31均不表达,表明两种干细胞对阳性标志物的表达率并无统计学差异。通过体外克隆形成率的比较,i- hPDLSCs的克隆形成能力要高于hPDLSCs,说明其克隆增殖能力要强。在体外诱导环境下,i- hPDLSCs的成骨能力要弱于hPDLSCs,两者成脂能力无统计学差异。本实验结果表明:①i- hPDLSCs 和hPDLSCs的生物学性能具有一定的差异,i- hPDLSCs能否和hPDLSCs一样具有良好的牙周组织形成能力,并且作为牙周组织工程的候选种子细胞,需要进一步深入研究;②本实验所用样本为同一个体所提取的hPDLSCs,两者生物学性能具有一定差异,表明炎性微环境刺激对hPDLSCs有一定的影响,提示我们牙周炎症可能与表观遗传具有相关性。
本结果显示,在同一患者口腔内不同环境所分离获得的细胞,其生物学性能有所改变,与先前报道一致[10],由于本实验所选两种细胞来自同一患者,患牙仅是所处环境不同,所以本实验更有力的证实了炎性微环境对于细胞的生物学特性有一定影响。另有研究表明,慢性炎症的存在和细菌的感染都可能引起DNA甲基化的改变[11]。由此提醒我们,细胞生物学性能的改变,可能与表观遗传也有一定的关系。表观遗传学是指研究有丝分裂以及在某些情况下减数可遗传的表型变化,可以严格规范的特异性表达基因信息而不改变DNA序列[12]。表观遗传学建立在有预见性和妊娠期的水平上。事实上,在配子形成和妊娠时父方和母方暴露的环境因素均可能对于后代的表观遗传基因产生影响[13]。另一方面,在生命的早期阶段,继承了的表观遗传状态几经变化,以确保正常的细胞发育和分化过程。环境刺激或随机错误等因素均能够诱导表观遗传配置在生命早期和晚期阶段发生变化,而这些变化大多数情况下可以负责如发育、分化、应激反应和病理条件等过程在寿命期间发生[14]。在尽可能地排除体内及体外影响因素的情况下,同卵双生的双胞胎成为研究表观遗传现象的一个经典模型——具有完全相同基因的2个人,在相同或相似的生长环境中长大后,性格以及疾病易感性等方面仍会有较大的差异[15]。在对双胞胎牙周疾病的研究中,学者们发现其牙周病的表型往往有所不同。Torres等[16]发现,同卵双胞胎的牙周病表型如附着丧失、牙槽骨吸收程度等均不一致,且随年龄增长, 双胞胎的牙周表型差异性越大,此项研究是在排除了教育程度、吸烟、病原菌等因素的影响后进行的。由此提示,牙周病与表观遗传两者相互影响,牙周炎的发生及细菌的存在可引起表观遗传的改变,表观遗传修饰可能参与了牙周病相关基因表达的调控。而对于牙周病与表观遗传的相关研究现在仍处于初期阶段,需进一步探索。
[1]Akizuki T, Oda S, Komaki M,etal. Application of periodontal ligament cell sheet for periodontal regeneration: a pilot study in beagle dogs [J].JPeriodontalRes, 2005,40(3):245-251.
[2]陈发明,金岩,施松涛,等. 转化医学:十年回顾与展望[J]. 实用口腔医学杂志, 2011,27(1):5-11.
[3]Feng F, Akiyama K, Liu Y,etal. Utility of PDL progenitors for in vivo tissue regeneration: a report of 3 cases [J].OralDis, 2010,16(1):20-28.
[4]Park JC, Kim JM, Jung IH,etal. Isolation and characterization of human periodontal ligament (PDL) stem cells (PDLSCs) from the inflamed PDL tissue: in vitro and in vivo evaluations [J].JClinPeriodontol, 2011,38(8):721-731.
[5]Chen FM, Sun HH, Lu H,etal. Stem cell- delivery therapeutics for periodontal tissue regeneration [J].Biomaterials, 2012,33(27):6320-6344.
[6]Gronthos S, Mrozik K, Shi S,etal. Ovine periodontal ligament stem cells: isolation, characterization, and differentiation potential [J].CalcifTissueInt, 2006,79(5):310-317.
[7]Seo BM, Miura M, Gronthos S,etal. Investigation of multipotent postnatal stem cells from human periodontal ligament [J].Lancet, 2004,364(9429):149-155.
[8]谈珺. 人牙周炎症组织中干/祖细胞的体外分离、纯化及初步鉴定[D]. 西安:第四军医大学, 2011-04-01.
[9]Zhang J, An Y, Gao LN,etal. The effect of aging on the pluripotential capacity and regenerative potential of human periodontal ligament stem cells [J].Biomaterials, 2012,33(29):6974-6986.
[10]刘亚丽,刘文佳,胡成虎,等. 牙周慢性炎症对牙周膜干细胞生物学特性的影响 [J]. 牙体牙髓牙周病学杂志, 2014,24(1):21-25.
[11]Stenvinkel P, Karimi M, Johansson S,etal. Impact of inflammation on epigenetic DNA methylation a novel risk factor for cardiovascular disease? [J].JInternMed, 2007,261(5):488-499.
[12]Waddington CH. The epigenotype. 1942 [J].IntJEpidemiol, 2012,41(1):10-13.
[13]Puri D, Dhawan J, Mishra RK. The paternal hidden agenda: Epigenetic inheritance through sperm chromatin [J].Epigenetics, 2010,5(5):386-391.
[14]Cedar H, Bergman Y. Programming of DNA methylation patterns [J].AnnuRevBiochem, 2012,81:97-117.
[15]Fraga MF, Ballestar E, Paz MF,etal. Epigenetic differences arise during the lifetime of monozygotic twins [J].ProcNatlAcadSciUSA, 2005,102(30):10604-10609.
[16]Torres DHG, Loos BG, van der Velden U. Monozygotic twins are discordant for chronic periodontitis: clinical and bacteriological findings [J].JClinPeriodontol, 2010,37(2):120-128.
Comparasion of the biological characteristics of normal and inflammatory periodontal ligament stem cells from the same donor
ZHANG Lin- lin*, BI Chun- sheng, CHEN Fa- ming, JIN Yan
(*StateKeyLaboratoryofMilitaryStomatology,DepartmentofPeriodontology,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi′an710032,China)
AIM: To compare the biological characteristics of inflammatory periodontal ligament stem cells (i- hPDLSCs) and healthy periodontal ligament stem cells ( hPDLSCs) from the same donor.METHODS: i- hPDLSCs and hPDLSCs were isolated from the same donor.Their colony-forming ability,proliferative capacity, cell surface antigens and differentiation ability were evaluated and quantified for statistical analysis.RESULTS: Both stem cells have highly proliferative and differentiative potential.i- hPDLSCs had a significantly higher rate of successive culture and proliferation than hPDLSCs(P<0.05). hPDLSCs had a higher rate of cell osteogenic differentiation than i- hPDLSCs (P<0.05). The adipogenic potential of i- hPDLSCs and hPDLSCs showed no statistical difference.CONCLUSION: Inflammatory environment influences the biological properties of periodontal ligment stem cells.
periodontal ligament stem cells (hPDLSCs); inflammatory periodontal ligament stem cells ( i- hPDLSCs); proliferation; differentiation
2014-07-17
国家自然科学基金(31170912)
张琳琳(1985-),女,汉族,临沂人。硕士生(导师:陈发明、金岩)
陈发明, E-mail: cfmsunhh@fmmu.edu.cn
金 岩, E-mail: yanjin@fmmu.edu.cn
R781.4
A
1005-2593(2015)01-0001-07
教育部新世纪优秀人才支持计划(NCET-12-1005)

