miR-3077-5P对3T3-L1前脂肪细胞成脂分化能力的影响
杨晓红,杨 琨,廖 立,金 岩
(1.遵义医学院附属口腔医院 口腔修复科,贵州 遵义 563099;2.遵义医学院附属口腔医院 牙周科,贵州 遵义 563099;3.第四军医大学口腔医院 组织工程研究中心,陕西 西安 710032)
微小 RNA(microRNA,miRNA)是一类高度保守的、广泛存在于细胞中的单链、非编码小 RNA,一般含有 22~24个核苷酸[1]。通过在转录后水平与靶基因 mRNA 的 3' 非翻译区(untranslated region,UTR)互补结合抑制基因表达[2],是基因表达的重要调控手段,参与多种疾病的发生发展[3]。最新研究表明,miRNA广泛参与了干细胞的增殖、凋亡、分化、代谢等过程的调控,在其中发挥关键作用[4]。 近年来研究发现miR-27a、miR-130、miR-378和miR-138在干细胞成脂分化过程中起着关键的作用[5]。我们在前期实验中发现绝经后骨质疏松小鼠的骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)中的miR-3077-5P异常升高[6],证实了miR-3077-5P参与了BMMSC成脂分化能力的调控。近年来有学者报道,通过体内调控干细胞miRNA的表达,可以有效的提高病理状态下组织损伤的修复能力,直接治疗疾病[7],这些开拓性研究提示miRNA可以作为治疗疾病新靶点思路,假设miR-3077-5P对脂肪前体细胞成脂分化调控具有相似的调控功能,这为miR-3077-5P作为新靶点药物治疗的研发和治疗脂肪分化异常引起的疾病(如骨质疏松、肥胖)提供理论依据。本实验拟通过过表达和下调表达3T3-L1前脂肪细胞中miR-3077-5P,检测过表达和下调表达miR-3077-5P对3T3-L1前脂肪细胞在成脂分化诱导过程中成脂能力的差异,从而探讨miR-3077-5P对3T3-L1前脂肪细胞的成脂分化过程的调控作用。
1 材料与方法
1.1 材料与试剂 α-MEM培养基购自美国Gibco公司;优级胎牛血清购自杭州四季青生物工程材料有限公司;细胞总RNA提取试剂盒、一步法RT-PCR试剂盒购自日本TaKaRa公司;油红O购自上海化学试剂采购供应站;IP细胞裂解液、BCA蛋白定量试剂盒购自美国Beyotime公司;miR-3077-5P control、miR-3077-5P mimics、miR-3077-5P inhibitor和内参U6购自广州市锐博生物科技有限公司;siPORTTMNeoFXTM转染试剂购自美国Ambion公司;3T3-L1前脂肪细胞购自上海中科院细胞库;β-actin鼠单克隆抗体、抗小鼠过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)、脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)、三羊抗小鼠IgG购自美国Abcam有限公司; LPL和PPAR-γ 引物 (TaKaRa,日本)。
1.2 主要仪器设备 Real time定量PCR仪(Bio-Rad,美国);酶标仪(Bio-tek,美国);凝胶成像分析系统(天能,上海);电泳仪(Bio-Rad,美国)。
1.3 3T3-L1前脂肪细胞培养及miR-3077-5P转染 以1×104个/cm2密度接种3T3-L1细胞,用含10% FBS的α-MEM培养基培养,于37 ℃、5% CO2的孵箱中培养,2~3 d换液一次,待细胞融合90%,用0.25%胰蛋白酶消化获得细胞,用于后续实验。
于转染前一天将3T3-L1前脂肪细胞更换为无血清的培养液,用无双抗的培养液将细胞消化后制备成单细胞悬液,计数后置37 ℃孵育备用。细胞分为3组,分别为control组、mimics组及inhibitor组。转染时先稀释siPORTTMNeoFXTM转染试剂(24孔板用量),每孔用量为20 μL培养液(无血清无双抗)+5 μL转染试剂,室温静置10 min;再稀释需要转染miRNA:miRNA 1.5 μL(10 μmol/L)+ 20 μL培养基(无血清无双抗),室温静置10 min。将稀释后的转染试剂和miRNA轻轻混匀,室温静置10 min后移至24 孔板。将制备好的细胞悬液以每孔450 μL(4×104)接种于准备好的培养孔中,轻轻晃动培养板使细胞与转染试剂充分接触。置37℃孵箱培养,12 h更换完全培养基,72 h后收集细胞,行转染成功与否鉴定。其方法是用总RNA提取试剂盒,一步法提取细胞总RNA,并按照Bulge-Loop miRNA 实时qRT-PCR Primer(广州市锐博生物科技有限公司)说明书进行实时定量PCR检测上述3T3-L1前脂肪细胞中miR-3077-5P的表达量,miR-3077-5P的引物序列均由广州锐博生物有限公司合成:miR-3077-5P(Product ID:miRQ0003495-1-2)和 U6(Product ID:MQP-0202)。实验重复3次。
1.4 油红O染色检测脂滴形成及定量分析 将转染了miR-3077-5P mimics、miR-3077-5P inhibitor、miR-3077-5P control的3T3-L1前脂肪细胞加入成脂诱导液(10%FBS 的α-MEM基础培养基,0.01μM 地塞米松,0.5 mM 3-异丁基-1-甲基黄嘌呤,60 μM吲哚美辛,2 mM胰岛素)诱导培养10d后,用油红O对各组细胞进行染色观察脂滴形成;将异丙醇加入已染上色的油小滴样本中10 min,收集溶解液,酶标仪检测溶解液的OD值(波长520 mm),进行定量分析。
1.5 RT-PCR检测PPAR-γ、LPL mRNA表达 3组3T3-L1前脂肪细胞成脂诱导培养10 d后进行细胞收集,按TRIzol说明书抽提各组细胞总RNA,并用反转录试剂盒合成cDNA。参照GenBank数据库,以Primer primer 5.0计算机软件设计引物;以β-actin为内参照,采用RT-PCR检测,反应体系为:premix 10 μL、dye 0.4 μL、ddH2O 6.6 μL、上下游引物各0.5 μL、样本模板2 μL;其定量计算方法:RNA样品的浓度(ng/μL)=RNAOD值×稀释倍数×40;反应条件:95 ℃ 5 min ,94 ℃ 30 s,65 ℃ 30 s ,40个循环;实验重复3次,所用引物均由TaKaRa公司合成,各引物基因序列见表1。
表1引物基因序列

基因引物序列PPAR-γF-ACTGCCGGATCCACAAAAR-TCTCCTTCTCGGCCTGTGLPLF-CCCCAGTCGCCTTTCTCCTGATR-CTCTTGGCTCTGACCTTGTTGATβ-actinF-CTGGCACCACACCTTCTACAR-GGTACGACCAGAGGCATACA
1.6 蛋白质印迹法检测PPAR-γ及FABP4蛋白表达 取成脂诱导10 d后的各组细胞,用碧云天Western及IP细胞裂解液进行总蛋白提取;严格按照BCA蛋白定量试剂盒标准步骤进行蛋白定量测定;加入蛋白样品20~30 μL后,进行SDS-PAGE电泳:80V40 min,120V90 min(电泳缓冲液液配置:H2O 1L;Tris 3.03 g;甘氨酸14.4 g;SDS 1g);采用硝酸纤维素膜,200 mA转膜90 min;10%小牛血清白蛋白37 ℃封闭2 h,封闭β-actin(稀释度1∶10 000)和 PPAR-γ、FABP4(稀释度1∶10 00)的抗体并4 ℃孵育过夜,洗膜液清洗10 min,3次;加入三羊抗小鼠IgG(稀释度1∶50 000),室温孵育2 h;最后进行化学发光反应检测各组PPAR-γ和FABP4蛋白的表达。

2 结果
2.1 3T3-L1前脂肪细胞成功转染miR-3077-5P miR-3077-5P mimics组、control组和inhibitor组miR-3077-5P的表达水平分别为40.90±0.03、1.00±0.04和0.18±0.02,转染72 h后,mimics组中miR-3077-5P的表达量较control组上调约48倍,inhibitor组中miR-3077-5P的表达量较对照物组下调了69%(见图1)。提示通过转染特异性mimics或inhibitor能有效调控3T3-L1前脂肪细胞中miR-3077-5P的表达水平,并且在短时间内稳定表达。

*:vs control,P<0.05;**:vs control,P<0.01;n=3。图1 化学合成miR-3077-5P mimics和inhibitor对miR-3077-5P表达水平的影响
2.2 3组3T3-L1前脂肪细胞脂滴形成及定量分析 镜下可见细胞由诱导前梭形变为椭圆形,胞浆内出现一至数个大小不等、折光性强、圆形透亮脂肪滴,脂滴呈串珠状排列、细胞核被脂滴挤压于细胞一侧。与control组比较,mimics组油红染色较深,胞浆内脂滴体积较大、脂滴数目较多,inhibitor组着色细胞数量极少,细胞胞浆染色较浅及胞浆脂滴小而少(见图2),油红O定量显示mimics组所形成的脂滴数量明显高于inhibitor组,两组间有显著差异性(P<0.001)(见图3)。脂滴染色及定量检测表明 mimics组细胞成脂能力较强。

Control mimics inhibitor图2 3T3-L1前脂肪细胞成脂诱导10 d油红O染色
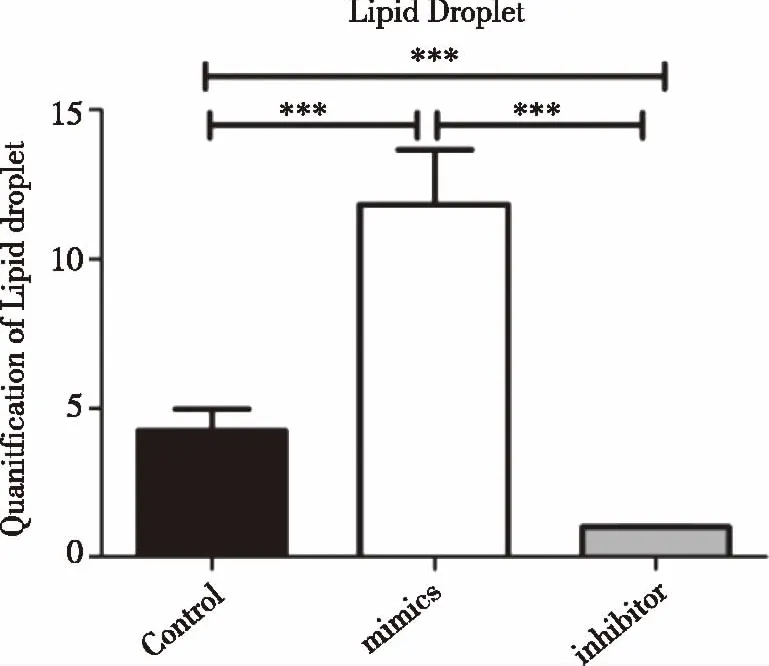
***:vs control,P<0.001 ;n=3。图3 3T3-L1前脂肪细胞成脂诱导10 d油红O染色脂滴定量检测
2.3 3组3T3-L1前脂肪细胞成脂基因 PPAR-γ、LPL mRNA表达比较 与control组比较,mimics组PPAR-γ成脂基因的mRNA表达量明显升高,而inhibitor组其表达水平明显降低,3组间差异具有统计学意义(P均<0.001)(见图4A)。3组细胞中LPL成脂基因的mRNA表达与PPAR-γ结果相似,其在mimics组表达量最高,3组间差异具有统计学意义(P均<0.001)(见图4B),以上基因检测表明miR-3077-5P表达量升高时,3T3-L1前脂肪细胞成脂能力较强,这提示miR-3077-5P对3T3-L1前脂肪细胞成脂诱导过程具有促进作用。

A:PPAR-γ的mRNA水平;B:LPL 的mRNA 水平。 ***:vs control,P < 0.001 ;n=3。图4 3T3-L1前脂肪细胞成脂诱导10 d成脂基因PPAR-γ的mRNA表达水平
2.4 3组3T3-L1前脂肪细胞PPAR-γ和FABP4蛋白表达比较 mimics组PPAR-γ和FABP4蛋白水平显著高于inhibitor组,3组间差异具有统计学意义(P均<0.05)(见图5),进一步证实了在3T3-L1前脂肪细胞成脂诱导过程中miR-3077-5P对其具有促进作用。
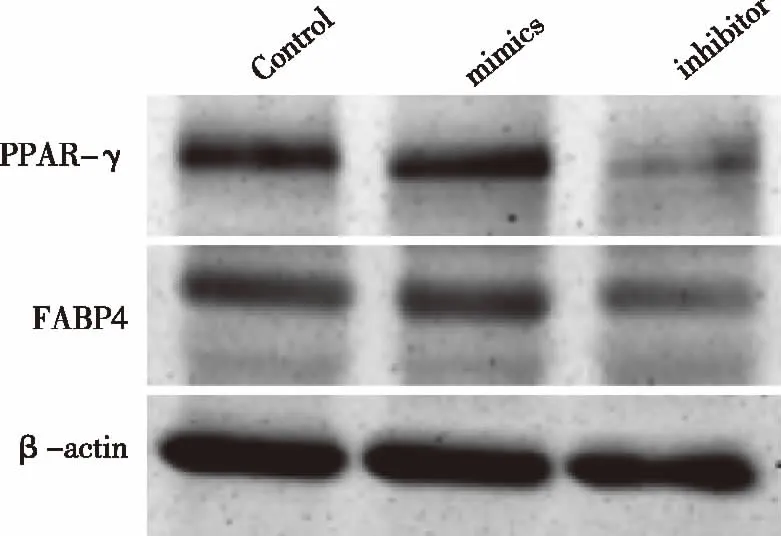
图5 3T3-L1前脂肪细胞成脂诱导10 d后PPAR-γ和FABP4的蛋白表达水平
3 讨论
干细胞具有多向分化能力,当成脂诱导后细胞胞浆内有脂滴形成和高表达PPAR-γ、LPL、FABP4等调节脂肪形成的相关蛋白。其中脂滴的形成是脂肪细胞的特征表现[8],细胞内脂滴体积的大小和数量多少是细胞成脂分化能力大小及成熟度的量化指标[9,14]。本实验通过油红0染色和定量分析,结果显示,转染了miR-3077-5P mimcs和miR-3077-5P inhibitor的3T3-L1前脂肪细胞,经成脂诱导10 d,其mimics 组比inhibitor组细胞胞浆内着色深、脂滴数目多、脂滴较大。这表明两组细胞都已经向成脂方向分化为脂肪细胞,且mimics组成脂分化能力较强。
PPAR-γ是核受体超家族成员之一,是调控干细胞向成脂细胞分化过程中的一种特异性转录因子[9],对LPL、FABP4成脂基因都具有重要的调控作用,因此是成脂分化过程的中心调控因子[11]。它在脂肪细胞成熟过程中发挥重要作用,调控脂肪细胞分化速度和脂滴的形成,是成脂的标志性基因[12]。LPL和FABP4是反映成脂分化能力的关键指标[13],FABP4又是成熟脂肪细胞胞质的重要蛋白[14-15]。本实验通过 RT-PCR检测结果显示, mimcs组的3T3-L1前脂肪细胞细胞中PPAR-γ和LPL的表达量较对照组和ihibitor组高。这表明mimcs组的3T3-L1前脂肪细胞成脂分化能力最高及3T3-L1前脂肪细胞的成脂能力大小与miR-3077-5P在其细胞内表达量密切相关,miR-3077-5P在3T3-L1前脂肪细胞内表达量越高,其成脂能力越强。提示miR-3077-5P在基因水平上对3T3-L1前脂肪细胞成脂分化起着促进作用。
为了进一步证实miR-3077-5P对3T3-L1前脂肪细胞成脂分化具有促进作用,同时我们从蛋白水平上检测了各组细胞中的成脂关键基因PPAR-γ和FABP4的表达量,结果显示,PPAR-γ和FABP4的蛋白表达结果与PPAR-γ 和LPL 的mRNA表达趋势一致。以上结果从基因水平和蛋白水平均证明了miR-3077-5P在 3T3-L1前脂肪细胞株成脂分化具有成脂分化的促进功能作用。
综上所述,虽然我们发现了miR-3077-5P在 3T3-L1前脂肪细胞株成脂分化过程中具有成脂分化的促进用,但miR-3077-5P在翻译后水平通过调控何种转录因子发挥其作用待进一步研究。同时我们对miR-3077-5P研究结果均是体外研究结果,其在体内是否亦能够通过miR-3077-5P介导进行相关疾病机制及治疗的研究是后续研究工作的重要内容。

