微沟槽形貌对人牙龈成纤维细胞整联蛋白intergrin α5、β1表达的影响
赖颖真, 林 珊, 陈 江
(1. 厦门医学高等专科学校口腔医学系, 福建 厦门 361000;2. 福建医科大学附属第一医院口腔科, 福建 福州 350000);3. 福建医科大学附属口腔医院种植科, 福建 福州 350002)
微沟槽形貌对人牙龈成纤维细胞整联蛋白intergrin α5、β1表达的影响
赖颖真1, 林 珊2, 陈 江3
(1. 厦门医学高等专科学校口腔医学系, 福建 厦门 361000;2. 福建医科大学附属第一医院口腔科, 福建 福州 350000);3. 福建医科大学附属口腔医院种植科, 福建 福州 350002)
目的: 研究微沟槽形貌对人牙龈成纤维细胞(HGF)整联蛋白intergrin α5、integrn β1表达的影响。方法: 用光刻技术制作沟槽宽度分别为15、30、60 μm,沟槽深度分别为5、10 μm(沟槽间隔分别等于各相应宽度)的微沟槽形貌,分别命名为T15/5、T15/10、T30/5、T30/10、T60/5、T60/10,光滑钛(T0)表面作为对照组;分别测量各组材料表面的微沟槽形貌及亲水性,用Real time- PCR和Western blotting 检测HGF在各组材料表面培养3 d时的intergrin α5和β1mRNA及蛋白的表达水平。结果: T60/5表面亲水性最好, T15/10疏水性最大并明显大于光滑组T0(P<0.05); intergrin α5mRNA表达水平以T60/10组最高,而T15/10时最低,各组间两两相比P<0.05;沟槽宽度较小时(T15、T30),若深度增加则可减少intergrin α5mRNA的表达,而沟槽宽度较大时(T60),若深度增加则可促进intergrin α5mRNA的表达;intergrin β1mRNA的表达水平以T60/10组最高,与其他各组相比P<0.05;其余3组间比较均P>0.05,intergrin α5、 intergrin β1蛋白的表达趋势与其mRNA的表达基本一致。结论: intergrin α5和β1表达随着沟槽宽度增大而增加,深度对intergrin α5表达的影响与沟槽的宽度大小相关,沟槽宽度和深度对intergrin β1表达的影响程度低于intergrin α5。
种植体; 微沟槽; 人牙龈成纤维细胞; 整联蛋白
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.01.002
[Chinese Journal of Conservative Dentistry,2015,25(1):8]
为了防止牙种植体软组织周围细胞根方迁移,本实验拟对种植体穿龈部分材料表面进行沟槽化的设计,以诱导种植体周围软组织细胞能垂直于种植体长轴的沟槽生长,使之有利于建立良好的种植体软组织愈合[1]。Lai等[2]针对牙龈成纤维细胞的大小设计不同宽度和深度的沟槽表面,经研究证明,不同尺寸的沟槽形貌均能够成功诱导细胞顺着沟槽生长[2]。有研究报道,细胞粘附于材料表面主要依靠粘着斑附着( FAs )[3]。FAs是将细胞锚定在材料表面的结构,可作为一个跨膜装置将肌动蛋白纤维与细胞外基质相连;典型的FAs结构由跨膜蛋白-整联蛋白(intergrin α5、β1)构成,其胞外段与细胞外基质-纤维连接蛋白(Fibronectin)实现受配体的结合,并最终构成一个细胞外基质-intergrin-细胞骨架跨膜系统[4]。由于细胞附着的好坏与intergrin α5、β1蛋白的表达密切相关,故本实验通过观察不同尺寸微沟槽对人牙龈成纤维细胞(Human gingival fibroblasts,HGF) 表达intergrin α5、β1的影响,以期为选择合适的种植体穿龈部分的沟槽尺寸提供参考。
1 材料和方法
1.1 主要材料和设备
1.1.1 微沟槽制备材料及其检测设备
4英寸的硅片、腐蚀液(3HF ∶6NH4F ∶10H2O)、光刻胶、清洗液(4H2SO4+H202,NH4OH +H2O2+5H2O,HNO3+ H2O2+5H2O)、氧化4470四管微控制扩散系统、Karlsuss MA6/BA6光刻键合对准机、双管等离子体去胶机-DQ-500、JS- 3X-100B 磁控溅射台、环境扫描电镜(XL30 ESEM- TMP)、视频光学接触角测量仪OCA20(dataphysics,德国) 。
1.1.2 细胞培养、基因和蛋白检测材料及设备
胎牛血清(FBS)(HyClon,美国);DMEM低糖培养液、2.5 g/L胰蛋白酶(Gibco,美国); Trizol reagent (Invitrogen); PrimeScript® RT reagent Kit逆转录试剂盒(DRR037A)、SYBR® Premix Ex TaqTMII PCR试剂盒(Tli RNaseH Plus Code:DRR820A)、RNA酶抑制剂(TaKaRa); NanoDrop 2000( Thermo); ABI 7500 real- time PCR cycler (Applied Biosystems); RIPA buffer (P0013B)、BCA蛋白定量试剂盒(P0012)(碧云天);Halt Protease Inhibitor Cocktail (Thermo, 美国);Integrin α5Antibody (1 ∶1 000, #4705, Cellsignaling)、Integrin β1Antibody (1 ∶1 000, #4706, Cellsignaling)、Anti- GAPDH (1 ∶20 000, G8795)、Anti- Mouse IgG- Peroxidase antibody(1 ∶80 000, A2304)(Sigma);Minigel system、SDS- PAGE脱色摇床、Western blotting transfer apparatus (BIO- RAD,美国)。
1.2 微沟槽表面样本的制备
参照文献[2]报道的方法,采用光刻技术在4英寸的硅片上制备不同宽度和深度的沟槽:首先用掩膜板在硅片上确定出沟槽的间距,并使之分别为15、30、60 μm;然后再在每一种沟槽间距的硅片上,按图1a所示的步骤制备出宽度与该硅片预设沟槽间距相等的沟槽,并通过蚀刻时间控制使每一种宽度沟槽的深度分别为5 μm和10 μm;经检测确定各沟槽剖面均为倒梯形,沟槽侧壁与顶部交角均为54.74°(图1b)后,分别在各材料表面溅射200 nm Ti,并根据沟槽的宽度和深度,分组命名为:T15/5、T15/10、T30/5、T30/10、T60/5、T60/10;另设光滑钛表面作为对照,并命名为T0。上述制备完成的所有样本分别经丙酮超声清洗3 min、无水乙醇浸泡2 h后,灭菌纯净水冲洗2次,并放置于超净台内紫外光照射消毒30 min备用。
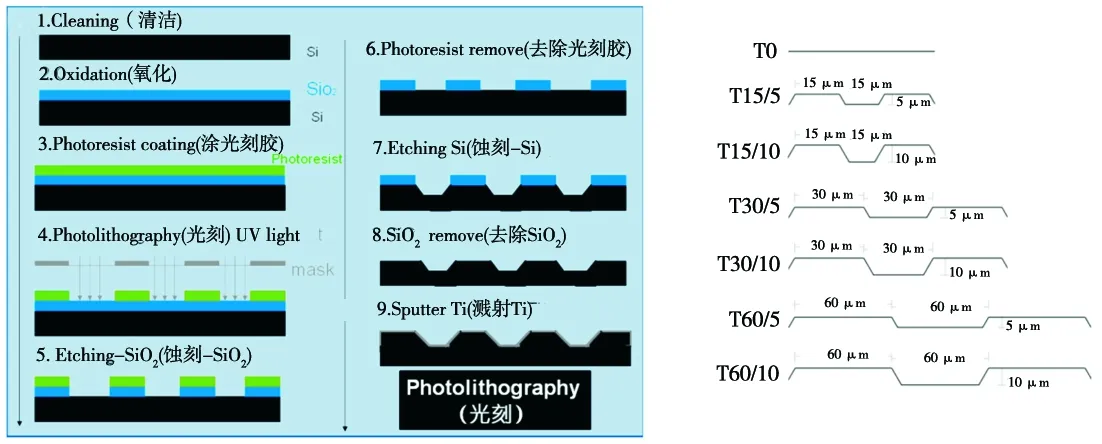
a. 光刻步骤示意图 b. 各组材料表面示意图
图1 材料制作和形貌示意图
1.3 各向异性微沟槽的形貌表征观察
采用环境扫描电镜(ESEM),在放大1 000倍条件下观察各组样本表面微沟槽的正面和侧面形貌;同时测量微沟槽的深度和宽度[2]。
1.4 各组样本表面的亲水性测量
每组各取7个样本,分别在其表面的不同部位各滴1 μL蒸馏水,并使液滴的初始方向垂直于沟槽的方向;然后采用OCA20视频光学接触角测量仪分别检测10 s内1 μL蒸馏水在各样本表面的接触角,用以评价各样本表面的亲水性。每个样本的不同位置各检测2次,取平均值[2]。
1.5 微沟槽形貌对HGF 表达intergrin α5、β1影响的观察
1.5.1 HGF 体外培养和分组处理
参照文献[2]报道的方法体外原代培养HGF,常规传代后取第6代细胞以3×105/孔的密度接种于置有各组样本片的6孔板,并于每孔中各加入3 mL DMEM低糖培养液,常规条件下进行培养。连续培养3 d后,分别进行以下检测。
1.5.2 PT- PCR检测intergrin α5、β1mRNA表达
取上述培养3 d后的各组样本片(每组材料各6孔),分别转移到新的6孔板后用1 mL Trizol收集细胞并提取细胞总RNA;用NanoDrop 2000检测各组RNA 260/280波长的吸光度值以确定其浓度(ng/μL)后,分别将各RNA逆转录为cDNA。然后以cDNA为模板,β- actin为内参照进行Real- time PCR反应,反应体系和反应条件均严格按试剂盒说明;所用引物TAKARA由大连宝生物合成,各目的基因引物序列见表1。实验重复3次(每次每组各2个复孔),所得结果用ABI7500 Software V 2.0.1.软件导出各组Ct值,并采用2-ΔΔCt法计算intergrin α5、β1mRNA 的相对表达量。

表1 各蛋白相对应的引物序列
1.5.3 Western blotting检测intergrin α5、β1蛋白的表达
取上述培养3 d后的各组样本片(每组各6孔)并分别转移到新的6孔板,PBS冲洗1次后,每孔加入1 mL Acctuse 37 ℃消化3 min;加入培养液终止消化并反复吹打使材料片上的细胞尽可能完全脱离后,收集各组细胞并转移到离心管中离心去上清。分别在每个离心管中各加入200 μL含磷酸酶抑制剂的裂解液,用BCA法测定蛋白浓度后,进行SDS- PAGE蛋白电泳并转膜;然后分别滴加一抗integrin α5Antibody、integrin β1Antibody以及内参抗体Anti- GAPDH并孵育2 h;滴加二抗Anti-Mouse IgG- Peroxidase antibody孵育1 h后,ECL显色、曝光、定影、显影,最后用凝胶灰度分析软件Quantity One 4.6.2进行灰度值定量分析。
1.6 统计学分析
2 结果
2.1 各向异性微沟槽的形貌表征
SEM观察显示,不同宽度和深度的微沟槽表面均呈现规则的各向异性排列走向(图2), 经测量各组沟槽的宽度、间隔和深度、表面尺寸均符合原始设计尺寸要求[2]。
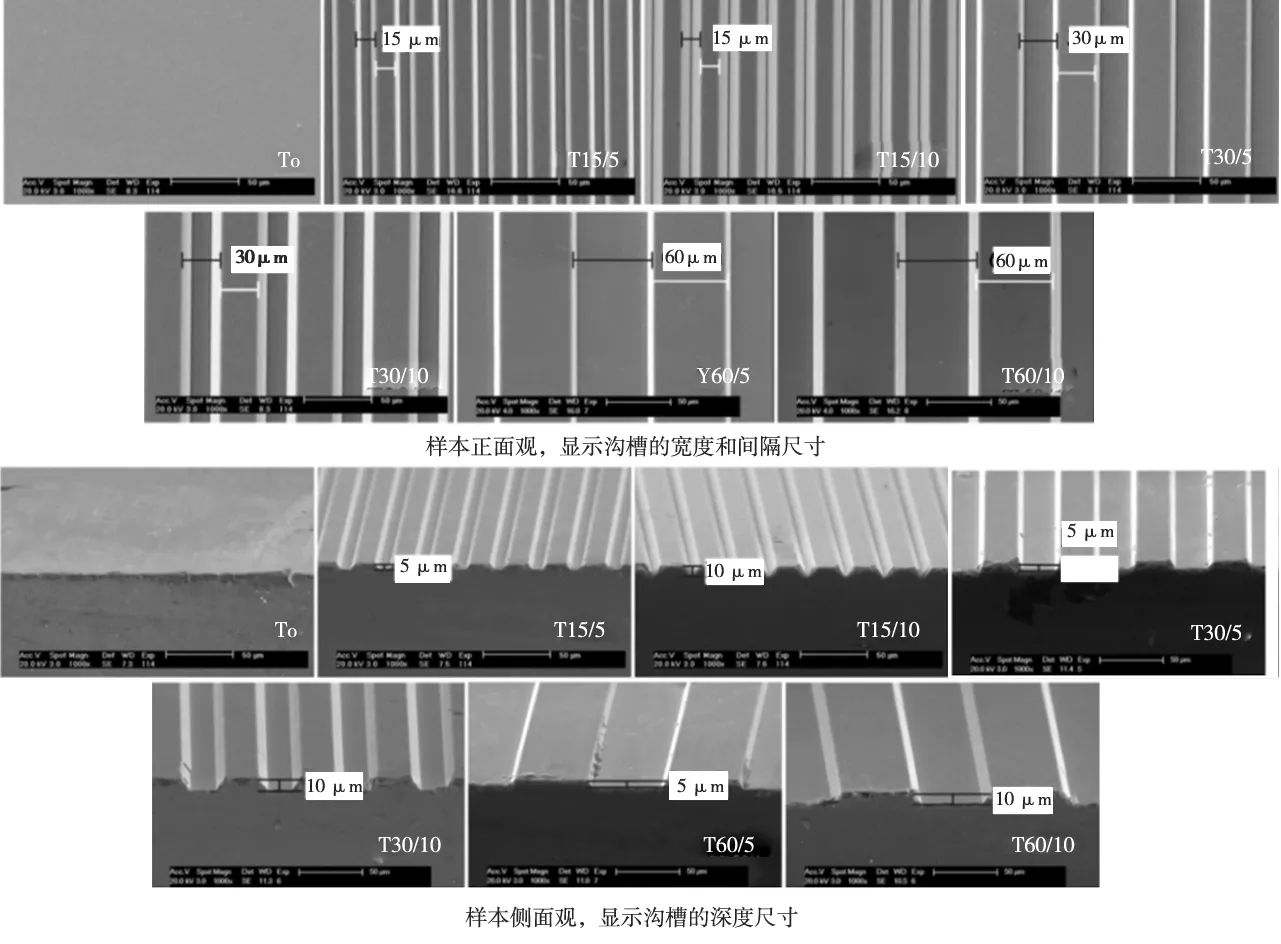
图2 样本表面形貌SEM观察(1 000×)
2.2 各组亲水性和接触角比较
各组材料表面的亲水性测试见图3a,统计结果显示:T60组的接触角均明显小于其他宽度的微沟槽表面(P<0.05);其中以T60/5组的接触角最小(约25.09°),亲水性最好,T15/10组的接触角最大(106.66°),疏水性最强,甚至大于光滑组T0(97.36°);在相同宽度下T60/10、T30/10、T15/10的接触角分别大于T60/5、T30/5、T15/5,差异均有统计学意义(P<0.005)(图3b)。提示随着沟槽宽度变窄和深度增加,其材料表面的疏水性也显著增大。
2.3 不同微沟槽对HGF表达intergrin α5、β1mRNA的影响
各组intergrin α5mRNA检测结果见图4a,其表达水平随着沟槽宽度的增加而增大,其中以T60组的表达水平最高,T15组最低;各组间两两相比除T15/5与T0组无统计学差异(P>0.05)外,其余各组间差异均有统计学意义(P<0.05);当沟槽的宽度小于60 μm时,若沟槽的深度增加则可减少intergrin α5的表达,其中T15/10明显小于T15/5 (P<0.05)、T30/10明显小于T30/5(P<0.05);而沟槽宽度较大的T60组则相反,当沟槽的深度增加时可促进intergrin α5mRNA的表达,即T60/10明显大于T60/5(P<0.05)。
各组intergrin β1mRNA检测结果见图4b, 各组间的差异不如intergrin α5大,除T60/10组的表达水平明显高于其他各组(P<0.05),且T60/10明显高于T60/5(P<0.05)外,T0、T15、T30 3组的表达量均相似(P>0.05),在相同沟槽宽度下不同深度间相比亦无统计学差异(P>0.05)。
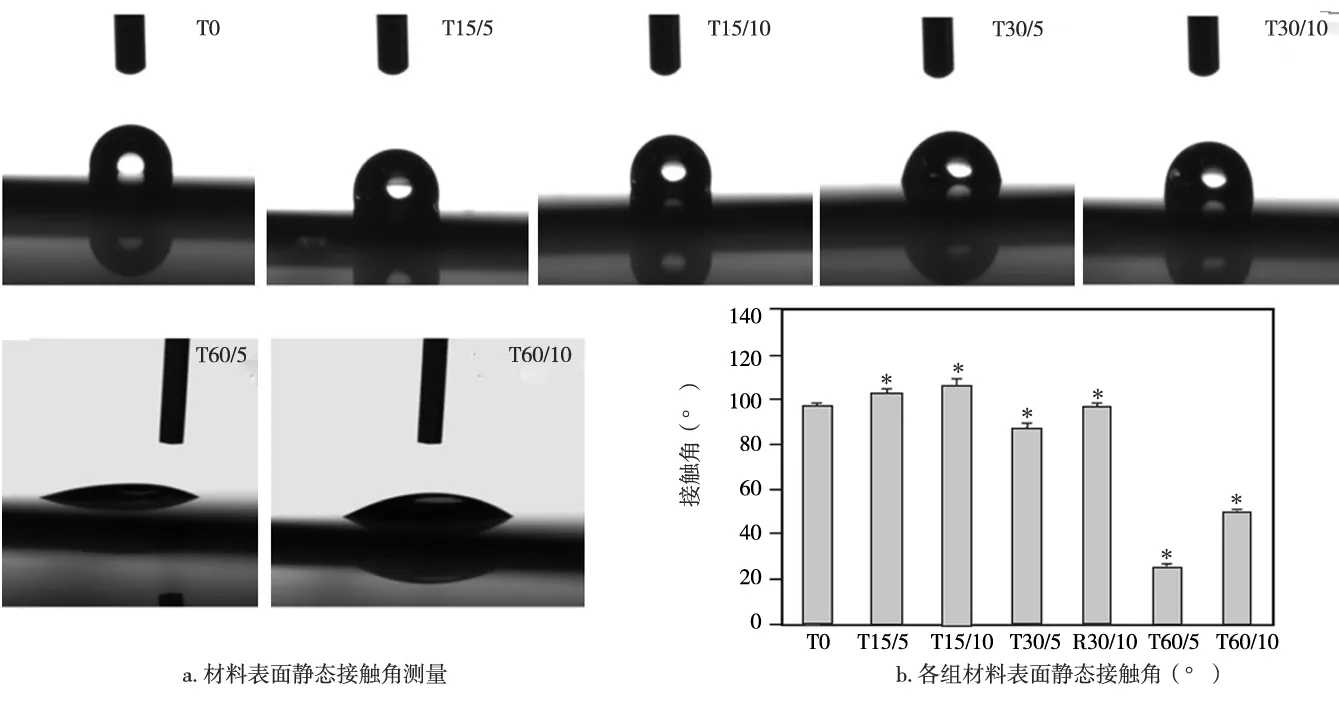
图3 各组材料表面亲水性测量结果(* P<0.05)
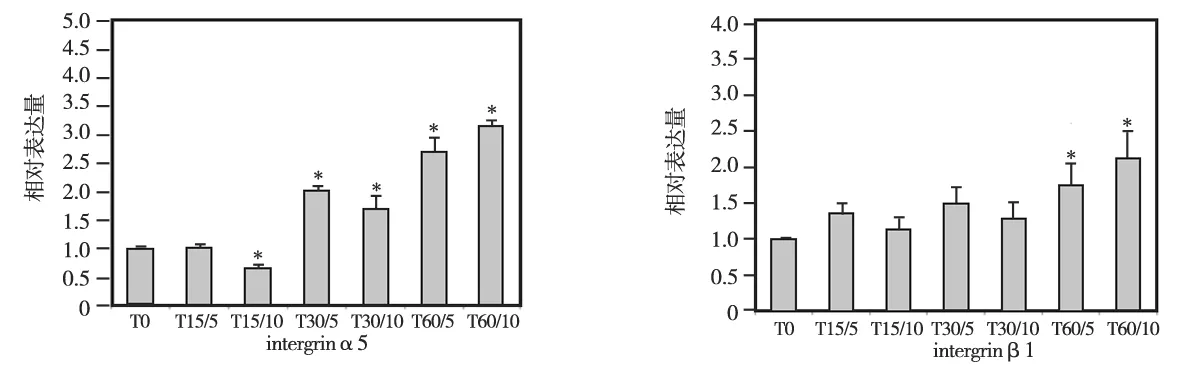
图4 各组intergrin α5、β1 mRNA表达水平比较(*P<0.05)
2.4 不同微沟槽对HGF表达intergrin α5、β1蛋白的影响(图5)
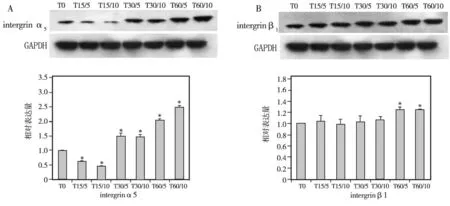
图5 各组intergrin α5、β1 蛋白表达水平比较(* P<0.05)
各组intergrin α5蛋白检测结果见图5a,其表达趋势与mRNA的表达基本一致,区别在于T15/5组的蛋白表达水平低于T0组,差异有统计学意义(P<0.05);当沟槽宽度为15 μm时,沟槽深度的增加可使蛋白表达减少,即T15/10组的表达水平明显低于T15/5组(P<0.05);当沟槽宽度60 μm时,沟槽深度的增加可使蛋白表达增多,即T60/10组的表达水平明显大于T60/5(P<0.05);当沟槽宽度为30 μm时,沟槽深度的增加对intergrin α5蛋白的表达没有影响。
各组intergrin β1蛋白检测结果见图5b,其表达趋势与mRNA的表达基本一致,不同的是T60/5和T60/10两组的蛋白表达水平明显大于其他各组(P<0.05);而T0、T15、T30 3组的表达量均相似(P>0.05),相同沟槽宽度下不同深度间相比亦无统计学差异(P>0.05)。
3 讨论
intergrin蛋白由一个α亚基和一个β亚基构成。目前已经发现18种α亚基和9种β亚基,这些亚基通过不同组合方式可构成至少25种整联蛋白。FAs中主要为整合素α5、β1,是纤维连接蛋白的受体,当细胞接触到ECM纤维连接蛋白(FN)后,intergrin α5、β1即被激活,此时α亚基的胞外区段所含的能识别细胞外基质(ECM)的RGD序列[5]就可介导intergrin与ECM的粘附;而β亚基的胞内区段则可与细胞骨架相连,最终构成一个ECM- intergrin- 细胞骨架跨膜系统;在这个过程中,细胞内部分还与酪氨酸磷酸酶-粘着斑激酶(FAK)相关联[4]。有研究证明intergrin还存在力学敏感性,即可通过力学刺激激活intergrin并使其达到更高的亲和力,从而增加其介导的与ECM的粘附效力;而且这种新结合的intergrin 能激发后续与其相关的信号传导途径[6]。该跨膜系统可双向传导细胞内外信号,并能诱导细胞骨架重排,从而广泛影响细胞的生长、增殖、侵袭、转移、凋亡等[5]。有研究发现,细胞首先通过intergrin蛋白识别外界的条件是否有利于粘附,当细胞感受到外界的条件适合粘附时,则将信号传递入细胞内并表达和招募Vinculin以促进ECM的合成;而当细胞感受到外界环境不适宜粘附时,则通过产生系列蛋白酶分解蛋白,从而抑制细胞的吸附[7]。以上研究结果提示,intergrin在材料表面粘附的位置对后续细胞的粘附起着重要作用。
有研究表明,当细胞受到被动动力学刺激(如对牙龈或牙周成纤维细胞施加牵引力)时,能增加intergrin α5、β1蛋白表达[8-9]。此外,细胞的附着通常由intergrin蛋白决定,细胞培养环境形貌和形态的改变会影响细胞粘附所需要的配体分布和溶度[10],并进而影响细胞跨膜intergrin 蛋白的表达和功能。有研究证明,当细胞受到主动力学刺激即表面形貌的改变时,也能影响intergrin的表达和分布。Teixeira[11]、Stevens[12]等研究指出,粘附表面的微孔结构能影响intergrin 粘附蛋白的表达和分布,并进而激活粘着斑激酶(FAK)使之成为细胞粘附、增殖的基本条件。另有研究发现,细胞在沟槽表面会产生不同程度的形变,且随着沟槽宽度的增加而形变增大,表明细胞产生的形变作用是细胞受到沟槽形貌力学作用后的一种反应[2]。本实验结果显示,HGF在相对较宽(T30和T60)的沟槽表面时,其intergrin α5的表达水平均明显高于T0组,其中T60组的表达量又明显高于T30组;而T15组的intergrin α5蛋白基因表达量甚至明显低于光滑组(intergrin β1在T15、T30组与T0组无差异)。由以上结果可以推测,intergrin α5蛋白的表达除了与细胞受力有关外,还与粘附表面的几何宽度有关。另外,在同一个细胞粘附表面存在断层情况下,也会影响粘附结构蛋白intergrin α5的表达,此时深度越大表达量越低(T15/10组 intergrin α5表达水平明显低于T15/5组);提示,沟槽的深度越大,导致细胞悬空附着的程度越大,就越不利于粘附结构蛋白intergrin α5的表达,比较intergrin α5和intergrin β1蛋白的表达水平还发现,沟槽宽度和深度对intergrin α5蛋白表达的影响大于后者,与Lin Wang等的研究结果一致[13];该作者认为,intergrin α5、β1对三维形貌的反应程度不一致,其中intergrin α5蛋白对三维形貌的垂直轴向更为敏感,不同的三维形貌可导致其表达量的差异加大。
此外,intergrin的表达还可能与材料表面的亲水性相关[14],增加材料表面的亲水性更有利于液态环境下培养的细胞接触材料表面,从而促进其intergrin的表达[15]。本试验中各组材料的表面接触角测定结果显示,其亲水性随着沟槽的加宽而增强,其中T15/5组和T15/10组表面的接触角甚至高于光滑表面;由于T15组材料表面呈强疏水性可能是导致其intergrin α5蛋白的表达水平比光滑表面少的另一主要原因。此外,T60/5的亲水性高于T60/10,而intergrin α5蛋白表达水平也是后者高于前者,可能与深度的增加加大了沟槽侧壁的粘附面有关,或由于T60/10材料表面的细胞形变率较高而受到力学作用最大相关联。
综合以上,intergrin蛋白可直接参与将力信号转换为生物化学信号或作为力学信号传导过程中的关键中介,而细胞骨架(核)的形变则是细胞受到环境影响而导致的力学作用的间接表达;因此intergrin的表达不仅与细胞受形貌主动力学作用后的变形程度有关,还与粘附表面的几何形貌尺寸大小、材料表面的亲水性有关。由于intergrin α5亚基与胞外环境连接因此比β1亚基受外界环境的影响较大,所以T15组的intergrin α5蛋白的表达水平最低,可能与其表面疏水性和过窄的沟槽形貌不利于细胞粘附有关。而T60表面细胞骨架形变大、材料表面亲水性高、粘附表面几何平面连续性较大等可能是T60/10组intergrin表达水平最高的原因。就细胞粘附中起重要作用的粘着斑附着(FAs)-跨膜结构蛋白intergrin α5、β1表达而言,建议将T60/10作为种植体穿龈部分的微沟槽尺寸。
[1]Rompen E, Domken O, Degidi M,etal. The effect of material characteristics, of surface topography and of implant components and connections on soft tissue integration: a literature review[J].ClinOralImplantsRes, 2006,17 (2):55-67.
[2]Lai Y, Chen J, Zhang T,etal. Effect of 3D microgroove surface topography on plasma and cellular fibronectin of human gingival fibroblasts[J].JDent, 2013,41(11):1109-1121.
[3]Geiger B, Spatz JP, Bershadsky AD. Environmental sensing through focal adhesions[J].NatRevMolCellBiol, 2009,10(1):21-33.
[4]Geiger B, Yamada KM. Molecular architecture and function of matrix adhesions[J].Review.ColdSpringHarbPerspectBiol, 2011,3(5):1-16.
[5]Schwartz MA. Integrins and extracellular matrix in mechanotransduction[J].ColdSpringHarbPerspectBiol, 2010,2(12):1-11.
[6]Friedland JC, Lee MH, Boettiger D. Mechanically activated integrin switch controls alpha5beta1 function[J].Science, 2009,323(5914):642-644.
[7]Biggs MJ, Richards RG, Wilkinson CD,etal. Focal adhesion interactions with topographical structures: a novel method for immuno- SEM labelling of focal adhesions in S- phase cells[J].JMicrosc, 2008,231(Pt 1):28-37.
[8]Hannafin JA, Attia EA, Henshaw R,etal. Effect of cyclic strain and plating matrix on cell proliferation and integrin expression by ligament fibroblasts[J].JOrthopRes, 2006,24(2):149-158.
[9]Bolcato- Bellemin AL, Elkaim R, Abehsera A,etal. Expression of mRNAs encoding for alpha and beta integrin subunits, MMPs, and TIMPs in stretched human periodontal ligament and gingival fibroblasts[J].JDentRes, 2000,79(9):1712-1716.
[10]Henshaw DR, Attia E, Bhargava M,etal. Canine ACL fibroblast integrin expression and cell alignment in response to cyclic tensile strain in three- dimensional collagen gels[J].JOrthopRes, 2006,24(3):481-490.
[11]Teixeira AI, Abrams GA, Bertics PJ,etal. Epithelial contact guidance on well- de?ned micro- and nanostruc- tured substrates[J].JCellSci, 2003, 116(10):1881-1892.
[12]Stevens MM, George JH. Exploring and engineering the cell surface interface[J].Science, 2005,310(5751):1135-1138.
[13]Lin Wang,Rebecca L. Carrier. Biomimetic Topography: Bioinspired Cell Culture Substrates and Scaffolds[J].AdvancesinBiomimetics, 2011,3:454-471.
[14]Anselme K, Davidson P, Popa AM,etal. The interaction of cells and bacteria with surfaces structured at the nanometre scale[J].ActaBiomater, 2010,6(10):3824-3846.
[15]Jacobs T, Declercq H, De Geyter N,etal. Plasma surface modification of polylactic acid to promote interaction with fibroblasts[J].JMaterSciMaterMed, 2013,24(2):469-478.
Effects of microgroove surface morphology on the expression of intergrin α5and intergrin β1in human gingival fibroblasts
LAI Ying- zhen*, LIN Shan, CHEN Jiang
(*DepartmentofOralMedicine,Xiamenmedicalcollege,Xiamen361000,China)
AIM: To investigate the effects of microgroove surface morphology on the expression of intergrin α5and intergrin β1in human gingival fibroblasts(HGFs). METHODS: Microgroove titanium surface was fabricated by photolithography with parallel grooves: 15 μm, 30 μm or 60 μm in width and 5 μm or 10 μm in depth. The combinations of groove width and depth were hereafter denoted as T15/5, T15/10, T30/5, T30/10, T60/5 and T60/10. Smooth titanium surface(T0) was used as the control. Surface topography and hydrophilicity were detected. HGFs were cultured on the microgroove surfaces for 3 days. Intergrin α5and intergrin β1expression was examined by Real- time PCR and western blotting. RESULTS: T60/5 microgroove showed the highest surface hydrophilicity. However, T15/10 had the highest surface hydrophobicity, even higher than T0 (P<0.05). T60/10 group showed the highest expression of intergrin α5and intergrin β1mRNA, and in T15/10 group the lowest (P<0.05). In groups with lower microgroove depth (T15, T30), expression of intergrin α5decreased with the increase of microgroove depth; while in groups with higher microgroove depth (T60), expression of intergrin α5mRNA increased with the increase of microgroove depth. T60/10 group showed the highest expression of intergrin β1mRNA (P<0.05), among the other 3 groups,P>0.05. The expression of intergrin α5and β1 protein showed similar pattern with mRNA expression. CONCLUSION: The effects of microgroove depth on intergrin α5and intergin β1depended on micro- groove width. Microgroove width and depth showed less effect on intergrin β1mRNA and protein when compared to that on intergrin α5.
implant; microgroove; human gingival fibroblasts; intergrin
2014-07-16
赖颖真(1984-), 女, 汉族,福建人。博士,讲师,主治医师
林 珊, E-mail: 121708065@qq.com
R780.2
A
1005-2593(2015)01-0008-07

