组胺及组胺受体1在大鼠牙周炎发病中表达差异的研究
冯小倩, 张 纲, 张慧宇, 冯晓丹, 张 萍, 谭颖徽
(第三军医大学附属新桥医院口腔科, 重庆 400037)
组胺及组胺受体1在大鼠牙周炎发病中表达差异的研究
冯小倩, 张 纲, 张慧宇, 冯晓丹, 张 萍, 谭颖徽
(第三军医大学附属新桥医院口腔科, 重庆 400037)
目的: 研究组胺及组胺受体1(HR1)在牙周炎发病机制中的作用。方法:将40只雄性SD大鼠随机分为实验组和对照组(每组20只),其中实验组采用正畸丝结扎法建立牙周炎模型,对照组不作任何处理;建模8周后,分别采用ELISA法检测各组龈沟液中组胺含量,荧光定量PCR法检测各组牙龈组织中HR1 mRNA的表达水平。结果:牙周炎组龈沟液中的组胺浓度(35.47± 3.908)μg/L高于正常对照组(19.77± 3.832)μg/L(P<0.05);牙周炎组牙龈组织中的HR1- mRNA表达水平低于正常对照组(P<0.05)。结论:组胺及HR1对牙周炎的发病均有一定调控作用。
牙周炎; 大鼠; 组胺; 组胺受体Ⅰ(HR1)
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.01.003
[Chinese Journal of Conservative Dentistry,2015,25(1):15]
牙周炎是由牙周致病菌导致牙周组织破坏的慢性感染性疾病,其特点是致病菌及其产物如内毒素(LPS)直接破坏,以及免疫细胞与促炎细胞因子相互作用而造成牙周支持组织的丧失[1]。在此过程中释放多种炎症介质可通过相互作用而加重牙周组织的破坏,部分炎性介质还可促进破骨细胞的活性,加重骨吸收[2]。组胺是一种以无活性结合型存在于肥大细胞和嗜碱性粒细胞颗粒中的自体活性物质,在体内由组氨酸脱羧基而成,具有影响多种细胞反应的作用,包括过敏反应,炎性反应等。最新研究认为,组胺是免疫反应中重要的调控者[3]。体内存在的多种细胞因子均参与促进组胺的合成。如TNF- α、IL- 1可与人粒细胞-巨噬细胞集落刺激因子(GM- CSF)协同诱导嗜碱粒细胞前驱细胞合成组胺;LPS可通过刺激巨噬细胞而使其合成组胺[4];细胞因子IL- 3能与LPS协同促进巨噬细胞合成组胺[5]。组胺通过脱颗粒现象由肥大细胞和嗜碱性粒细胞释放并与组胺受体结合从而产生生物学效应,使机体发生炎症反应。因此,研究组胺(Histamine)和组胺受体(Histamine receptor, HR)在机体应答炎症反应中的调控机制,对于牙周炎进程的诊断与治疗具有重要意义。本研究通过建立大鼠牙周炎模型并观察其牙周组织病理变化,同时检测龈沟液中组胺表达水平的改变以及牙龈组织中HR1-mRNA含量表达的差异,初步探讨组胺及其受体在牙周炎症中的作用。
1 材料和方法
1.1 主要材料和仪器
SD大鼠(第三军医大学大坪医院实验动物中心提供,所涉及的动物实验均经第三军医大学实验动物伦理委员会许可);戊巴比妥钠(第三军医大学新桥医院中心实验室提供);大鼠组胺检测试剂盒(RND公司,美国);酶标仪( Bio- Rad 5.0, 美国);AX80自动研究级系统显微镜( Olympus公司,日本);mRNA提取试剂盒、逆转录试剂盒、荧光实时定量PCR试剂盒(TaKaRa, 日本)。
1.2 方法
1.2.1 牙周炎动物模型的建立
取健康雄性SD大鼠40只,体质量(220±10)g,于室温下适应性饲养(普通饲料喂养)4 d后,将其随机分为实验组和对照组(n=20)。其中实验组参照Achong等[6]报道的方法及标准建立大鼠牙周炎模型(采用正畸结扎丝结扎右侧上颌第一磨牙颈部,并配合Keyes’, sdiet2000牙周炎食谱喂养);对照组不作任何处理,在相同环境下普通饲料喂养。建模期间定期(每周1次)观察各大鼠的牙周组织变化情况以及结扎情况,若结扎丝脱落或移位则重新结扎。
1.2.2 常规组织学观察
建模8周后分别从每组中各随机抽取10只大鼠,用40 g/L多聚甲醛液心内灌注处死后取其右侧上颌第一磨牙及牙周组织;分别用40 g/L多聚甲醛液再次固定、EDTA液脱钙2周后,常规脱水、包埋、制作石蜡切片,HE染色观察结合上皮、沟内上皮、牙龈上皮、上皮下炎细胞浸润情况。
1.2.3 龈沟液中组胺含量的测定
组织学观察确定牙周炎模型建立成功后,取各组所余的另10只大鼠,用无菌干棉球擦干各大鼠右侧上颌第一磨牙的牙面并隔湿;然后将3个已称量的Whatman40号滤纸条(2 mm×20 mm)分别插入各取样牙的颊侧近中、中央及远中3 个位点的牙周袋内, 直至遇轻微阻力为止, 30 s后取出合并放入一个微离心管中(若有血液和唾液污染,则弃置重取);再次称重并按以下公式计算所取龈沟液的重量:龈沟液重量=(提取龈沟液后3个滤纸条+ Ep管)的重量- (取样前3个滤纸条+ Ep 管)的重量。所有样本均置于-70 ℃下保存,检测时室温放置1 h后,放入加有0.5 mL PBS缓冲液洗脱离心10 min ( 3 000 r/min), 取上清液;然后按大鼠组胺试剂盒说明检测各样本450 nm波长处的吸光度值,并以组胺标准品系列浓度为X轴,对应的450 nm波长吸光度值为Y轴,在CurveExpert 1.4软件中选择拟合度最好的标准曲线方程计算各个样品中组胺的浓度。
1.2.4 荧光定量PCR检测牙龈组织中HR1- mRNA的表达
龈沟液取样结束后,脱颈处死各组大鼠并取其唇颊侧牙龈组织, 吸干血迹和唾液后称重, 加入三蒸水配制的生理盐水制成10%组织匀浆;5 ℃、4 000 r/min 离心10 min, 取上清液置-20 ℃冻存待测。取RNAlater中保存的组织样本,液氮冷冻下研磨后加入Trizol匀浆液裂解细胞,并严格按照Trizol说明书提取总RNA;分别经微量分光光度计和10 g/L琼脂糖凝胶电泳检测确定A260/280在1.8~2.0范围内(RNA完整)后,取1 μg RNA按逆转录试剂盒说明书合成cDNA。然后以稀释3倍的cDNA为模板,GAPDH为内参照,用荧光定量PCR仪测定各样本中HR1- mRNA表达情况。所用引物用primer3专业引物设计软件进行设计,并由invitrogen公司合成,各引物序列如下:HR1- mRNA:上游引物5c- GTGGGCATAAGAAACC- 3c;下游引物5c- TCAAGCGGGAAGCAGTAG- 3c,产物长度191 bp;GAPDH: 上游引物5c- TCACCAACTGGGACGACA- 3c,下游引物5c- GCATACAGGGACAGCACA- 3c,产物长度206 bp。
反应体系共25 μL,分别为:SYBR Premix EX Taq(TaKaRa公司)12.5 μL、F- primer(10 pmol/lxL)0.5 μL, R- prime(10 pmol/lxL )0.5 μL,cDNA 1 μL,dd H2O补至25 μL。反应条件为:95 ℃ 5 min;95 ℃ 5 sec,60 ℃ 30 sec,40 cycles。反应结束仪器自动生成循环阈值(cycle threshold,Ct值)后,用HR1- mRNA与内参基因GAPDH的Ct值差值(△Ct)表示HR1- mRNA相对含量。
1.2.5 统计学分析
2 结果
2.1 临床大体观察
建模8周后,对照组牙周组织肉眼观察无明显变化,牙周炎组牙周组织有中度炎症,牙龈红肿光亮,可探及牙周袋,BOP(+)。
2.2 组织学观察
建模8周后组织学观察显示,牙周炎组结合上皮向根方退缩并形成牙周袋,龈沟上皮变性,上皮及固有层可见中等量炎性细胞浸润,牙周膜间隙略增宽;对照组无明显炎症反应,但牙周膜间隙未见异常;牙龈结合上皮为无角化的鳞状上皮,无上皮钉突,牙周膜排列一致;牙槽骨表面光滑,未见破骨细胞和骨陷窝形成(图1~2)。
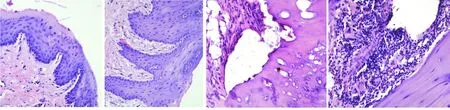

正常对照组 牙周炎组 正常对照组 牙周炎组
图1 建模8周时各组牙龈组织形态(HE, ×100) 图2 建模8周时各组牙周组织形态(HE, ×400)
2.3 各组龈沟液中组胺含量比较
实验8周时,牙周炎组龈沟液中的组胺含量明显高于正常对照组(P<0.05)(表1)。
2.4 各组牙龈组织中HR1- mRNA含量比较
实验8周时,牙周炎组牙龈组织中的HR1- mRNA含量仅为正常对照组的1/2,两者相比差异有统计学意义(P<0.05)(图3)。
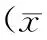
表1 各组大鼠龈沟液中组胺含量比较 ±s)
*与对照组相比P<0.05
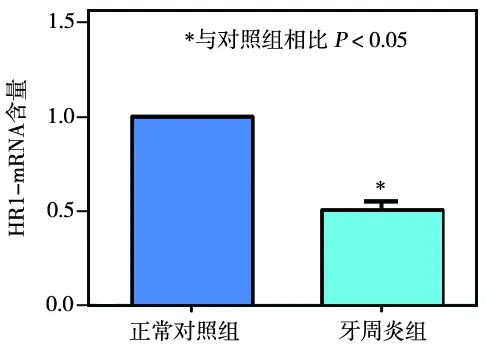
图3 各组牙龈组织中HR1- mRNA含量比较
3 讨论
组胺可由肥大细胞、嗜碱性粒细胞、嗜铬细胞、血小板、树突状细胞以及T细胞等多种细胞生成,对机体的多种生理机能(包括细胞的增殖、分化、造血过程、胚胎发育、组织再生以及伤口愈合等)均有一定的影响。在不同微生物源性感染中,组胺广泛存在于各种炎症以及感染性疾病患者的局部组织中,具有正、负双向调控作用细胞免疫反应的功能[7-13]。在炎症早期阶段,局部组织中可以分离出组胺,表明组胺参与了早期炎症反应,并可促进炎症发展[14]。组胺的通路活化有赖于其相应的4个受体,按被发现顺序分别命名为:HR1、HR2、HR3、HR4。HRs属G蛋白偶联受体(G- protein-coupled receptors,GPCRs)家族成员,与通过偶联激活特异性G蛋白而进行信号转导。组胺-HR1通路需在组胺脱羧酶的作用下激活,有研究证实先天缺乏组胺脱羧酶大鼠的骨组织中破骨细胞生成减少,并只有少量的破骨细胞[15],说明组胺与破骨细胞的生长以及骨组织损伤关系密切。不同组胺受体通路的功能由4个不同的特定组胺受体亚型所介导,其中HR1被认为是自身免疫性疾病的关键分子,表达于Th1细胞,具有调控组胺致敏的作用。因此,本实验通过建立大鼠牙周炎模型,并在牙周炎病理条件下检测了龈沟液中组胺的表达量。结果显示,牙周炎组龈沟液中组胺水平明显高于正常对照组(P<0.05);暗示,组胺表达的升高与牙周病的病程呈正相关性,并说明在慢性炎症的刺激中可能持续存在细胞脱颗粒现象,从而导致大量组胺的产生,加重了组织对炎症反应的应答。
另外,Ma RZ研究发现,HR1通过依赖IFN- γ分泌增加从而促使Th1细胞的应答,在对组织的破坏损伤作用中扮演重要角色[16]。本研究中发现,实验组牙龈组织中的HR1- mRNA表达水平明显低于正常对照组(P<0.05),进一步证实组胺及HR1通路在牙周炎的进展中具有重要作用。有研究发现,一定程度的炎症条件下,由肥大细胞合成和分泌的组胺、肝素、类胰蛋白酶、细胞因子等能够刺激成纤维细胞增殖并形成胞外基质积聚,从而使组织纤维化[17]。另外,组胺的过度增加还会加重TNF- α、IL- 1、LPS对牙龈成纤维细胞的炎症刺激,并增强局部组织的免疫反应,从而进一步加重了牙周组织的破坏[18]。组胺可通过刺激牙龈成纤维细胞分泌细胞因子、前列腺素,使IL- 2、IL- 4、PGE2表达升高[18-19]。其中PGE2是一种炎症介质和强效促进骨吸收的刺激因子,能够加速破骨细胞的形成、增强破骨细胞前体的融合、抑制钙化,从而促进骨的吸收[20-21]。组胺参与了机体大多数免疫及炎症的生理、病理反应[7],在免疫功能中起着潜在的调节作用[22]。本结果显示,牙周炎组龈沟液中组胺的含量明显增加,而HR1表达明显下降,暗示了组胺-HR1通路在牙周炎症中的重要调控作用,即当炎症发展到一定程度时,HR1的下降使组胺-HR1通路水平下降,并形成负向调节,从而可保护组织免受炎症中因组胺的不断增加而产生的进一步破坏。相关研究也表明,HR2拮抗剂在兔模型中可抑制牙周炎,并能减少骨吸收的形成[23]。有研究发现,HR1的活化还可导致气道及血管平滑肌细胞的收缩、增强血管内皮细胞的通透性;并促进相关细胞合成前列腺环素(prostacyclin)以及血小板激活因子(plateletactivating factor);而HR2通路则主要对血管、子宫以及气道平滑肌细胞产生舒张作用;在一定情况下,可通过激活HR1通路以达到对HR2通路的双向调节作用[24-25]。
Masahiro等证实,运用HR1拮抗剂可以抑制组胺诱导的集落刺激因子、IL- 6和IL- 8的分泌,并能拮抗组胺介导的Ca2+依赖的NF- kB通路[26]。目前,在炎症中针对调控组胺-HR1的治疗手段,主要通过HR1拮抗剂的使用而抑制阻碍该通路的激活,从而抑制不断增多的组胺对炎性组织的进一步破坏。但运用HR1受体拮抗剂治疗炎性以及变态反应性疾病时,常会因不同病理环境而使其疗效存在一定差异[27]。因此,从基因水平对组胺-HR1的调控治疗可能更具重要意义。本实验中检测发现,实验组龈沟液组胺的含量明显高于正常对照组(P<0.05);而HR1- mRNA表达水平则较正常对照组明显下降 (P<0.05);提示,在炎症反应条件下活体组织中可能存在调控HR1基因表达的重要机制;从而为组胺-HR1通路控制治疗手段提供了实验依据。但HR1在炎症中通过何种调控而影响其基因表达的具体机制尚不清楚,仍需进一步深入的研究。
[1] Loesche WJ, Syed SA, Morrison EC,etal. Treatment of periodontal infections due to anaerobic bacteria with short- term treatment with metronidazole[J].JClinPeriodontol, 1981, 8(1): 29-44.
[2]Wisutsitthiwong C, Buranaruk C, Pudhom K,etal. The plant limonoid 7- oxo- deacetoxygedunin inhibits RANKL- induced osteoclastogenesis by suppressing activation of the NF- kappaB and MAPK pathways[J].BiochemBiophysResCommun, 2011, 415(2): 361-366.
[3]Gutierrez- Venegas G, Rodriguez- Perez CE. Toll- like receptor 3 activation promotes desensitization of histamine response in human gingival fibroblasts: Poly (I:C) induces histamine receptor desensitization in human gingival fibroblasts[J].CellImmunol, 2012, 273(2): 150-157.
[4]Vonakis BM, Sora R, Langdon JM,etal. Inhibition of cytokine gene transcription by the human recombinant histamine- releasing factor in human T lymphocytes[J].JImmunol, 2003, 171(7): 3742-3750.
[5]Dy M, Arnould A, Lemoine FM,etal. Hematopoietic progenitors and interleukin- 3- dependent cell lines synthesize histamine in response to calcium ionophore[J].Blood, 1996, 87(8): 3161-3169.
[6]Achong R, Nishimura I, Ramachandran H,etal. Membrane type (MT) 1- matrix metalloproteinase (MMP) and MMP- 2 expression in ligature- induced periodontitis in the rat[J].JPeriodontol,2003, 74(4): 494-500.
[7]Akdis CA, Blaser K. Histamine in the immune regulation of allergic inflammation[J].JAllergyClinImmunol, 2003, 112(1): 15-22.
[8]Jutel M, Watanabe T, Akdis M,etal. Immune regulation by histamine[J].CurrOpinImmunol, 2002, 14(6): 735-740.
[9]Jutel M, Watanabe T, Klunker S,etal. Histamine regulates T- cell and antibody responses by differential expression of H1 and H2 receptors[J].Nature, 2001, 413(6854): 420-425.
[10]Banu Y, Watanabe T. Augmentation of antigen receptor- mediated responses by histamine H1 receptor signaling[J].JExpMed,1999, 189(4): 673-682.
[11]Ash AS, Schild HO. Receptors mediating some actions of histamine[J].BrJPharmacolChemother, 1966, 27(2): 427-439.
[12]Beghdadi W, Porcherie A, Schneider BS,etal. Inhibition of histamine- mediated signaling confers significant protection against severe malaria in mouse models of disease[J].JExpMed, 2008, 205(2): 395-408.
[13]Metz M, Doyle E, Bindslev- Jensen C,etal. Effects of antihistamines on innate immune responses to severe bacterial infection in mice[J].IntArchAllergyImmunol, 2011, 155(4): 355-360.
[14]钟斐,蒋瑾瑾.组胺及组胺受体对免疫系统调节作用[J]. 中华临床医师杂志, 2013,7(21):9753-9755.
[15]Fitzpatrick LA, Buzas E, Gagne TJ,etal. Targeted deletion of histidine decarboxylase gene in mice increases bone formation and protects against ovariectomy- induced bone loss[J].ProcNatlAcadSciUSA, 2003, 100(10): 6027-6032.
[16]Ma RZ, Gao J, Meeker ND,etal. Identification of Bphs, an autoimmune disease locus, as histamine receptor H1[J].Science, 2002, 297(5581): 620-623.
[17]Gailit J, Marchese MJ, Kew RR,etal. The differentiation and function of myofibroblasts is regulated by mast cell mediators[J].JInvestDermatol, 2001, 117(5): 1113-1119.
[18]Minami T, Kuroishi T, Ozawa A,etal. Histamine amplifies immune response of gingival fibroblasts[J].JDentRes, 2007, 86(11): 1083-1088.
[19]Gutierrez- Venegas G, Cruz- Arrieta S, Villeda- Navarro M,etal. Histamine promotes the expression of receptors TLR2 and TLR4 and amplifies sensitivity to lipopolysaccharide and lipoteichoic acid treatment in human gingival fibroblasts[J].CellBiolInt, 2011, 35(10): 1009-1017.
[20]Nakashima K, Roehrich N, Cimasoni G. Osteocalcin, prostaglandin E2 and alkaline phosphatase in gingival crevicular fluid: their relations to periodontal status[J].JClinPeriodontol, 1994, 21(5): 327-333.
[21]Van Dyke TE, Serhan CN. Resolution of inflammation: a new paradigm for the pathogenesis of periodontal diseases[J].JDentRes, 2003, 82(2): 82-90.
[22]O'Mahony L, Akdis M, Akdis CA. Regulation of the immune response and inflammation by histamine and histamine receptors[J].JAllergyClinImmunol, 2011, 128(6): 1153-1162.
[23]Hasturk H, Kantarci A, Ebrahimi N,etal. Topical H2 antagonist prevents periodontitis in a rabbit model[J].InfectImmun, 2006, 74(4): 2402-2414.
[24]Baudry M, Martres MP, Schwartz JC. H1 and H2 receptors in the histamine- induced accumulation of cyclic AMP in guinea pig brain slices[J].Nature, 1975, 253(5490): 362-364.
[25]Garbarg M, Schwartz JC. Synergism between histamine H1- and H2- receptors in the cAMP response in guinea pig brain slices: effects of phorbol esters and calcium[J].MolPharmacol, 1988, 33(1): 38-43.
[26]Matsubara M, Tamura T, Ohmori K,etal. Histamine H1 receptor antagonist blocks histamine- induced proinflammatory cytokine production through inhibition of Ca2+-dependent protein kinase C, Raf/MEK/ERK and IKK/I kappa B/NF- kappa B signal cascades[J].BiochemPharmacol,2005, 69(3): 433-449.
[27]Neumann D, Schneider EH, Seifert R. Analysis of histamine receptor knockout mice in models of inflammation[J].JPharmacolExpTher, 2014, 348(1): 2-11.
Differential expression of histamine and histamine receptor 1 in rats with periodontitis
FENG Xiao- qian, ZHANG Gang, ZHANG Hui- yu, FENG Xiao- dan, ZHANG Ping, TAN Ying- hui
(ChongQing,DepartmentofStomatology,XingQiaohospital,TheThirdMilitaryMedicalUniversity,Chongqing400037,China)
AIM: To investigate the expression of histamine and histamine receptor 1(HR1) in rat gingival crevicular fluid (GCF) and gingival tissues. METHODS: 40 adult SD rats were randomly divided into 2 groups(n=20): The periodontitis models were established by ligation technique and the rats in control group received no treatment. After 8 weeks, Histamine in GCF was detected by ELISA. HRI mRNA expression in gingival tissues was detected by QT- PCR. RESULTS: The level of histamine in GCF in the periodontitis group (35.47±3.908) μg/L was higher than that in control group (19.77±3.832)μg/L(P<0. 05). HRI mRNA in gingival tissues of periodontitis group was lower than that of the control group (P<0.05). CONCLUSION: Upregulation of histamine in GCF and downregulation of HRI in gingival tissues may play important roles in pathogenesis of periodontitis.
periodontitis; rat; histamine; histamine receptor 1
2014-06-30;
2014-12-09
军队十二五课题(CWS12J096)
冯小倩(1988-), 女, 汉族, 安徽人。硕士生(导师: 谭颖徽)
谭颖徽,E-mail: tanyh1962@outlook.com
R781.4
A
1005-2593(2015)01-0015-05
第三军医大学校管课题(2011D274)

