一次法咬合重建对大鼠咬肌组织损伤相关蛋白表达的影响
崔 洁, 于世宾, 何惠明, 张春宝
(第四军医大学口腔医学院 军事口腔医学国家重点实验室:1.修复科; 2.颞下颌关节病科; 3. 修复工艺科, 陕西 西安710032)
一次法咬合重建对大鼠咬肌组织损伤相关蛋白表达的影响
崔 洁1, 于世宾2, 何惠明1, 张春宝3
(第四军医大学口腔医学院 军事口腔医学国家重点实验室:1.修复科; 2.颞下颌关节病科; 3. 修复工艺科, 陕西 西安710032)
目的: 探讨一次法咬合重建后大鼠咬肌损伤相关结蛋白(desmin)和骨骼肌肌钙蛋白抑制亚基(sTnI)含量的变化。方法:取8周龄健康雄性SD大鼠60只,随机分为空白对照组(C组)、操作对照组(S组)和一次法咬合重建组(T组)(n=20)。T组采用人工逐次磨除法将各大鼠上颌后牙牙冠磨低约1.2 mm,6周后口外制作咬合板并将其粘固于各大鼠的上颌后牙上;S组麻醉后模拟T组操作过程,无实际操作;C组不作任何处理。咬合重建后3、7、14、28 d处死大鼠(n=5),取其双侧咬肌组织并采用western blot方法检测咬肌细胞内desmin和sTnI的表达。结果:①S组与C组相比desmin、sTnI表达无明显差异(P>0.05);②T组于咬合重建后3 d时desmin、sTnI开始降低(P<0.05),7 d时降至最低,14 d后逐渐增加,28 d时恢复正常;28 d时desmin、sTnI的表达水平与C组、S组相比P>0.05,其他各时间点的desmin、sTnI表达水平均低于C组和S组(P<0.05)。 结论:一次法咬合重建可造成咬肌细胞内desmin和sTnI发生不同程度的降解,但这种变化是可逆的。
一次法咬合重建; 咬肌; 结蛋白(desmin); 骨骼肌肌钙蛋白抑制亚基(sTnI)
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.01.004
[Chinese Journal of Conservative Dentistry,2015,25(1):20]
咬合垂直距离(occlusal vertical dimension,OVD)通常是指上下颌牙尖交错位时面下1/3的高度,临床上以鼻底到颏下点的距离来表示[1]。多种先天或后天的原因均可导致咬合垂直距离的降低,从而引起咀嚼肌和颞下颌关节的一系列改变,并进一步导致颞下颌关节紊乱综合征;在临床修复中,常采用咬合重建修复(升高咬合)的方法对其进行治疗。目前临床上升高咬合的方法有两种:一种是渐进性缓慢地升高,以避免咬合突然升高而导致的口颌系统出现不适;另一种是在双侧咀嚼肌平衡,且患者无异常感的情况下进行一次性升高[2]。以往的研究多集中于患者逐渐适应的情况下缓慢地升高咬合[3-4],而对于一次法咬合重建的研究尚未见相关报道。本课题组在前期研究中成功建立了一次法咬合重建的动物模型,并发现该模型动物的咬肌显微、超微结构,以及咬肌内线粒体的Ca2+含量均发生了可逆性变化[5]。本实验拟通过观察一次法咬合重建后大鼠咬肌损伤相关蛋白结蛋白(desmin)和骨骼肌肌钙蛋白抑制亚基(skeletal muscle troponin I, sTnI)的变化,进一步探讨一次法咬合重建对咬肌组织的影响。
1 材料和方法
1.1 主要材料及仪器
SD大鼠[第四军医大学实验动物中心提供,合格证号:SCXK-(军)一2012-0007];10 g/L戊巴比妥钠注射液(西安国安生物科技有限公司);硅橡胶印模材料、3M RelyX Unicem树脂粘结剂(3M公司,美国);可乐丽菲露自酸蚀粘结剂(上海可乐丽国际贸易有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所); Desmin兔抗大鼠多克隆抗体、sTnI绵羊抗大鼠多克隆抗体(Abcam,英国);SDS- PAGE凝胶配制试剂盒(北京康为世纪生物科技有限公司);204+102L型微型技工打磨机(世新,韩国);直径为0.30 mm慢速球钻(NTI,美国);光学显微镜(Leica,德国);火焰状砂石(松风,日本);CL- 628树脂光固化灯(南昌普洋科技有限公司);垂直电泳槽、电泳仪(Bio- Rad,美国);scanner Q62型扫描仪(BenQ,德国)。
1.2 实验方法
1.2.1 实验动物选择及分组
取颌面对称,牙列完整的8周龄健康雄性SD大鼠60只, 体质量(220±15)g,于我院动物实验中心适应性饲养,室温(20±3)℃,自由饮水和摄食1周后,将其随机分为3组:空白对照组(C组)、操作对照组(S组)、实验组(T组)(n=20)。另取1只10周龄雄性SD大鼠,断颈处死后取出上颌骨,利用光固化成型片制作大鼠上颌个别托盘。
1.2.2 一次法咬合重建动物模型的建立
取实验组大鼠按以下步骤建立一次法咬合重建动物模型:①取实验组各大鼠,分别用 10 g/L 戊巴比妥钠腹腔注射(0.40 mL/100 g)麻醉后,用个别托盘和硅橡胶以二次印模法制取各大鼠正常牙列的印模,超硬石膏灌注;②在外科手术显微镜下用慢速马达(35 000 r/min)带动直径为0.3 mm的NTI球钻分次磨低各大鼠的上颌后牙牙冠,使其高度降低约1.2 mm(每隔5 d磨除1次,每次磨除0.3 mm,共计4次)。同时磨低其下颌前牙以保证前后牙列咬合接触[5]。咬合垂直距离降低完成后,再次用硅橡胶以二次印模法制取印模,超硬石膏灌注; ③用正常牙列石膏模型翻制印模,并灌注自凝塑料(稀糊期),待其至面团期早期时,取对应的磨耗后石膏模型复位,作为大鼠的个别咬合板(厚度为1.2 mm); ④根据本课题组前期实验结果(待发表)(大鼠牙齿重度磨耗后其咀嚼肌改建活动在 42 d后趋于稳定),于大鼠咬合垂直距离降低后 42 d进行一次法咬合重建。实验组各大鼠在10 g/L戊巴比妥钠腹腔注射麻醉下,干棉卷隔湿,分别在其上颌双侧磨牙咬合面涂粘结剂,光固化灯光照 20 s;分别取各大鼠的相应咬合板,并将牙托水滴于其粘结面使之溶胀,干燥后涂粘结剂并光照20 s;然后用3M RelyX Unicem树脂粘结剂将咬合板粘固于相应大鼠的上颌磨牙上,确定咬合板就位且密合后,光照60 s;最后检查各大鼠的咬合并去除咬合高点,使上下颌达到均匀广泛地接触。
操作对照组各大鼠按同样方法麻醉后仅模拟实验组的操作过程,不做实际处理;空白对照组不进行任何处理。各组大鼠均在相同环境下进行饲养。
1.2.3 取材和咬肌肌总蛋白提取
分别于一次法咬合重建后3、7、14、28 d各时间点,从每组中各随机抽取5只大鼠,脱颈处死后取各大鼠的双侧咬肌组织并将其剪成细小的碎块;然后按每20 mg肌肉组织用100 μL裂解液的比例加入裂解液,用手握式电动组织匀浆器对肌肉进行匀浆,直至肌细胞充分裂解。充分裂解后,14 000 r/min 离心10 min,取上清(即肌总蛋白)分装于EP管中,用BCA蛋白定量试剂盒对提取的蛋白进行定量分析后,加入上样缓冲液煮沸5 min,-20 ℃ 保存备检。
1.2.4 western- blot检测损伤相关蛋白的含量
取上述提取的各组咬肌肌总蛋白样品,按以下步骤检测desmin和sTnI蛋白的含量。①配胶:配制分离胶,待其凝固后再配置浓缩胶并注入玻璃板,同时插入梳子; ②上样:将玻璃板放入电泳槽并加入电泳液,然后取各组肌总蛋白样品上样(10 μg); ③电泳:上层胶以80 V电泳25 min,下层胶以120 V电泳60 min; ④转膜:按照胶的大小裁剪NC膜和滤纸,采用Bio- Rad系统进行转膜; ⑤封闭:将NC膜做好标记后,放入封闭液中37 ℃恒温孵育30 min; ⑥蛋白免疫印迹检测:蒸馏水洗膜10 min后,分别滴加TBST溶液(1 ∶1 000的稀释比)稀释的兔抗Desmin抗体和绵羊抗sTnI抗体,并将其置于密封袋中4 °C过夜; TBST洗膜15 min×4次,滴加TBST稀释的二抗,室温孵育1 h;TBST洗膜15 min×4次后,分别进行化学发光、显影、图像采集; ⑦ 图像分析:采用IPP软件对条带灰度进行计算。
1.3 统计学分析
2 结果
2.1 desmin在各组咬肌中的表达
S组与C组相比,desmin的表达量无统计学差异(P>0.05); T组于咬合重建后3 d时desmin的表达量开始降低,7 d时达到最低,14 d时开始逐渐增加,至28 d时基本恢复到正常水平,其中除T组28 d时与C组和S组相比无统计学差异(P>0.05)外,3、7、14 d各时间点的desmin表达量均明显低于C组和S组(P<0.05); T组各时间点的desmin表达量两两相比,除3 d与7 d相比无统计学差异(P>0.05)外,其他各时间点间差异均有统计学意义(P<0.05)(图1~2)。
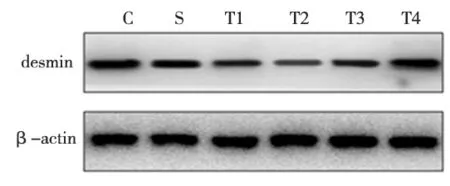
T1、T2、T3、 T4分别为实验组3、7、14、28 d
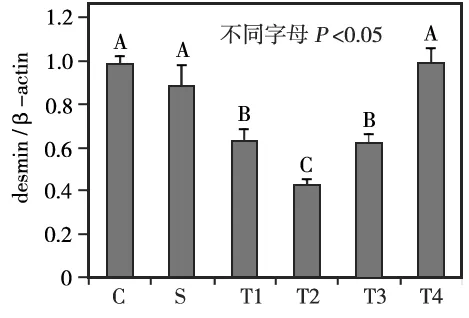
T1、T2、T3、 T4分别为实验组3、7、14、28 d
2.2 sTnI在各组咬肌中的表达
各组sTnI蛋白的表达量两两相比与desmin基本一致,即S组与C组相比无统计学差异(P>0.05);T组于咬合重建3 d时sTnI的表达量开始降低,7 d时降至最低,14 d时开始逐渐增加,至28 d时基本恢复到正常水平,其中除T组28 d时与C组和S组相比无统计学差异(P>0.05)外,3、7、14 d 各时间点的sTnI表达量均明显低于C组和S组(P<0.05)(图3~4)。
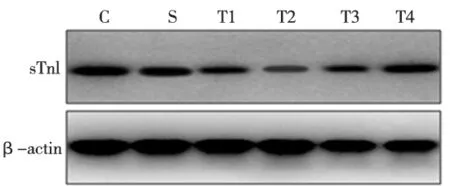
T1、T2、T3、 T4分别为实验组3、7、14、28 d
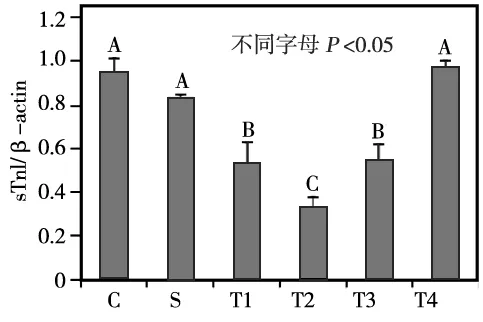
T1、T2、T3、T4分别为实验组3、7、14、28 d
3 讨论
咬合重建是指用修复方法改造和重新建立牙列的咬合状态,使之与颞下颌关节及咀嚼肌功能协调一致,从而消除因牙合异常而引起的口颌系统紊乱,并使口颌系统恢复正常的生理功能[6]。大部分学者认为,当垂直距离丧失较多时必须采取渐进法升高咬合,一般选用初始厚度为2 mm暂时性牙合垫,然后再根据复诊时患者的舒适度逐渐增加高度,直至达到预期高度[7];并认为,只有将垂直距离增高至适当范围,才可减少咀嚼肌升颌肌群的张力,此范围一般不超过息止颌位[8]。本课题组前期实验表明,一次法咬合重建可使大鼠咬肌显微、超微结构及颞下颌关节发生适应性改建[9]。本实验通过观察一次法咬合重建后大鼠咬肌细胞中desmin和sTnI表达的变化,进一步探讨一次法咬合重建对咬肌的影响。
desmin是骨骼肌、平滑肌和心肌中重要的细胞骨架蛋白,主要存在于Z带和闰盘,并排列成相互交错的三维网状结构,且能通过该结构将Z带与细胞膜及细胞核相连接,从而使众多的单个肌原纤维连接起来;其主要作用不仅能将所有肌原纤维的单个收缩运动机械地整合在一起形成牙合力[10],同时还能限制肌节在肌肉收缩时被过分牵拉。除此之外,desmin还在肌肉形态的形成与维持、细胞之间的信息传递、肌细胞分化的调控等多个方面具有非常重要的意义[11]。大量研究表明,desmin丢失是骨骼肌运动性微损伤的一个敏感指标,desmin不仅在维持肌原纤维的完整性方面起重要作用,而且还与肌肉损伤后的修复或再生密切相关[12]。Friden 等[13]发现,运动可导致desmin断裂,并认为细胞骨架蛋白的破坏是导致肌组织超微结构变化的重要原因。Lieber等[14]报道,肌节的过度伸展能引起细胞内局部钙离子的浓度升高,并激活细胞内的钙激活蛋白酶,从而使desmin发生水解,进而导致肌节结构紊乱。以往研究表明,一次法咬合重建可引起咬肌细胞超微结构发生可逆性损伤,并使咬肌细胞内Ca2+含量增加[5]。本结果显示,与对照组相比,一次法咬合重建后第3天时其desmin的表达即开始明显下降,第7天时达到最低,但随后其表达逐渐增加,到28 d时恢复正常。以上结果说明,一次法咬合重建可使大鼠咬肌细胞的desmin发生降解,分析其原因可能为:咬合重建后咬肌肌纤维被动过度伸展,此时的被动张力可刺激敏感离子通道使钙离子内流,并使细胞内局部钙离子强度升高[15];细胞内升高的钙离子又可激活蛋白酶(如calpain),从而使desmin发生水解。
骨骼肌肌钙蛋白(Skeletal Troponin,sTn)存在于心肌和骨骼肌中,由3种亚基组成,分别为:肌钙蛋白C、肌钙蛋白I和肌钙蛋白T。TnI亚基为单一多肽链,是肌肉收缩的分子开关,可通过抑制细丝中肌动球蛋白的ATP酶活性而抑制肌球蛋白与肌动蛋白的结合,从而阻止肌肉的收缩[16]。有研究指出,sTnI可能是反映运动性骨骼肌损伤的一种特异性的早期敏感标志,但目前对运动性骨骼肌损伤后sTnI的早期升高机制还不是很清楚。本结果显示,与对照组相比,一次法咬合重建后第3天时sTnI的表达明显下降,第7天时达到最低,但随后其表达逐渐增加,到28 d时恢复正常。说明一次法咬合重建可使大鼠咬肌细胞的sTnI发生降解。Sorichter等[17]曾发现了一个占骨骼肌肌纤维sTnI总量3%~4%的小型sTnI胞浆池。田吉明等[18]也指出,不习惯性运动引起的细胞内钙离子 — 钙蛋白酶的激活机制导致的肌小结复合体的选择性降解,以及骨骼肌内存在的可溶性sTnI胞浆前体池共同导致了运动后血浆sTnI的早期迅速抬升。但有关一次法咬合重建后肌细胞内sTnI逐渐增加的机制仍不清楚,有待于进一步深入研究。
综上所述,一次法咬合重建后大鼠咬肌组织内desmin和sTnI发生了降解,但随着重建后咬合状态的持续,损伤表现逐渐消失,desmin和sTnI含量恢复正常。提示,一次法咬合重建可导致大鼠咬肌损伤,但这种损伤是可逆的,随着状态持续时间的延长,咬肌可逐步适应新的咬合功能状态,并恢复其正常功能。
[1]皮昕.口腔解剖生理学[M].6版 .北京:人民卫生出版社,1979:83.
[2] 潘新华.低位咬合的修复[J].国外医学口腔医学分册,1995,22(3):161.
[3]程永喜.56例牙合过度磨耗修复治疗的分析[J]. 广东牙病防治,1999,7(1):66.
[4]温映萍,邱伟平,江惠珍.升高咬合在临床中的应用[J]. 广东牙病防治,2001,9(2):140-141.
[5]李甜,于世宾,何惠明,等.渐进性咬合垂直距离降低对大鼠咬肌微观结构及线粒体Ca2+含量的影响[J]. 牙体牙髓牙周病学杂志,2013,23(2):95-99.
[6]马轩祥.口腔修复学[M].5版.北京:人民卫生出版社,2003:464.
[7]高杰,唐旭炎,刘世明.金属烤瓷牙治疗牙合面重度磨耗30例疗效分析[J].蚌埠医学院学报,2007,32(4):419-420.
[8]Rivera- Morales WC,Mohl D.Relationship of occlusal vertical dimension to the health of the masticatory system[J].JProsthetDent,1991,65(4):547.[9]党薇,于世宾,何惠明,等.不同开口度对大鼠咬肌及颞下颌关节的影响[J].牙体牙髓牙周病学杂志,2013,23(2) :100-103.
[10]白雪梅.大鼠心肌缺血再灌注后结蛋白的变化[J].中国医学创新,2013,10(26):6-8.
[11]段立公,李国平,李肃反..结蛋白和波形蛋白在运动性肌肉损伤和再生过程中表达及意义的实验研究[J].中国运动医学杂志,2001,20(2):167-170.
[12]Goebel HH,Bornemann Antje.Desmin pathology in neuromuscular disease[J].CellPathol,1993,64(3):127-135.
[13]Friden J, Kjorell U, Thornell LE.Delayed muscle soreness and cytoskeletal alterations:an immunocytological study in man[J].IntSportsMed,1984,5(1):15-18.
[14]Lieber RL,Friden J. Mechanisms of muscle injury after eccentric contraction[J].SciMedSport,1999,2(3):253-265.
[15]Guharay F,Sachs F.Stretch- activated single ion channel currents in tissue- cultured embryonic chick skeletal muscle[J].PhysiolLond,1984,352:685-701.
[16]Mukhopadhyay S,Langsetmo K,Stafford WF,etal. Identification of a region of fast skeletal troponin T required for stabilization of the coiled- coil formation with troponin I[J].TheJBiolChem,2005, 280(1):538-547.
[17]Sorichter S,Mair J,Koller A,etal. Skeletal muscle troponin I release and magnetic resonance imaging signal intensity changes after eccentric exercise- induced skeletal muscle injurv[J].ClinChimActa, 1997,262(1-2):139-146.
[18]田吉明,丁树哲.运动性骨骼肌损伤标志的研究进展[J].浙江体育科学,2001,23(1):52-54.
The effects of one- visit occlusal rehabilitation on the expression of injury- sensitive proteins in rat′s masseter muscle
CUI Jie*, YU Shi- bin, HE Hui- ming, ZHANG Chun- bao
(*DepartmentofProsthodontics,SchoolofStomatology,TheFourthMillitaryMedicalUniversity,Xi'an710032,China)
AIM: To investigate the effects of one- visit occlusal rehabilitation(OR) on the expression of desmin and skeletal troponin I (sTnI) in rat's masseter muscle. METHODS: 60 healthy 8- week- old male SD rats were randomly divided into control group (C), sham operation group (S) and one- visit OR group (T)(n=20). In T group, the crown height of the upper molars of the rats were shortened by 1.2 mm mechanically and gradually, 6 weeks later, the occlusal splints were made and adhered to the molar surface by resin bonding. In S group the sham operation was used, the controls were without any operation. 5 rats in every group were sacrificed at 3 d, 7 d, 14 d, and 28 d after operation respectively. The deep masseter muscles were excised, western blot method was used to detect the expression of desmin and sTnI. RESULTS: ① The expression of desmin and sTnI showed no significant difference between group C and S(P>0.05).② Desmin and sTnI in the masseter muscle in group T decreased 3 d after OR(P<0.05), decreased to the lowest level 7 d after OR(P<0.05), then began to increase gradually and reached the normal level 28 d after the OR(P>0.05). CONCLUSION: One- visit occlusal rehabilitation can cause the degradation of desmin and sTnI in masseter muscle. However, the damage is reversible.
one- visit occlusal rehabilitation; masseter muscle; desmin; skeletal troponin I
2014-07-29
全军后勤科研计划面上项目(CWS12J101)
崔洁(1989-),女,汉族,山西省人。硕士生(导师:何惠明)
何惠明,E-mail: hhming@fmmu.edu.com
R780.2
A
1005-2593(2015)01-0020-05

