NF2蛋白518位丝氨酸磷酸化状态对其分子内相互作用机制的结构生物学及生物化学研究
巩 微 徐海鸣 孙 昶 徐彦辉 李 泽 王 平
(复旦大学生物医学研究院结构生物学实验室 上海 200032)
NF2是由位于22号染色体上的抑癌基因NF2所编码的蛋白质,NF2基因的失活会造成神经性纤维瘤病Ⅱ型(neurofibromatosis type 2,NF2)的发生[1-2]。研究发现,NF2蛋白的异常可能导致散发性的许旺氏细胞瘤、脑脊膜瘤、室管膜瘤以及肾细胞癌、黑色素瘤、胶质母细胞瘤、大肠癌、乳腺癌等多种肿瘤的发生[3-9]。目前的研究表明,NF2可以在细胞质中以及细胞核中发挥不同功能。在成角质细胞和皮肤上皮中,NF2可以被招募到α-catenin处并促进α-catenin与Par3(pulmonary adenoma resistance 3)的相互结合,起到帮助黏附连接成熟的作用[10]。在紧密连接处,NF2通过与血管动蛋白结合释放Rich(GTPaseRac激活蛋白)来使Rac失活,调节细胞的接触抑制进而减弱有丝分裂信号,甚至可能有抑制肿瘤的作用[11-12]。在细胞核内,NF2可以与CRL4DCAF1结合并抑制其E3泛素连接酶活性,因为CRL4DCAF1可以调节许多与转录和表观遗传有关的蛋白质,NF2被认为在进入细胞核后可以对基因的表达进行调控[13-21]。另外,最新研究发现,NF2还可以通过 CRL4DCAF1调控 Lats1/2[22](large tumor suppressor kinase 1)或直接调控 Lats1/2[23],达到调节Hippo信号通路活性的目的。
NF2与 ERM(Ezrin,Radixin,Moesin)蛋白为同源蛋白,均属于Band 4.1超级家族[24]。这4种蛋白质的 N-端均有一个 FERM(Four-point one,Ezrin,Radixin,Moesin)结构域,C-端为一段亲水的尾巴,其间为coiled coil结构。这类蛋白质生物活性的调控可通过其分子内相互作用的改变来实现。与ERM蛋白相似,NF2特定位点的氨基酸被磷酸化后,其活性状态会发生改变,如NF2 C-端第518位丝氨酸可以被激活后的 PAK(P21-activated kinase)磷酸化,导致其分子内相互作用改变从而使蛋白失活[25]。虽然NF2活性的调节方式已经被研究得十分清楚,但是由于缺少全长结构,目前仍无法从原子水平证实NF2的分子内相互作用机制及其活性调节机制。
在NF2的十余种亚型中,关于NF2-1和NF2-2两种亚型的研究最多,其中NF2-1为主要表达的亚型(以下均称 NF2)[26]。自1997年起,多项研究认为,NF2-2不具有抑制肿瘤生长的活性,且其N端的FERM结构域和C端结构的分子内相互作用很弱,即其构象一直处于“开放”状态;有抑制细胞生长活性的 NF2与之相反,为“闭合”构象,即 N端FERM结构域与C端尾巴紧密结合,而失活的NF2为“开放”构象[25,27]。而较新的研究结果恰与此相反,研究认为,518位丝氨酸未被磷酸化的NF2与NF2-2均处于“开放”的构象,且具有抑制细胞生长的活性,而518位丝氨酸被磷酸化从而失活的NF2则处于“闭合”构象[28]。
有研究表明,NF2的518位丝氨酸突变为天冬氨酸后可以模拟该位点的组成型磷酸化,且NF2不再具有正常的抑制肿瘤生长的功能[29]。基于以上背景,本研究对野生型NF2WT和突变型NF2S518D(518位丝氨酸突变为天冬氨酸)进行了表达与纯化,希望通过结构生物学的手段,直接观察两种NF2的构象,进一步通过体外Pull-down实验和荧光共振能量转移实验,检测NF2的分子内相互作用,对NF2的分子内相互作用机制及其活性调节机制作出解释。
材料和方法
材料来源 NF2全长cDNA由复旦大学生物医学研究院MCB实验室管坤良教授馈赠;CFP和YFP荧光蛋白基因由华东理工大学杨弋教授提供;大肠埃希菌Top10和BL21(DE3)感受态菌株、原核表达载体pGEX6p-1-His、用于FRET实验的载体pET28-FRET、3C蛋白酶等均由本实验室制备;PCR引物购自Invitrogen公司;Phanta DNA聚合酶购自诺唯赞生物公司;KOD plus DNA聚合酶购自TOYOBO公司;限制性内切酶购自Takara公司;质粒抽提试剂盒购自Solarbio公司;胶回收、PCR产物回收试剂盒购自Axygen公司;蛋白纯化使用层析柱及柱材均购自GE Healthcare公司;结晶初筛商业试剂盒分别购自Hampton Research公司和Emerald BioStructures公司;各类试剂分别购自生工生物工程(上海)股份有限公司、国药集团化学试剂有限公司、AMRESCO公司、Sigma公司。
野生型NF2蛋白表达片段的构建 全长NF2共有595个氨基酸。通过Gene Runner软件分析cDNA序列并设计PCR引物(表1)。以人源NF2 cDNA作模板进行PCR扩增,回收DNA片段,使用BamHⅠ和EcoRⅠ分别对DNA片段及载体进行双酶切,回收酶切产物。片段和载体用T4酶连接后转入大肠埃希菌Top10中,在含相应抗生素的固体平板上培养,挑取单克隆以PCR方法检测阳性克隆。通过DNA测序的方法(上海铂尚生物技术有限公司)鉴定重组质粒的序列是否完全正确。

表1 针对野生型NF2不同蛋白表达片段的引物序列Tab 1 Primers used for different protein expression in wild type NF2constructs
突变体NF2蛋白表达片段的构建 将NF2的518位丝氨酸(Serine,S)突变为天冬氨酸(Asp,D)以模拟518位丝氨酸的磷酸化状态,重组蛋白称为NF2S518D。以测序正确的野生型NF2重组质粒为模板,用含有突变序列的PCR引物(表2)对目的片段进行扩增。用限制性内切酶DpnⅠ消化模板质粒,将产物转入大肠埃希菌Top10中,在含相应抗生素的固体平板上培养,挑取单克隆通过DNA测序的方法鉴定重组质粒的序列是否完全正确。
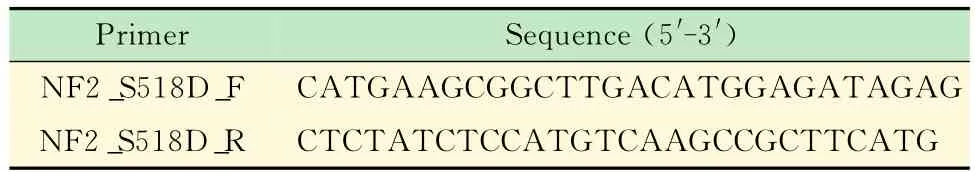
表2 用于突变体NF2结构的引物序列Tab 2 Primers used in mutate NF2constructs
NF2重组蛋白的表达与纯化 将鉴定正确的重组质粒转入大肠埃希菌BL21(DE3)中表达,经反复测试,使用2×YT培养基、低温(15℃)诱导表达的条件下,蛋白产量较高、性质较好。37℃培养至菌液的D值为0.6~0.8,降温至15℃,加入终浓度1 mmol/L的IPTG诱导重组蛋白的表达,低温培养16 h后收集菌体。菌体用裂解缓冲液充分重悬后高压破碎,细菌裂解液使用高速离心机30 996×g低温(4℃)离心40 min,收集上清液。接下来的步骤均在4℃冷库中进行。
将上清液缓缓通过Ni2+亲和层析柱,上样完毕后,使用洗涤缓冲液冲走非特异性吸附的杂蛋白。向吸附了目的蛋白的柱内加入1 mL浓度为0.5 mg/mL的3C蛋白酶,与柱材充分混匀,酶切过夜。不同的是,NF2 513-595和 NF2 513-595 S518D 为GST Pull-down的饵蛋白,亲和层析后直接用洗脱缓冲液洗脱,进行纯化及缓冲条件的更换。
用洗脱缓冲液洗脱充分酶切后的蛋白,稀释后使用AKTA Purifier蛋白纯化仪进行阴离子交换柱层析,用SDS-PAGE检测紫外吸收峰处的蛋白样品,收集浓度较高且杂带较少的蛋白样品,浓缩至1 mL以内。
利用凝胶过滤层析进一步纯化,同时更换缓冲液。用SDS-PAGE检测紫外吸收峰处蛋白样品,收集纯度高的目的蛋白样品浓缩至适合的浓度,分装于1.5 mL离心管中,液氮速冻后保存于-80℃冰箱中备用。
NF2重组蛋白晶体的筛选和优化 本研究采用气相悬滴法筛选和优化蛋白晶体,初筛使用商业化缓冲液(WizardⅠ、Ⅱ96个结晶条件,Crystal screenⅠ、Ⅱ96个结晶条件,Index 96个结晶条件,Salt 96个结晶条件,PEG/IonⅠ、Ⅱ96个结晶条件,PEG/RxⅠ、Ⅱ96个结晶条件),将NF2 18~595蛋白、NF2 18~595 S518D蛋白(均为10 mg/mL)与池液1:1混合。晶体在4℃或者18℃恒温箱内生长。3天后在倒置显微镜下观察液滴内是否有晶体长出,筛选到质量较好的晶体的初始生长条件后,根据初始生长条件分别对沉淀剂浓度、缓冲液pH进行变动,以上述相同方法筛选晶体。
对晶体进行防冻处理时,防冻液成分为晶体生长缓冲液加20%的甘油,采用慢平衡的方法处理,平衡好的晶体迅速转移至液氮中保存。
晶体数据收集及结构解析 在上海同步辐射光源SSRF-BL17U线站内CentOS操作系统中运行的Bluice控制系统控制收集晶体衍射数据,数据收集采用回摆法。
衍射数据收集完成后,使用HKL2000软件包[30]处理。采用分子置换法解析相位,依次用CCP4软件包[31]中scalepack2mtz、matthews_coef、phaser_MR用搜索模型进行分子置换,找到对应的解。随后在PHENIX软件包[32]中使用phenix.refine中刚体修正、拟退火修的测率进行修正。在COOT[33]中根据对应的电子密度图进行手动的搭建与修正,并用phenix.refine进行结构优化。通过多轮的手动搭建和软件优化确定最终的结构模型。最终根据R-work值和R-free值来评价模型搭建的质量并使用PROCHECK[34]来确定二面角等立体化学参数是否合理。
GST Pull-down实验 为检测518位丝氨酸的磷酸化对于NF2蛋白分子内相互作用的影响,将有GST融合标签的 NF2蛋白 GST-NF2 513-595、GST-NF2 513-595 S518D作为饵蛋白,与不含GST标签的靶蛋白(NF2 18~344)按照1∶10的摩尔比混合。结合缓冲液成分为20 mmol/L Tris-HCl(pH=8.0),110 mmol/L NaCl,体积分数分别为0.3%的Triton X-100和5%的甘油。4℃孵育2 h,12 000×g离心2 min后将上清与10μL用结合缓冲液平衡过的GST柱材混合孵育1 h。用缓冲液清洗GST柱材4~5次,用SDS-PAGE检测结合情况。
体外荧光共振能量转移(fluorescence resonance energy transfer,FRET)实验 为检测518位丝氨酸的磷酸化对NF2蛋白分子内相互作用的影响,将供体CFP荧光蛋白融合于NF2蛋白的N端,受体YFP荧光蛋白融合于蛋白的C端,检测NF2蛋白的荧光强度。CFP、YFP荧光蛋白距离在10 nm以内时,CFP被激发后的发射光与YFP吸收光光谱重叠,因而发生能量转移,供体CFP的荧光强度会大大降低,仅可检测到YFP发射光;若YFP与CFP相距较远,则YFP无法吸收CFP的发射光,因而只能检测到CFP的发射光。
实验组为融合有CFP和YFP的NF2蛋白,阴性对照组使用终浓度0.1%的SDS处理(使蛋白变性而构象开放),以430 nm波长激发光激发CFP并测量455~600 nm波长范围内的数值,每个孔的数值由Synergy4酶标仪读取,数据使用软件Microsoft Office Excel处理。
结 果
NF2重组质粒的构建 以往研究结果表明,NF2蛋白第518位丝氨酸的磷酸化对NF2的构象及生物功能均有重要影响。本研究采用518位丝氨酸突变为天冬氨酸以模拟S518磷酸化状态的策略,设计了用于晶体筛选、GST Pull-down实验和FRET实验的不同重组质粒(表3)。

表3 用于不同实验而设计的重组质粒Tab 3 Recombinant plasmids designed for different experimental purposes
NF2重组蛋白的表达与纯化 经过对缓冲液pH、盐浓度、添加剂以及纯化方式的反复优化,本研究最终选取Ni2+亲和层析-阴离子交换柱层析-凝胶过滤层析的纯化策略,各种缓冲液成分如下:
裂解缓冲液:50 mmol/L Tris-HCl (pH =8.0),300 mmol/L NaCl;洗涤缓冲液:50 mmol/L Tris-HCl (pH =8.0),300 mmol/L NaCl,25 mmol/L 咪唑;洗脱缓冲液:50 mmol/L Tris-HCl(pH=8.0),300 mmol/L NaCl,250 mmol/L咪唑;离子交换层析缓冲液 A:20 mmol/L Tris-HCl(pH=8.0),2 mmol/L DTT;离子交换层析缓冲液B:20 mmol/L Tris-HCl(pH=8.0),1 mol/L NaCl,2 mmol/L DTT;凝胶过滤层析缓冲液:20 mmol/L Tris-HCl(pH=8.0),150 mmol/L NaCl,及 2 mmol/L的DTT。
Ni2+-NTA对NF2-N蛋白有较强的吸附性,3C酶切除 His-GST标签。蛋白样品上样电导4.5 ms/cm,盐浓度线性梯度洗脱时,该蛋白的紫外吸收峰出现在电导12 ms/cm处,SDS-PAGE检测样品较为纯净。凝胶过滤层析后得到性质较好、纯度较高的蛋白样品。
NF2WT和NF2S518D蛋白用于晶体的筛选。点突变后的NF2蛋白性质并未发生明显的变化。Ni2+亲和层析后,3C酶切过夜除去His-GST标签。离子交换层析时,两种蛋白均在电导23 ms/cm处出现目标蛋白峰。用于FRET实验的FRET-NF2WT(CFP-NF2 18-595-YFP)和 FRET-NF2S518D(CFPNF2 18-595 S518D-YFP)使用凝胶过滤层析纯化。
NF2重组蛋白晶体的筛选和优化 分别使用纯度和浓度均较高的NF2WT和NF2S518D蛋白样品,依照前文所述方法,用576个商业化初筛条件筛选。最终两种蛋白晶体均在18℃、体积分数为10%的异丙醇、0.1 mol/L Tris(pH=8.5)的条件下产生。根据初始结晶条件,分别调整沉淀剂异丙醇的浓度(8%、10%、12%、14%)和缓冲液的pH(8.0、8.2、8.4、8.6、8.8、9.0),最终得到的晶体呈粗棒状(图1),经慢平衡防冻处理后冻于液氮中保存。防冻液条件为体积分数10%的异丙醇,0.1 mol/L Tris(pH=8.5),体积分数为20%的甘油。

图1 NF2WT和NF2S518D的晶体照片Fig 1 Crystals of NF2WT and NF2S518D
NF2晶体数据收集与结构解析 晶体衍射数据在上海同步辐射光源(SSRF)BL17U线站收集。衍射数据用HKL2000软件包进行处理,NF2WT和NF2S518D晶体最终衍射分辨率分别为3.60Å和3.90Å(图2)。
由于同家族蛋白的FERM结构域的结构已有报道,本课题采用FERM结构域(PDB:1ISN)作为模型进行分子置换。NF2WT和NF2S518D晶体的一个不对称单位均含有一个分子。采用上文所述方法对结构继续进行优化,数据收集、处理与结构优化结果统计见表4。
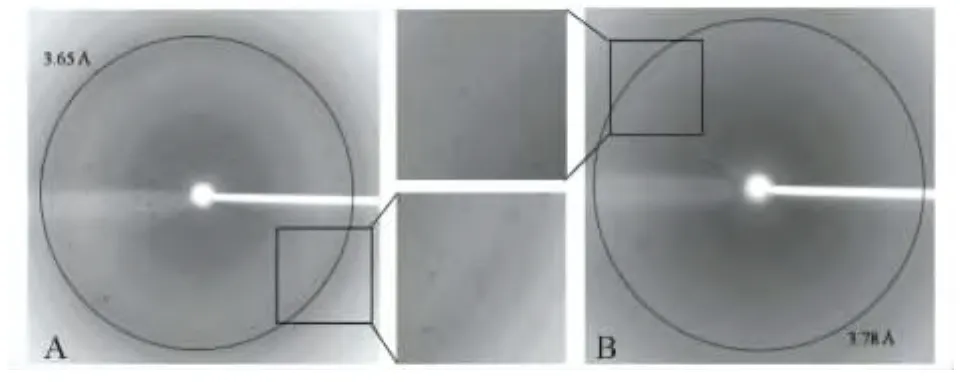
图2 NF2WT和NF2S518D的晶体衍射图及局部放大图Fig 2 X-ray diffraction pattern and enlarged images from crystals of NF2WT and NF2S518D
NF2蛋白的C-端在结晶过程中发生降解 结构中显示的氨基酸残基序列为20-361,其整体结构如图3A/B所示,两个结构均由FERM结构域和一段延伸在外的α螺旋组成。与以往文献[35-36]所述相似,FERM结构域由3个亚结构域组成(图3C):第1个亚结构域与泛素蛋白相似,由5条β折叠和1条α螺旋组成;第2个亚结构域与乙酰辅酶A结合蛋白相似,由4个α螺旋组成;第3个亚结构域则与PTB结构域相似,由1对正交的反向平行β折叠和1条α螺旋组成。
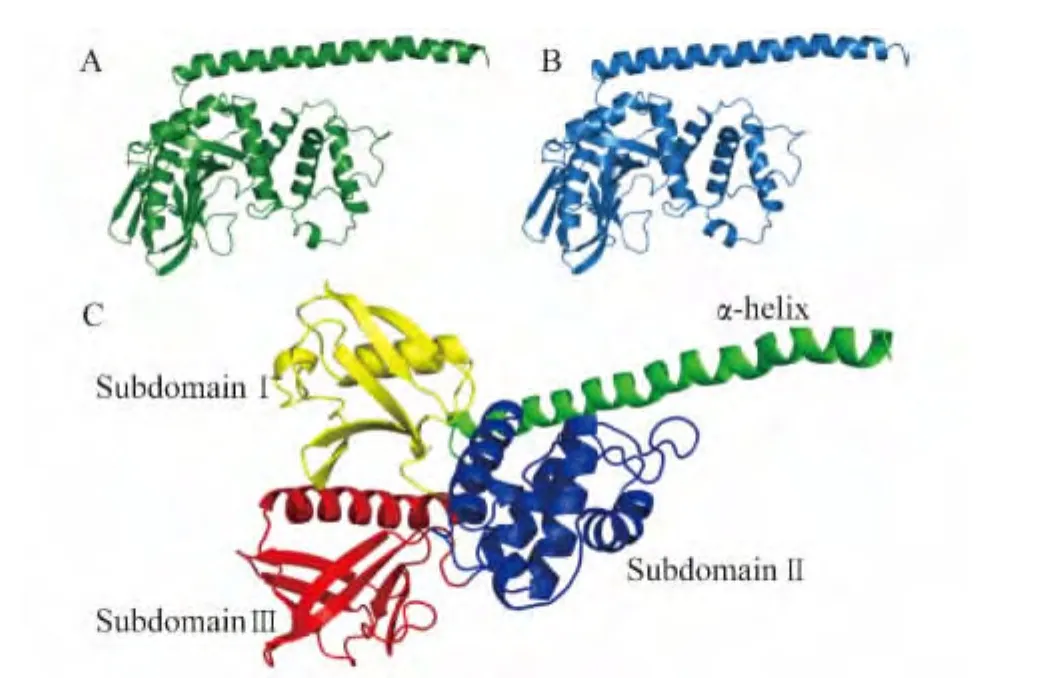
图3 NF2WT和NF2S518D的晶体结构及FERM结构域示意图Fig 3 Crystal structures and FERM domain of NF2WT and NF2S518D
对两种蛋白的晶体进行SDS-PAGE检测,发现两者均有降解,且主带对应相对分子质量(Mr)与20-361片段的(Mr)接近。同样地,纯化好的NF2蛋白样品也发生了不同程度的降解(图4A、B)。根据序列比对的结果(图4C),NF2蛋白的FERM结构域十分保守,NF2结构中延伸在外的α螺旋也较为保守,而其C端氨基酸序列则并不保守。实验证明,正是这段不保守的区域发生了降解。518位丝氨酸所在的C端蛋白片段并未出现在所解析结构中,可能是蛋白自身性质所造成的降解导致的,本课题未能成功解析2个蛋白的18~595序列的完整结构。

图4 NF2晶体及蛋白样品SDS-PAGE图与NF2蛋白序列比对Fig 4 SDS-PAGE of NF2crystals and proteins versus sequence alignment of NF2family proteins
NF2蛋白FERM结构域结构与同家族蛋白FERM结构域相似 通过NF2WT结构与NF2S518D结构的比对(图5A),发现两者的分子构象相似,因而后续结构比对仅使用NF2WT的结构。将本研究中所解析的结构NF2WT分别与已有的人源NF2 FERM 结构域(PDB:1H4R)、鼠源 Merlin FERM结构(PDB:1ISN)、人源 MOESIN部分结构(PDB:1E5 W)分别进行结构比对(图5B~D)。NF2WT的结构较之人源FERM结构域,其C端多一段向外延伸的α螺旋;与鼠源Merlin FERM结构域构象相似,C末端α螺旋长度不同,且其走向稍有不同;与人源MOESIN的FERM结构域、C末端α螺旋构象基本相似。

表4 NF2WT和NF2S518D蛋白晶体数据处理及结构解析参数Tab 4 Statistics of data collection,processing and refinement
综上所述,NF2蛋白N端的FERM结构域蛋白序列保守,三维结构亦与该家族中其他蛋白的FERM结构域相似,C末端α螺旋结构走向一致,提示该螺旋在NF2结构中的保守性,可能对C端结构域的走向起重要作用。
体外结合实验检测模拟磷酸化突变体调节NF2相互作用 采用GST Pull-down实验进一步研究NF2 N端和C端的相互作用。SDS-PAGE显示(图6),N端蛋白NF2-N与GST并无非特异性的结合,GST-NF2WT蛋白和GST-NF2S518D蛋白均可与N端序列有较强的结合,然而,在相同的蛋白用量时,GST-NF2S518D蛋白较 GST-NF2WT蛋白可以结合更多的NF2-N蛋白。该结果提示518位丝氨酸磷酸化后,NF2蛋白的C端与N端的结合可能更加紧密,分子内相互作用更强,因而NF2S518D的构象呈“闭合”状态,无模拟磷酸化突变的NF2相对而言呈“开放”构象。

图5 NF2的结构比对Fig 5 Structure alignment of NF2proteins

图6 GST Pull-down的SDS-PAGE实验结果Fig 6 SDS-PAGE result of GST Pull-down assay
FRET检测磷酸化模拟突变造成的NF2内部构象变化 为了进一步研究NF2蛋白分子内相互作用,我们开展了FRET实验。由标准化数据生成的图显示(图7),在激发光的作用下,经SDS变性解链的 FRET-NF2WT和 FRET-NF2S518D均未检测到FRET信号。在实验组中,相较FRET-NF2WT而言,FRET-NF2S518D组检测到了更强的FRET信号,即CFP和YFP距离更为接近。该结果与上文所述GST Pull-down结果一致,进一步表明:518位丝氨酸被磷酸化的NF2蛋白N端和C端的分子内相互作用更强。上述结果说明,NF2的518位丝氨酸被磷酸化后,蛋白处于“闭合”构象,与最新的研究结果[28]一致。

图7 FRET标准化曲线Fig 7 Standardized curve of FRET
讨 论
NF2是由抑癌基因NF2所编码的蛋白质,NF2基因的失活会造成神经性纤维瘤病Ⅱ型的发生。多项研究发现,NF2蛋白的异常可能导致散发性的许旺氏细胞瘤、脑脊膜瘤、室管膜瘤以及肾细胞癌、黑色素瘤、胶质母细胞瘤、大肠癌、乳腺癌等多种肿瘤的发生,且其参与众多体内关键信号途径如Hippo信号途径的调控。自1997年至2012年以来,多项研究认为,有抑制肿瘤细胞生长活性的NF2为“闭合”构象,即N端FERM结构域与C端尾巴紧密结合,而518位磷酸化后失活的NF2分子内相互作用变弱,呈“开放”构象。直至2012年有研究提出并实验验证了完全相反的结论。
为了澄清磷酸化对NF2调节构象变化的机制,本研究构建了野生型NF2WT和模拟518位丝氨酸组成型磷酸化的突变型NF2S518D两种重组质粒,并对两者进行了表达纯化和晶体的筛选,希望通过结构生物学的手段,从原子水平解读NF2蛋白的构象变化方式,对NF2的分子内相互作用机制及其活性调节机制作出更为直观的解释。除此之外,本研究进一步采用体外Pull-down实验及荧光共振能量转移实验,检测两种NF2蛋白的分子内相互作用,进而从生化水平验证两种蛋白的构象变化,对结论给予佐证。
实验证明,NF2蛋白与同家族蛋白FERM结构域无论在序列还是结构上均有很高的相似度。然而,其序列不保守的362~595段序列在纯化与结晶的过程中均发生很大程度的降解,致使18~595段完整序列的结构无法解析。解析出的部分结构与人源或鼠源同家族蛋白的N-端FERM结构域基本相似。
由于无法从原子水平看到518位丝氨酸磷酸化前后NF2蛋白构象的不同,本研究采用GST Pulldown及FRET的研究方法,在体外检测NF2蛋白N端和C端的分子间相互作用强度,从侧面求证蛋白内部相互作用关系。GST Pull-down实验结果表明:518位模拟磷酸化突变后,NF2蛋白的C端与N端的结合更加紧密,分子内相互作用更强。在FRET实验中,相较 FRET-NF2WT而言,FRETNF2S518D组检测到了更强的FRET信号,即CFP和YFP距离更为接近,发生了能量转移,进一步支持上述推断:溶液状态下的NF2蛋白在518位丝氨酸被磷酸化后,N端和C端的分子内相互作用更强。
综上所述,处于活性状态的NF2蛋白,其N端和C端分子内相互作用强度较弱,蛋白质整体呈“开放”状态,而518位丝氨酸被磷酸化后,NF2蛋白活性丧失,此时分子内相互作用较强,蛋白质处于“闭合”构象,这与最新的研究结果一致[28]。今后的研究中,我们拟进行突变体筛选以提高NF2蛋白自身稳定性,避免其分子内降解,有望从结构生物学的角度揭示NF2蛋白518位丝氨酸磷酸化对其构象调节进而调控肿瘤生长的分子机制。
致谢上海光源BL17U线站工作人员在晶体数据采集过程中提供了帮助。
[1] Rouleau GA,Merel P,Lutchman M,et al.Alteration in a new gene encoding aputative membrane-organizing protein causes neuro-fibromatosis type 2[J].Nature,1993,363(6429):515-521.
[2] Trofatter JA,MacCollin MM,Rutter JL,et al.A novel moesin-,ezrin-,radixin-like gene is a candidate for the neurofibromatosis 2 tumor suppressor[J].Cell,1993,72(5):791-800.
[3] Bianchi AB,Hara T,Ramesh V,et al.Mutations in transcript isoforms of the neurofibromatosis 2 gene in multiple human tumour types[J].Nat Genet,1994,6(2):185-192.
[4] Dalgliesh GL,Furge K,Greenman C,et al.Systematic sequencing of renal carcinoma reveals inactivation of histone modifying genes[J].Nature,2010,463(7279):360-363.
[5] Lau YK,Murray LB,Houshmandi SS,et al.Merlin is a potent inhibitor of glioma growth[J].Cancer Res,2008,68(14):5733-5742.
[6] Morrow KA,Das S,Metge BJ,et al.Loss of tumor suppressor Merlin in advanced breast cancer is due to post-translational regulation[J].J Biol Chem,2011,286(46):40376-40385.
[7] Papi L,De Vitis LR,Vitelli F,et al.Somatic mutations in the neurofibromatosis type 2 gene in sporadic meningiomas[J].Hum Genet,1995,95(3):347-351.
[8] Roche PH,Bouvier C,Chinot O,et al.Genesis and biology of vestibular schwannomas[J].Prog Neurol Surg,2008,21:24-31.
[9] Rustgi AK,Xu L,Pinney D,et al.Neurofibromatosis 2 gene in human colorectal cancer[J].Cancer Genet Cytogenet,1995,84(1):24-26.
[10] Gladden AB,Hebert AM,Schneeberger EE,et al.The NF2 tumor suppressor,Merlin,regulates epidermal development through the establishment of a junctional polarity complex[J].Dev Cell,2010,19(5):727-739.
[11] Okada T,Lopez-Lago M,Giancotti FG.Merlin/NF-2 mediates contact inhibition of growth by suppressing recruitment of Rac to the plasma membrane[J].J Cell Biol,2005,171(2):361-371.
[12] Yi C,Troutman S,Fera D,et al.A tight junctionassociated Merlin-angiomotin complex mediates Merlin's regulation of mitogenic signaling and tumor suppressive functions[J].Cancer Cell,2011,19(4):527-540.
[13] Angers S,Li T,Yi X,et al.Molecular architecture and assembly of the DDB1-CUL4A ubiquitin ligase machinery[J].Nature,2006,443(7111):590-593.
[14] Kassmeier MD,Mondal K,Palmer VL,et al.VprBP binds full-length RAG1 and is required for B-cell development and V(D)J recombination fidelity[J].EMBO J,2012,31(4):945-958.
[15] Kaur M,Khan MM,Kar A,et al.CRL4-DDB1-VPRBP ubiquitin ligase mediates the stress triggered proteolysis of Mcm10[J].Nucleic Acids Res,2012,40(15):7332-7346.
[16] Kim K,Heo K,Choi J,et al.Vpr-binding protein antagonizes p53-mediated transcription via direct interaction with H3 tail[J].Mol Cell Biol,2012,32(4):783-796.
[17] Kressel M,Schmucker B.Nucleocytoplasmic transfer of the NF2 tumor suppressor protein merlin is regulated by exon 2 and a CRM1-dependent nuclear export signal in exon 15[J].Hum Mol Genet,2002,11(19):2269-2278.
[18] Lee JM,Lee JS,Kim H,et al.EZH2 generates a methyl degron that is recognized by the DCAF1/DDB1/CUL4 E3 ubiquitin ligase complex[J].Mol Cell,2012,48(4):572-586.
[19] Li W,You L,Cooper J,et al.Merlin/NF2 suppresses tumorigenesis by inhibiting the E3 ubiquitin ligase CRL4(DCAF1)in the nucleus[J].Cell,2010,140(4):477-490.
[20] Tamori Y,Bialucha CU,Tian AG,et al.Involvement of Lgl and Mahjong/VprBP in cell competition[J].PLoS Biol,2010,8(7):e1000422.
[21] Yu C,Zhang YL,Pan WW,et al.CRL4 complex regulates mammalian oocyte survival and reprogramming by activation of TET proteins[J].Science,2013,342(6165):1518-1521.
[22] Li W,Cooper J,Zhou L,et al.Merlin/NF2 loss-driven tumorigenesis linked to CRL4 (DCAF1)-mediated inhibition of the hippo pathway kinases Lats1 and 2in the nucleus[J].Cancer Cell,2014,26(1):48-60.
[23] Yin F,Yu J,Zheng Y,et al.Spatial organization of Hippo signaling at the plasma membrane mediated by the tumor suppressor Merlin/NF2[J].Cell,2013,154(6):1342-1355.
[24] Bretscher A,Edwards K,Fehon RG.ERM proteins and merlin:integrators at the cell cortex[J].Nat Rev Mol Cell Biol,2002,3(8):586-599.
[25] Rong R,Surace EI,Haipek CA,et al.Serine 518 phosphorylation modulates merlin intramolecular association and binding to critical effectors important for NF2 growth suppression[J].Oncogene,2004,23(52):8447-8454.
[26] Stamenkovic I,Yu Q.Merlin,a"magic"linker between extracellular cues and intracellular signaling pathways that regulate cell motility,proliferation,and survival[J].Curr Protein Pept Sci,2010,11(6):471-484.
[27] Sherman L,Xu HM,Geist RT,et al.Interdomain binding mediates tumor growth suppression by the NF2 gene product[J].Oncogene,1997,15(20):2505-2509.
[28] Sher I,Hanemann CO,Karplus PA,et al.The tumor suppressor merlin controls growth in its open state,and phosphorylation converts it to a less-active more-closed state[J].Dev Cell,2012,22(4):703-705.
[29] Surace EI,Haipek CA,Gutmann DH.Effect of merlin phosphorylation on neurofibromatosis 2 (NF2)gene function[J].Oncogene,2004,23(2):580-587.
[30] Otwinowski Z,Minor W.Processing of X-ray diffraction data collected in oscillation mode[J].Methods Enzymol,1997,276(1):307-326.
[31] Winn MD,Ballard CC,Cowtan KD,et al.Overview of the CCP4 suite and current developments [J].Acta Crystallogr D Biol Crystallogr,2011,67(Pt 4):235-242.
[32] Adams PD,Afonine PV,Bunkoczi G,et al.PHENIX:a comprehensive Python-based system for macromolecular structure solution [J].Acta Crystallogr D Biol Crystallogr,2010,66(Pt 2):213-221.
[33] Emsley P,Lohkamp B,Scott WG,et al.Features and development of Coot[J].Acta Crystallogr D Biol Crystallogr,2010,66(Pt 4):486-501.
[34] Laskowski RA,MacArthur MW,Moss DS,et al.PROCHECK:aprogram to check the stereochemical quality of protein structures[J].J Appl Crystallogr,1993,26(2):283-291.
[35] Hamada K,Shimizu T,Matsui T,et al.Structural basis of the membrane-targeting and unmasking mechanisms of the radixin FERM domain[J].EMBO J,2000,19(17):4449-4462.
[36] Kang BS,Cooper DR,Devedjiev Y,et al.The structure of the FERM domain of merlin,the neurofibromatosis type 2 gene product[J].Acta Crystallogr D Biol Crystallogr,2002,58(Pt 3):381-391.

