小鼠青春期遭遇慢性温和应激对其成年后睡眠的影响
叶宸搏 罗艳佳 孙焕欣 杨素荣
(复旦大学基础医学院药理学系 上海 200032)
人的一生中约1/3的时间在睡眠中度过,良好的睡眠能够消除疲劳、增强免疫力、促进生长发育、延缓衰老、增强记忆[1-3]。青春期是童年到成年过渡的关键时期,对大脑发育至关重要。此时期睡眠限制可能永久性改变大脑发育[4]。我们之前研究发现慢性睡眠限制降低青春期动物空间学习记忆能力[5]。青春期也是应激敏感性的关键时间窗[6],青春期遭遇应激增加了成年后的焦虑样行为[7]。但青春期遭遇慢性温和应激(chronic mild stress,CMS)对成年后睡眠行为的影响尚未见报道。
研究表明,与应激相关的精神障碍常伴有睡眠异常。其中,睡眠潜伏期延长、早醒等被认为与抑郁相关[8-9]。焦虑患者抑郁发病率提高[10],但焦虑的睡眠问题尚不清楚。应激通常被视为扰乱睡眠的主要因素,许多关于应激与睡眠关系的研究都是基于动物模型。针对急性应激对睡眠的研究常使用单一方式一次性给予强烈应激,例如水浸[11]、乙醚暴露[12]、足底电击[13]等。而针对慢性应激对睡眠的研究常基于重复的较温和应激,例如间歇足底电击[14],长期交替给予不同的厌恶性刺激(倾斜笼子,食物剥夺,湿笼)[15]。以上方法所述的无论急性应激还是慢性应激对动物刺激较强烈,尤其慢性应激中长期交替给予不同的厌恶性刺激致使应激因素较多,有一定局限性。在啮齿动物中,青春期被认为在出生后21~59天[16]。本研究采用出生后28天(postnatal days 28,PND28)小鼠,使用之前报道方法[17]进行温和慢性应激,此方法压力源单一且温和,用于模拟青少年在日常生活中的慢性温和压力,成年后利用脑电(electroencephalogram,EEG)记录、高架十字迷宫(elevated plus maze,EPM)、自主活动(locomotor activity,LA)等方法检测动物行为。目的是探讨青春期CMS对成年后睡眠和情绪的影响,为青少年健康成长提供客观参考。
材料和方法
实验动物 SPF级3周龄雄性C57BL/6J小鼠(简称“C57小鼠”,中科院上海实验动物中心,许可证号SCXK(沪)2007-2005)。小鼠购入后,饲养在恒温(24±1)℃、恒湿60%±2%、隔音、12 h/12 h明暗周期(光照度≈100 lux,7:00开灯,19:00关灯)的环境中1周后用于实验。实验过程中尽量减少动物痛苦,实验方案得到复旦大学上海医学院动物管理委员会同意。
主要仪器和软件 脑立体定位仪(68002,深圳市瑞沃德生命科学有限公司);自主活动检测仪器、睡眠觉醒生物解析系统(Biotex,日本kissei Comtec株式会社);脑电波数据分析软件(SleepSign@3.0,日本),ANY-maze视频追踪系统(美国Stoelting公司)。
动物分组 将42只C57小鼠随机分为正常对照组和CMS组。造模结束后随机分为两批,一批埋置电极用于记录小鼠自发睡眠觉醒状态;另一批用于焦虑和自主活动检测。每组9~11只。
CMS模型的建立 模型组小鼠被单个放入束缚器进行束缚5 min(14:00~16:00),连续28天(PND28~55),对照组小鼠每天在同一时间放置在模型组小鼠旁使其自由活动5 min(图1B)。束缚器由有机玻璃管(长100 cm,内径24 cm)及可调节的有机玻璃塞组成,在束缚器前端留有直径为1 cm的小孔供小鼠呼吸。束缚时通过有机玻璃塞调节管体长度,使模型组小鼠恰好不能活动。
电极埋置及脑电记录 小鼠造模结束后第1天(PND56)进行记录电极埋置手术(图1B)。在水合氯醛(360 mg/kg,i.p.)麻醉下,剃去小鼠头颈部毛发并将其固定在脑立体定位仪上,75%酒精清洁手术区。EEG电极为2个直径为1mm的不锈钢螺丝,分别埋置在前囟前1.0mm,旁开1.5 mm,和后囟前1.0mm,旁开1.5 mm的位置。两根肌电(electromyogram,EMG)电极分别插入颈部两侧的斜方肌内,最后将连接电极的微型插头用牙托粉固定在小鼠头骨上,涂撒青霉素钠,缝合创口。随后将小鼠放置在37℃恒温电热板上至自然苏醒后放入恢复笼中饲养。术后恢复7天后,小鼠被单独接入睡眠记录系统的记录箱中,适应记录系统3天,连续记录24 h EEG和EMG,用于睡眠觉醒研究。
EEG/EMG解析 待EEG/EMG记录完成后,使用SleepSign解析软件(日本Kissei Comtec株式会社)按照设定标准(图1A)以10 s为基本单位进行自动扫描并判定出觉醒W(wake)、非快动眼睡眠S(non-rapid eye movement sleep,NREM)和快动眼睡眠R(rapid eye movement sleep,REM)。进行人工核查,必要时修正[18]。根据判别标准,NREM(S)时,EEGδ波(0.5~5 Hz)占优势,波幅大,EEG安静;REM(R)时,EEGθ波(6~9 Hz)占优势,波幅较小,EMG最安静;觉醒(W)时,EEG波幅最小,EMG活跃。
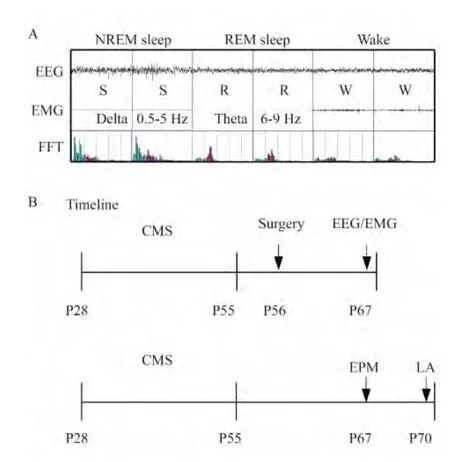
图1 Sleepsign软件解析标准(A)及实验流程图(B)Fig1 Analysis standard for Sleepsign(A)and schematic chart of the timeline for CMS exposure and behavioral tests(B)
EMP检测 小鼠焦虑行为使用EMP进行检测。小鼠造模结束后第12天(PND67)用EPM检测小鼠焦虑行为(图1B)。该装置是由黑色有机玻璃制成的4个相互垂直的等距离长度的臂(长36 cm,宽6 cm,离地面高75 cm)和中央区域(6 cm×6 cm)组成。其中,闭臂挡板高度为19 cm。装置被划分为5个区域:2个开臂,2个闭臂,1个中央区域。实验时,小鼠头朝开臂被单独放在中央区域使其自由探索5 min,使用ANY-maze视频追踪系统以小鼠四肢全部进入同一区域时才计为进入该区域为判断标准,记录小鼠在各个区域的活动情况。每只动物测试后用棉布蘸少量清水将各个臂彻底清洗并擦干以排除残留气味对小鼠行为的影响[19]。
自主活动检测 小鼠进行EMP检测后立即接入自主活动检测设备中使其适应环境2天,随后进行24 h LA记录(图1B)。小鼠单独置于28 cm×16.5 cm透明笼中,相邻鼠笼间距离为14 cm,红外线摄像头固定于距笼底17.5 cm的正上方,采用破坏红外光束法(infrared beam-breaking assays)检测自主活动。选择5 min作为采集间隔点,用于记录动物活动量。
结 果
CMS增加小鼠成年后的NREM睡眠小鼠睡眠觉醒时程图显示CMS小鼠在进入开灯期第1 h(7:00~8:00)REM明显减少,关灯期第1h(19:00~20:00)觉醒显著减少(图2A)。小鼠睡眠觉醒时相相关累积图显示CMS小鼠在开灯期(12 h)NREM 睡眠量显著增加;关灯期(12 h)有NREM睡眠量增加趋势;在整个节律周期(24 h),NREM睡眠量显著增加且觉醒显著减少(图2B)。此结果表明小鼠青春期遭遇CMS降低了成年后刚进入开灯期的深度睡眠和刚进入关灯期的觉醒,NREM睡眠在开灯期及整个节律周期都显著增加。

图2 小鼠青春期遭遇CMS后在成年期睡眠觉醒时程图Fig 2 CMS during adolescence induced alterations on time course(A)and amounts of sleep and wakefulness(B)in adulthood
CMS引起小鼠成年后睡眠觉醒片段次数改变和NREM睡眠深度降低 CMS小鼠在开灯期20 s短觉醒片段出现次数显著减少(图3A),而NREM睡眠在开灯期、关灯期及整个24 h节律周期都在~1 120 s长片段出现次数显著增加(图3A~C)。此结果与时相相关累积图(图2B)NREM睡眠增加保持一致,说明CMS小鼠NREM睡眠量增加是由于~1 120 s长片段的增加造成的。
NREM睡眠能谱分析显示CMS小鼠在δ波段(0.5~5 Hz)百分比显著降低,向δ(10~15 Hz)、β(16~23 Hz)高频率段转移(图3D~E)。此结果说明小鼠青春期遭遇CMS引起成年后NREM睡眠深度降低。
CMS小鼠成年后在睡眠觉醒时相转换后第1h内引起睡眠觉醒结构的改变 开灯期第1 h,CMS小鼠REM睡眠~128 s中片段次数显著减少,NREM睡眠~256 s中片段次数显著减少(图4A)。REM睡眠平均持续时间有较明显的减少趋势(P=0.05,图4C);睡眠觉醒状态转换次数都有减少趋势,其中REM向觉醒转换次数显著减少(图4D)。CMS小鼠关灯期第1 h NREM睡眠~560 s片段次数显著增加(图4B)。NREM睡眠平均持续时间有显著增加(图4C)。上述结果说明CMS小鼠开灯期第1 hREM睡眠总量的减少(图2A)主要表现为中片段(~140 s)出现次数、平均持续时间(图4A、C)减少;CMS小鼠而关灯期第1 h觉醒结构无明显减少(图表未列出),但觉醒总量减少(图2A),这种减少可能与此时期NREM睡眠在~560 s中片段出现次数显著增加(图4B)及平均持续时间明显延长(图4C)有关。
CMS使小鼠成年后产生焦虑样行为和降低自主活动 与造模前(PND28)相比,对照组小鼠在进入成年期(P55)后体质量显著增加,CMS小鼠体质量也存在相应增加,但与对照组相比,CMS小鼠体质量显著减少(图5A),此结果表明小鼠青春期遭遇CMS使其体质量增长减慢。

图3 小鼠青春期遭遇CMS后成年期睡眠觉醒片段出现次数(A、B、C)和NREM睡眠能谱分析(D、E)Fig 3 Episode number analysis of sleep-wake behavior(A,B,C)and power density analysis of NREM sleep(D,E)after CMS during adolescence in mice
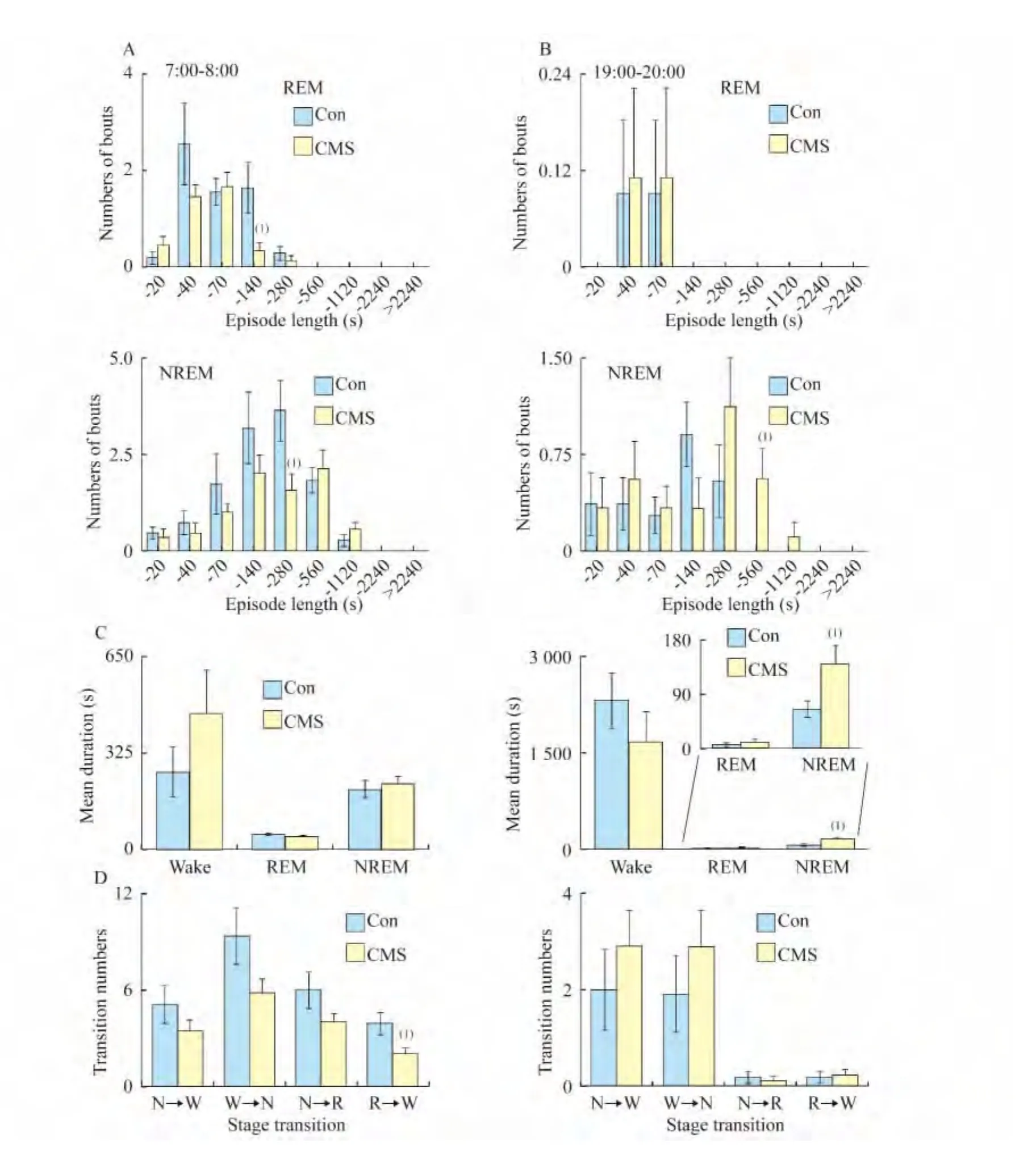
图4 小鼠青春期遭遇CMS在成年期睡眠觉醒时相转换后第1h各阶段睡眠觉醒结构分析Fig 4 Episode numbers,mean durations and stage transition during the 1st h after light on/light off in mice suffering CMS during adolescent stage
造模后第12天(PND67)使用EMP进行焦虑样行为检测。与对照组相比,CMS小鼠停留开臂时间及进入开臂次数均显著减少(图5B),显示青春期遭遇CMS使小鼠在成年后产生焦虑样行为。
造模后第15天(PND70)检测小鼠自主活动。与对照组相比,CMS小鼠在开灯期、关灯期以及整个节律周期(24 h)自主活动次数都显著减少(图5C)。时程图显示CMS小鼠在开灯后第1 h(7:00~8:00)、第8 h(14:00~15:00),熄灯后第1 h(19:00~20:00)、第3 h(21:00~22:00)、第5 h(23:00~24:00)、第9 h(3:00~4:00)活动次数出现显著减少(图5D)。该结果显示,青春期遭遇CMS使小鼠在成年后自主活动次数明显减少。

图5 小鼠青春期遭遇CMS使其成年后产生焦虑样行为(B)和自主活动次数减少(C、D)Fig 5 CMS during adolescence produced anxiety-like behavior(B)and decreased locomotor activity(C,D)in adulthood
讨 论
本研究对青春期小鼠进行CMS模拟日常潜在压力,探讨此时期给予温和应激对成年后睡眠及情绪的影响。结果表明,青春期CMS使小鼠体质量显著减少,这与之前报道啮齿类动物在青春期对压力引起的体质量丢失更敏感一致[20],提示青春期给予CMS可能影响了青春期到成年期身体的发育。
在临床上,社交焦虑障碍患者(generalized anxiety disorder,GAD)常倾诉睡眠维持困难,睡后无恢复感[21],但与正常人相比多导睡眠图上却未见差异[22-23]。我们实验结果中也未出现觉醒量的显著增加,反而NREM睡眠有所增加。值得注意的是NREM睡眠深度却显著降低。此结果与临床上GAD倾诉睡后无恢复感相一致。另外,我们发现,与对照组相比,CMS小鼠在睡眠觉醒时相转换后第1 h存在显著的睡眠障碍。在开灯期第1 h,REM睡眠平均持续时间的减少和中片段(~140 s)出现次数的减少使REM总量减少,说明CMS小鼠降低了此时期的深睡眠;在关灯期第1 h,CMS小鼠表现为觉醒量减少,觉醒结构无明显减少,这种减少可能与此时期NREM睡眠在~560 s出现次数显著增加及平均持续时间明显延长有关。此结果说明青春期给予慢性温和应激引起小鼠成年后进入睡眠期(开灯期)时睡眠深度出现延迟,这与临床上焦虑患者反应睡眠潜伏期延长相一致;进入活动期(关灯期)时觉醒的降低与临床上焦虑患者反应苏醒后精神欠佳相一致。与对照组相比,CMS小鼠自主活动次数的减少和NREM睡眠增多相一致。
视交叉上核(suprachiasmatic nucleus,SCN)常被称为“昼夜节律生物钟”,参与哺乳动物一系列生理行为和活动的调节。相关研究证实,大部分昼行性相关行为和生理机能受视交叉上核的节律基因调控[24]。而夜间自主活动的降低和视交叉腹外侧核活动受抑制有关[25]。另有报道提出生物钟可能促进睡眠或觉醒[26,27]。长时间光照可破坏SCN活动从而产生焦虑样行为[28]。我们推断青春期遭遇CMS小鼠在成年后出现焦虑样行为、自主活动减少、睡眠障碍,尤其在睡眠觉醒时相转换后第1 h引起睡眠障碍与SCN特定神经元的活动异常相关,具体机制有待进一步研究。
当今社会,青少年在日常生活中经受各方面的潜在压力。这种压力可能对成年后的心理健康产生影响。本研究结果表明,青春期遭遇CMS使小鼠成年后产生显著的睡眠障碍和焦虑样症状。此结果提示,减少青少年日常压力或许能减轻成年后睡眠障碍及焦虑的发生率。
致谢 复旦大学基础医学院药理学系黄志力教授和曲卫敏教授为本研究提供了实验技术指导。
[1] Xie M,Yan J,He C,et al.Short-term sleep deprivation impairs spatial working memory and modulates expression levels of ionotropic glutamate receptor subunits in hippocampus[J].Behav Brain Res,2015,286:64-70.
[2] Ota SM,Moreira KD,Suchecki D,et al.Lithium prevents REM sleep deprivation-induced impairments on memory consolidation[J].Sleep,2013,36(11):1677-1684.
[3] Alvarenga TA,Patti CL,Andersen ML,et al.Paradoxical sleep deprivation impairs acquisition,consolidation,and retrieval of a discriminative avoidance task in rats[J].Neurobiol Learn Mem,2008,90(4):624-632.
[4] Shaffery JP,Lopez J,Bissette G,et al.Rapid eye movement sleep deprivation in post-critical period,adolescent rats alters the balance between inhibitory and excitatory mechanisms in visual cortex[J].Neurosci Lett,2006,393(2-3):131-135.
[5] Yang SR,Sun H,Huang ZL,et al.Repeated sleep restriction in adolescent rats altered sleep patterns and impaired spatial learning/memory ability[J].Sleep,2012,35(6):849-859.
[6] Heim C,Nemeroff CB.The role of childhood trauma in the neurobiology of mood and anxiety disorders:preclinical and clinical studies[J].Biol Psychiatry,2001,49(12):1023-1039.
[7] Mccormick CM,Smith C,Mathews IZ.Effects of chronic social stress in adolescence on anxiety and neuroendocrine response to mild stress in male and female rats[J].Behav Brain Res,2008,187(2):228-238.
[8] Benca RM,Okawa M,Uchiyama M,et al.Sleep and mood disorders[J].Sleep Med Rev,1997,1(1):45-56.
[9] Steiger A,Kimura M.Wake and sleep EEG provide biomarkers in depression[J].J Psychiatr Res,2010,44(4):242-252.
[10] Brown CS.Depression and anxiety disorders[J].Obstet Gynecol Clin North Am,2001,28(2):241-268.
[11] Smith C.Sleep states and memory processes[J].Behav Brain Res,1995,69(1-2):137-145.
[12] Bodosi B,Obal FJ,Gardi J,et al.An ether stressor increases REM sleep in rats:possible role of prolactin[J].Am J Physiol Regul Integr Comp Physiol,2000,279(5):R1590-R1598.
[13] Palma BD,Suchecki D,Tufik S.Differential effects of acute cold and footshock on the sleep of rats[J].Brain Res,2000,861(1):97-104.
[14] Kant GJ,Pastel RH,Bauman RA,et al.Effects of chronic stress on sleep in rats[J].Physiol Behav,1995,57(2):359-365.
[15] Gronli J,Murison R,Bjorvatn B,et al.Chronic mild stress affects sucrose intake and sleep in rats[J].Behav Brain Res,2004,150(1-2):139-147.
[16] Tirelli E,Laviola G,Adriani W.Ontogenesis of behavioral sensitization and conditioned place preference induced by psychostimulants in laboratory rodents[J].Neurosci Biobehav Rev,2003,27(1-2):163-178.
[17] Parihar VK,Hattiangady B,Kuruba R,et al.Predictable chronic mild stress improves mood,hippocampal neurogenesis and memory[J].Mol Psychiatry,2011,16(2):171-183.
[18] Qu WM,Huang ZL,Xu XH,et al.Dopaminergic D1 and D2 receptors are essential for the arousal effect of modafinil[J].J Neurosci,2008,28(34):8462-8469.
[19] Rodgers RJ, Johnson NJ.Factor analysis of spatiotemporal and ethological measures in the murine elevated plus-maze test of anxiety [J].Pharmacol Biochem Behav,1995,52(2):297-303.
[20] Chiba S,Numakawa T,Ninomiya M,et al.Chronic restraint stress causes anxiety- and depression-like behaviors,downregulates glucocorticoid receptor expression,and attenuates glutamate release induced by brain-derived neurotrophic factor in the prefrontal cortex[J].Prog Neuropsychopharmacol Biol Psychiatry,2012,39(1):112-119.
[21] Anderson DJ,Noyes RJ,Crowe RR.A comparison of panic disorder and generalized anxiety disorder[J].Am J Psychiatry,1984,141(4):572-575.
[22] Papadimitriou GN,Linkowski P.Sleep disturbance in anxiety disorders[J].Int Rev Psychiatry,2005,17(4):229-236.
[23] Uhde TW,Cortese BM,Vedeniapin A.Anxiety and sleep problems:emerging concepts and theoretical treatment implications[J].Curr Psychiatry Rep,2009,11(4):269-276.
[24] Belle MD,Diekman CO,Forger DB,et al.Daily electrical silencing in the mammalian circadian clock[J].Science,2009,326(5950):281-284.
[25] Cormier HC,Della-Maggiore V,Karatsoreos IN,et al.Suprachiasmatic vasopressin and the circadian regulation of voluntary locomotor behavior[J].Eur J Neurosci,2015,41(1):79-88.
[26] Franken P,Dijk DJ.Circadian clock genes and sleep homeostasis[J].Eur J Neurosci,2009,29(9):1820-1829.
[27] Mistlberger RE.Circadian regulation of sleep in mammals:role of the suprachiasmatic nucleus[J].Brain Res Brain Res Rev,2005,49(3):429-454.
[28] Tapia-Osorio A,Salgado-Delgado R,Angeles-Castellanos M,et al.Disruption of circadian rhythms due to chronic constant light leads to depressive and anxiety-like behaviors in the rat[J].Behav Brain Res,2013,252:1-9.

