利用响应面法优化枯草芽孢杆菌产尿苷发酵培养基*
郭磊,吴鹤云,张成林,2,3,徐庆阳,2,3,谢希贤,2,3,陈宁,2,3
1(天津科技大学生物工程学院,天津,300457)
2(天津市氨基酸高效绿色制造工程实验室,天津,300457)
3(代谢控制发酵技术国家地方联合工程实验室,天津,300457)
尿苷(Uridine)是一种重要的核苷类物质,参与生物体的生命活动,是合成碘苷、溴苷及氟苷等核苷类抗病毒抗肿瘤药物的中间体,具有很高的医用价值及广阔的市场前景[1-2]。
尿苷生产方法主要为RNA水解法和化学合成法,前者面临优质原材料分离困难和产品的产销失衡等关键问题,后者由于使用大量的有机试剂而造成对环境的不友好且因步骤繁琐、难度高、周期长,导致无法实现大规模工业化生产[3]。
随着微生物育种技术的发展,微生物发酵法生产尿苷也逐渐成为国内外研究的热点。该方法的生产菌株主要为枯草芽孢杆菌(Bacillus subtilis),因其戊糖磷酸途径强且磷酸单酯酶活力高而较其他微生物更具有产苷潜力[4-7]。
本实验室经过前期菌种选育已获得1株具备尿苷积累能力的枯草芽孢杆菌B.subtilisUR1。通过摇瓶发酵实验发现,培养基成分的改变在影响菌体生长的同时,也对尿苷的积累量影响很大。为了使菌株产苷能力得到更大的提高,对有必要对培养基成分进行优化。
目前常用的培养基优化方法主要有单因素实验设计、正交实验设计和响应面法[8-11]。其中响应面法具有实验次数少,周期短,精度高,考察全面等优点,是降低开发成本、提高产品质量的一种有效方法,已成功应用到食品、生物、化工等诸多领域[12-13]。
本文采用响应面法系统地对菌株产尿苷发酵培养基进行优化,以提升尿苷积累量,也为尿苷的产业化提供借鉴。
1 材料与方法
1.1 材料
菌种:枯草芽孢杆菌B.subtilisUR1(△hom、△pyrR、△pdp、△nupC、△xylR::prsNL、pyrABTTKV),天津科技大学生物工程学院代谢工程研究室保存。
斜面培养基(/L):葡萄糖1 g,蛋白胨10 g,牛肉膏 10 g,酵母粉 5 g,NaCl 2.5 g,琼脂 20 g。
种子培养基(/L):葡萄糖20 g,豆粕水解液20 mL,酵母粉 10 g,NaCl 2.5 g,MgSO4·7H2O 1 g,KH2PO41 g,谷氨酸钠 5 g,L-苏氨酸(L-Threonine,Thr)、L-甲硫氨酸(L-Methionine,Met)、L-异亮氨酸(LIsoleucine,Ile)各 0.03 g,VB3、VB5、VB12各 0.1 mg。
初始发酵培养基(/L):葡萄糖80 g,豆粕水解液30 mL,酵母粉 15 g,玉米浆 20 mL,MgSO4·7H2O 8 g,(NH4)2SO415 g,KH2PO42.5 g,谷氨酸钠 15 g,Thr、Met、Ile 各 0.03 g,VB3、VB5、VB12各 0.1 mg。
优化发酵培养基(/L):葡萄糖80 g,豆粕水解液41 mL,酵母粉 25.6 g,玉米浆 20 mL,MgSO4·7H2O 8 g,(NH4)2SO415 g,KH2PO42.5 g,谷氨酸钠 25.2 g,Thr、Met、Ile 各 0.03 g,VB3、VB5、VB12各 0.1 mg。
1.2 实验方法
1.2.1 培养方法
1.2.1.1 斜面培养
用接种环接种1环从-80℃取出的冻存菌液,均匀划线于斜面培养基上,37℃培养12 h,并传代1次。
1.2.1.2 种子培养
用接种环刮取1环斜面种子接种于装有30 mL种子培养基的500 mL三角瓶中,9层纱布封口,37℃,200 r/min振荡培养10 h。
1.2.1.3 发酵
吸取3 mL种子液接种于装有27 mL发酵培养基的500 mL挡板三角瓶中,9层纱布封口,37℃,200 r/min振荡培养72 h。
1.2.1.4 取样
分别在培养时间12、24、36、48和60 h时刻用无菌移液管于无菌操作间中吸取发酵液1 mL,测定生物量及残糖量。
1.2.1.5 补糖
以经高压蒸汽灭菌(115℃,15 min)后的浓度为800 g/L的葡萄糖为母液,根据菌体耗糖速率补入所需量。
1.2.2 分析方法
1.2.2.1 生物量测定
取发酵液200 μL加入到9.8 mL去离子水中充分混匀,以经过同样处理的空白培养液作为参比,用分光光度计测定其OD600值,OD600×50即为生物量。
1.2.2.2 残糖测定
将发酵液于室温13 000 r/min离心2 min,取上清液10 μL加入至990 μL去离子水中充分混匀,然后取25 μL采用SBA-40E系列生物传感分析仪(山东省科学院生物研究所)测定其残糖量,所测值×100即为发酵液中的残糖量,单位为mg/100 mL。
1.2.2.3 尿苷产量测定
取离心后的发酵液上清液100 μL加入到900 μL去离子水中,以1 g/L尿苷作为标准样品并作相同的稀释处理,全部样品经过0.45 μm滤膜过滤后采用HPLC测定发酵液中尿苷产量。采用的色谱柱为Phenomenex Gemini 5u C18110A 150 mm ×4.6 mm,柱温30 ℃,流动相为V(乙腈)∶V(水)=2∶98,流速1 mL/min,进样量为 10 μL,分析时间 12 min。
1.2.2.4 单位菌体产苷量
以每组发酵结束后产苷量与生物量(OD600)的比值来衡量单位菌体产苷量[g/(L·OD600)]。
2 结果与讨论
2.1 PB实验设计筛选影响尿苷产量的显著因素
PB实验设计是由Plackett-Burman提出的一种基于不完全平衡块原理的2水平部分因子实验设计。它是一种筛选实验设计,能以最少的实验次数和尽可能高的精确度从众多实验因子中识别出对响应值影响最大的因素[14-15]。
在前期实验确定的葡萄糖初始浓度80 g/L的基础上,本实验采用N=12的PB设计,对初始发酵培养基中豆粕水解液,酵母粉,玉米浆,(NH4)2SO4,Mg-SO4·7H2O,KH2PO4,谷氨酸钠,Thr、Met、Ile,VB3、VB5、VB12,共计9种成分进行考察,每个因素取2个水平-高水平(+)和低水平(-),其中高水平为低水平的1.5倍,响应值Y为尿苷产量(g/L)。实验设计及发酵72 h后尿苷产量见表1。利用Minitab16软件对结果进行分析,各因素的编码水平、主效应分析见表2。其中P值大小代表了该因素的显著性水平,P<0.05说明该因素效应显著,P<0.01则效应极显著。由结果可知,酵母粉、谷氨酸钠、豆粕水解液、MgSO4·7H2O为对尿苷产量有显著影响的因素,选取前三者进行进一步优化。

表1 N=12的Plackett-Burman实验设计及响应值Table 1 Experimental design and response values of Plackett-Burman(N=12)
2.2 最陡爬坡实验
响应面拟合方程只在考察区域的领域范围内较真实地反映真实情况,而在远离该领域范围时几乎无相关性。因此,根据PB实验得出的初步结果,结合各因子变化的方向,选取合适的步长,利用最陡爬坡实验来寻找响应面分析的中心点往往被当作不可缺少的一项预实验来进行[16-17]。
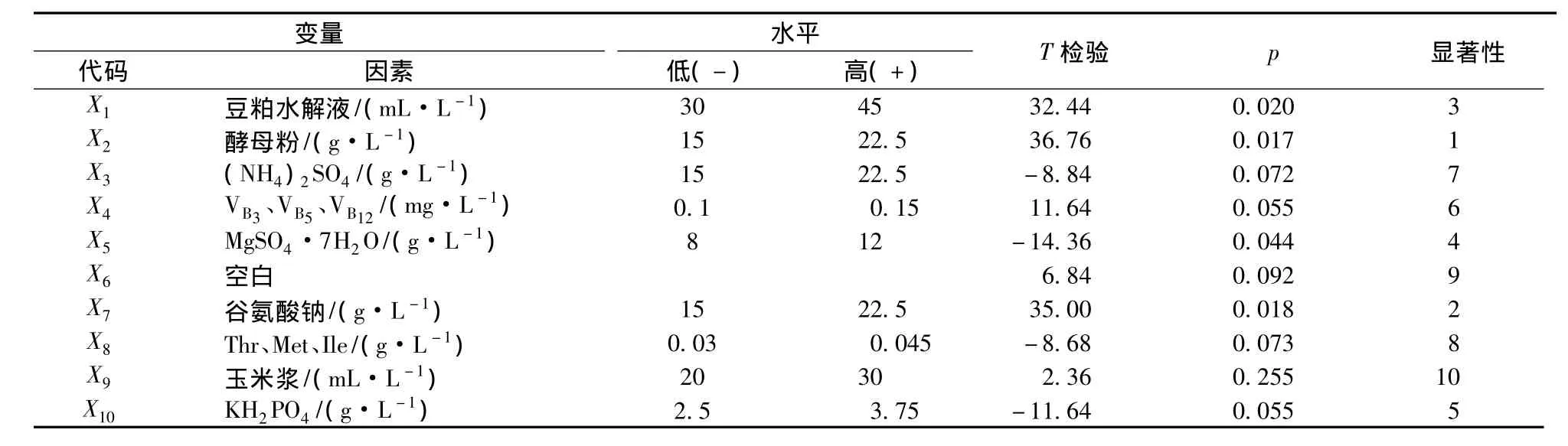
表2 各因子实验水平及主效应分析Table 2 Levels of variables and analysis of the main effect
根据表2的分析结果,酵母粉、谷氨酸钠、豆粕水解液都具有显著的正效应,都应增加。因此,根据三者的效应大小确定了最陡爬坡实验的步长及变化方向,其余因素均取初始水平。最陡爬坡实验设计及结果见表3。由结果可知,最佳因素浓度的条件位于第7组附近,故取第7组实验条件为中心点实施下一步的响应面分析。

表3 最陡爬坡实验设计及结果Table 3 Experimental design and results of steepest ascent
2.3 中心复合实验设计及结果
根据之前实验的结果,采用中心复合实验设计进行3因素5水平的响应面分析实验。以发酵72 h后尿苷的产量Y(g/L)为响应值,以2.3中第7组实验条件为中心点,各因素的编码水平见表4,中心复合实验设计及结果见表5。

表4 中心复合实验设计各因素及水平Table 4 Factors and levels of central composite design

表5 中心复合实验设计及结果Table 5 Central composite design and corresponding results
利用Minitab 16软件对实验结果进行分析,并拟合出响应值Y与A、B、C三因素之间的二次回归模型为:
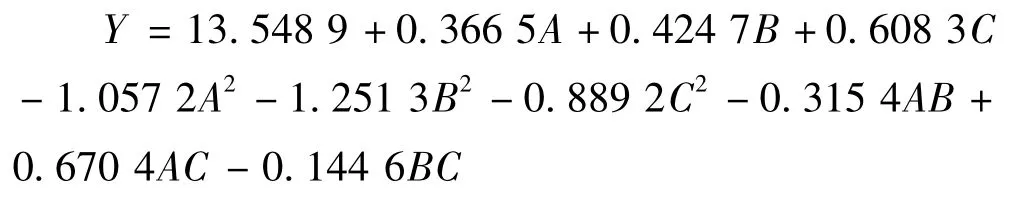
该回归模型的方差分析及可信度分析分别见表6和表7。由表6可以看出,该模型的F值为149.73,P(Prob>F)<0.000 1,说明该模型显著。由可信度分析表可知,该模型的复相关系数R2=0.992 6,说明模型可以解释99.26%的实验所得出的尿苷产量的变化,模型拟合度良好。变异系数CV值表示实验的精确度,值越低代表实验可靠性越高。本实验CV=1.79%,说明实验操作可信。Adeq Precision代表信噪比,通常情况下其值应大于4,本实验为30.449,进一步说明该模型可以很好地驾驭整个实验空间。综上,模型的选取基本正确。
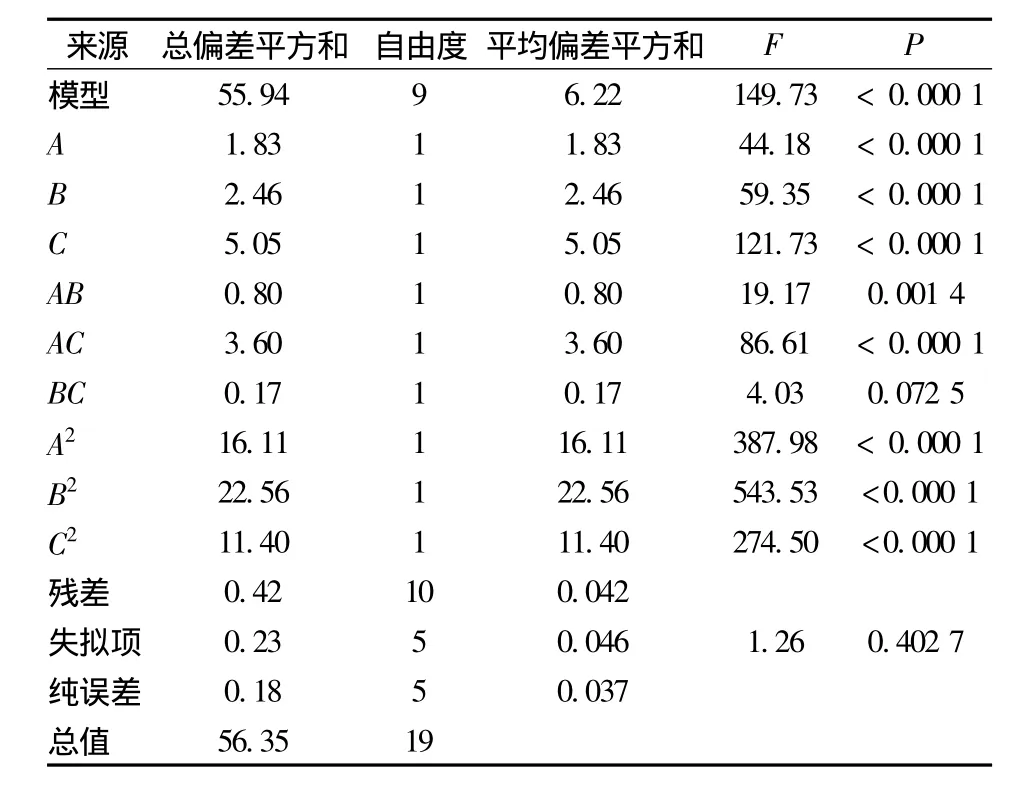
表6 回归方程的方差分析Table 6 ANOVA analysis for regression equation

表7 模型的可信度分析Table 7 Fitstatistics for Y
上述模型中的3个因素与响应值Y(尿苷,g/L)的相互作用可以直观地从图1的响应面图中反映出来。由图1可以看出,响应值Y存在最大值,经过软件的进一步分析得出,Y的最大值为Y=13.76 g/L,此时3个因素的值为A=0.298 8,B=0.106 9,C=0.446,对应的实际添加浓度为酵母粉25.6 g/L,谷氨酸钠25.2 g/L,豆粕水解液40.9 mL/L。
2.4 模型的验证实验
为验证模型的准确性及重复性,以上述得出的各因素浓度配制发酵培养基,并以初始发酵培养基作为对照,进行摇瓶发酵实验。发酵过程曲线如图2所示。

图1 酵母粉(A)、谷氨酸钠(B)和豆粕水解液(C)三因素影响尿苷产量的响应面图Fig.1 Response surface plots of the effects of yeast extract(A),monosodium glutamate(B)and soybean meal hydrolysate(C)on uridine yield
发酵结果各参数见表8。优化后的菌体生物量比优化前提高了11.2%,葡萄糖消耗量提高了51.0%,优化后尿苷产量与预测值非常接近,比优化前提高了164.1%。此外,单位菌体的尿苷生成量也提高了138.5%。可见,模型的选取基本正确。

表8 发酵结果各参数Table 8 Parameters of the fermentation results
3 结论
首先利用PB实验设计筛选出了对尿苷产量影响显著的3个因素:酵母粉、谷氨酸钠、豆粕水解液。其中,酵母粉和豆粕水解液含有丰富的有机氮源,是菌体生长过程中合成蛋白质、核酸和其他许多初级以及次级代谢产物的重要来源[18],在尿苷的从头合成途径中,这些氮源物质还是合成嘧啶环的前体物,具有极其重要的作用,直接影响到发酵产苷量。除此之外,它们含有的少量维生素和微量元素是菌体生长代谢中重要酶的辅酶或辅因子,能够保证菌体生长良好。尿苷属于初级代谢产物,只有在一定生物量的基础上,才有可能使之充分发挥产苷能力。谷氨酸钠一方面能够很好地促进菌体的生长,另一方面作为谷氨酸供体,大大增加了尿苷从头合成途径的氨基来源。
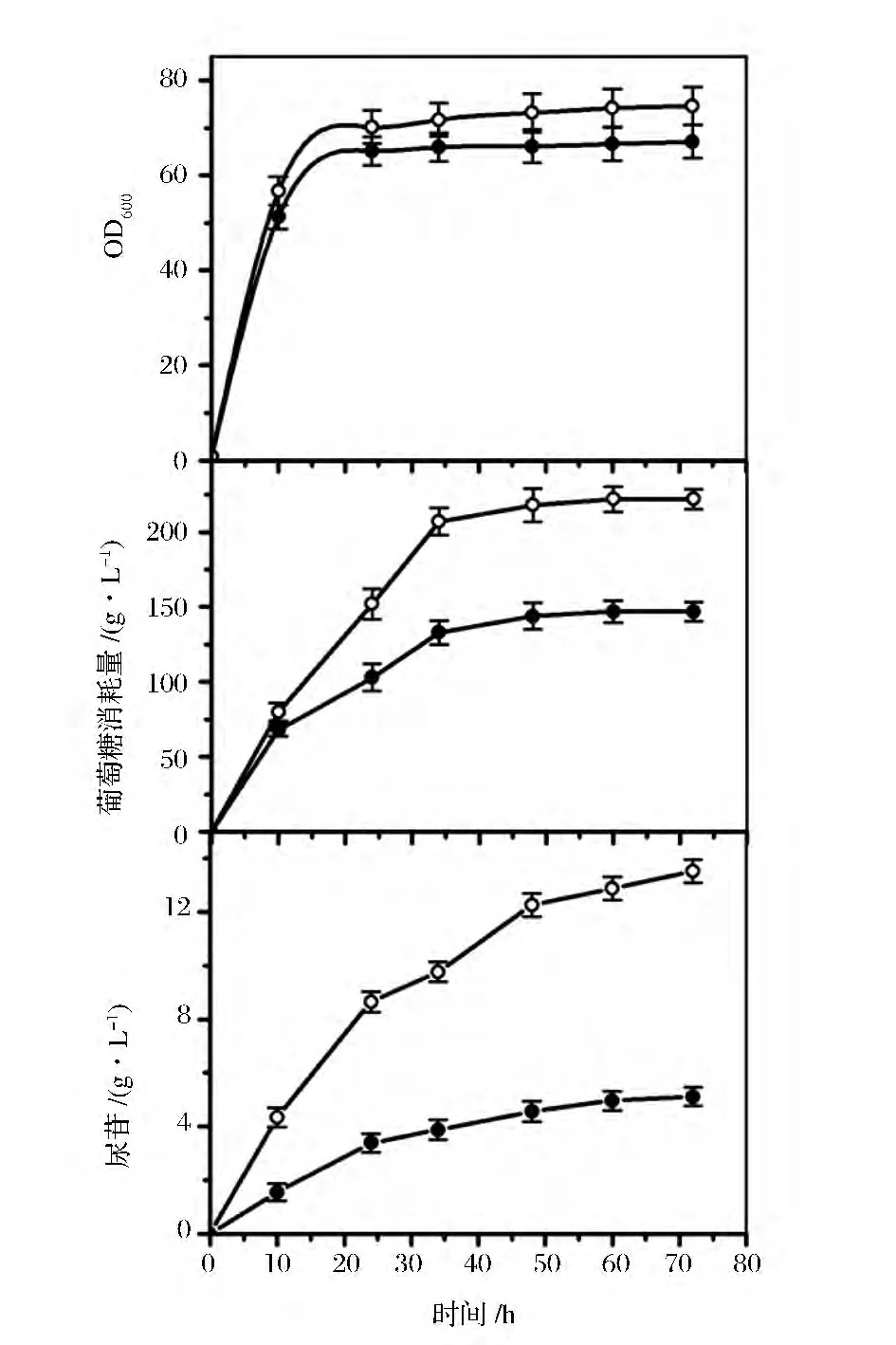
图2 优化前(实心)与优化后(空心)培养条件下发酵过程曲线图Fig.2 Curves of the fermentation process under original(solid symbols)and optimal(open symbols)conditions
通过响应面分析,我们得到了能够很好地反映尿苷产量变化的二次回归模型。通过求解回归方程,我们得出了尿苷产量最大值的预测值,通过模型验证实验再次验证了该预测值的准确性和可靠性。在优化的培养条件下,各因素的浓度分别为酵母粉26 g/L,谷氨酸钠25 g/L,豆粕水解液41 mL/L。这比初始培养基中各成分的浓度均提高了约1%,说明了优化后的培养基碳氮比更合适,培养条件更适宜菌体生长,尿苷的从头合成途径更为通畅,而使菌体能更多地积累尿苷。
[1] 王锐.嘧啶核苷的研究进展[J].生物技术通讯,2007,18(3):539-542.
[2] 邱蔚然,丁庆豹.酶法合成核苷类抗病毒药物[J].中国医药工业杂志,1999,30(10):474-478.
[3] 张绍谭,倪孟祥,阮期平.核苷类药物的酶法合成[J].药学进展,2005,29(2):56-62.
[4] 怀丽华,陈宁.嘧啶核苷高产菌的代谢控制育种策略[J].食品与发酵工业,2005,31(10):107-110.
[5] 方海田,徐庆阳,谢希贤,等.微生物发酵法生产胞嘧啶核苷的研究进展[J].发酵科技通讯,2010,39(3):48-51.
[6] 程远超,刘康乐,黄艳辉,等.尿苷菌种选育及发酵条件优化[J].发酵科技通讯,2009,38(4):11-15.
[7] 乔宾福.微生物产生核苷和核酸[J].工业微生物,1998,28(1):22-27.
[8] 黄新仁.响应面法在生物过程优化中的应用[D].长沙:湖南大学,2011.
[9] Muralidhar R V,Chirumamila R R,Marchant R,et al.A response surface approach for the comparison of lipase production byCandida cylindraceausing two different carbon sources[J].Biochemical Engineering Journal,2001,9(1):17-23.
[10] 李勇昊,周长海,丁雷,等.发酵培养基优化策略[J].北京联合大学学报,2011,25(2):53-59.
[11] 代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.
[12] LI C,BAI J H,CAI Z L,et al.Optimization of a cultural medium for bacteriocin production byLactococcuslactisusing response surface methodology[J].Journal of Biotechnology,2002,93(1):27-34.
[13] 曹小红,蔡萍,李凡,等.利用响应面法优化Bacillus nattoTK21产脂肽发酵培养基[J].中国生物工程杂志,2007,27(4):59-65.
[14] Vatanara A,Rouholamini Najafabadi A,Gilani K,et al.A Plackett–Burman design for screening of the operation variables in the formation of salbutamol sulphateparticles by supercritical antisolvent[J].The Journal of Supercritical Fluids,2007,40(1):111-116.
[15] Imandi S B,Karanam S K,Garapati H R.Use of Plackett-Burman design for rapid screening of nitrogen and carbon sources for the production of lipase in solid state fermentation byYarrowialipolyticafrom mustard oil cake(Brassica napus)[J].Brazilian Journal of Microbiology,2013,44(3):915-921.
[16] 阮文兵,陈必钦,陈素华,等.响应面分析法优化(R)-扁桃酸发酵培养基[J].中国生物工程杂志,2010,30(8):112-117.
[17] Fung W Y,Woo Y P,Liong M T.Optimization of growth ofLactobacillus acidophilusFTCC 0291 and evaluation of growth characteristics in soy whey medium:a response surface methodology approach[J].Journal of Agricultural and Food Chemistry,2008,56(17):7 910-7 918.
[18] 王镜岩.生物化学(下)[M].高等教育出版社,2002:396-397.

