讨论式教学法在容量分析教学中的具体运用
刘凯 辜英举 但梅
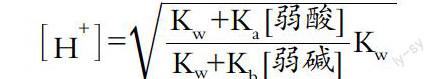
【摘要】根据容量分析的知识特点和要求,采用部分讨论的形式开展教学,以活跃学生的思维,加深对相关知识的理解,发挥他们的主观能动性。
【关键词】讨论式教学法 容量分析 酸碱滴定法 沉淀滴定法
【中图分类号】G420 【文献标识码】A 【文章编号】2095-3089(2015)10-0163-02
容量分析又称滴定分析,内容包括在四大平衡基础上建立起来的酸碱滴定法、络合滴定法、氧化还原滴定法和沉淀滴定法[1]。领会和掌握其原理和方法,对于化学专业的学生来讲具有至关重要的意义和价值。与滴定分析概论相比,这部分内容涉及的原理、方法和关系要复杂的多,对于国内多数高校的大一学生而言,不宜以全讨论的形式展开教学。为此,我们确定了以讲授法为主、讨论式教学法为辅的教学方法,即在教学过程中,围绕知识体系和教学大纲要求,甄选出一部分内容展开讨论,以活跃学生思维,加深对相关知识的理解和认识。在选择和确定讨论内容时,我们主要强调以下三项原则:
一、讨论内容应有利于学生对重点知识的认识和掌握
教学的目的在于使学生掌握相应的认知目标,讨论式教學应该紧扣教材的重点和难点进行设计,以利于学生对目标的认识和掌握。以分布分数为例,它是容量分析最为重要的参数之一,是开启溶液中各型体平衡浓度问题的一把钥匙。为了促进学生对该参数的理解和应用,我们在介绍了其定义、作用和计算关系之后,向学生提出了这样两个思考题:①碱性物质的分布分数该怎样处理?②分别将含有相同物质的量的醋酸、醋酸钠溶液的体积和pH值调至相同,二溶液中醋酸根离子的数量是否相同?若不同,谁多谁少?对问题①,一般资料都只介绍了弱酸及各解离型体分布分数的处理方法,碱性物质则未提及;通过小组讨论,学生们了解到有两种不同的处理方法,一是按解离平衡通过[OH-]和Kb处理,二是将碱性物质视为酸解离出的型体仍按酸性物质的方法处理。这样不仅可以使学生对分布分数的处理方法更加熟悉,增加处理方法的选择性,还可拓展思维,对酸碱性物质的转化关系及规律有了更加深刻的认识。对问题②,由于学生初步接触分布分数,尚不习惯按其方法处理这类实际问题,从讨论情况看,多数同学还是按照一般化学平衡关系或电荷平衡的方法去分析,容易掉入“谁多谁少”的陷进。其实,该问题用电荷平衡去处理是行不通的,因为它没有指明用什么物质及多少量去调节溶液的pH值,无法建立电荷平衡关系。而如果采用分布分数,通过分布分数与平衡浓度的关系去分析,就不难得出正确的结论。通过问题②的讨论,可以让同学们充分认识到分布分数在处理浓度关系时的巨大作用,为后继的学习创造了有利的条件。
二、讨论内容应有利于各知识体系之间的融会贯通
化学是一门综合性很强的学科,各知识板块相互交联和渗透,共同推动学科的进步和发展。这就要求入学者不仅要掌握各板块的基础知识,更重要的是利用这些基础知识跨板块解决不同的实际问题,即综合运用知识的能力。为此,我们在沉淀滴定的教学过程中,根据教学进度陆续提出了以下4个思考题:①为什么莫尔法的适宜酸度以pH=6.50~10.50为宜?依据何在?②为什么AgI、AgSCN要强烈吸附I-和SCN-,而AgCl、AgBr、AgCN对Cl-、Br-、CN-的吸附作用则要弱得多?③能否用莫尔法直接测定Ag+?④莫尔法不能测SCN-,缘于滴定产物AgSCN对SCN-有强烈的吸附作用。而佛尔哈德法的滴定产物同样是AgSCN,为什么却可以用来测定SCN-?在问题①中,既要涉及到AgOH的沉淀平衡,又要考虑到CrO42-和Cr2O72-的转化问题,且有些数据需要查阅各种资料,同时还要参考颜色的干扰等综合性的因素,对于大一的学生,具有一定的挑战性和较强的分析思考价值。对问题②,需要将微粒之间的相互作用力——尤其是色散力考虑进去,因此,对一价负离子来讲,离子半径及变形性是吸附作用大小的决定性因素,学生通过分析和查阅资料,不难找到正确答案。而问题④与问题②是类似的,但需要学生明确两个方面的问题,一是溶液环境不同,吸附的对象也就不同(莫尔法中沉淀的吸附对象是SCN-,佛尔哈德法中沉淀的吸附对象是Ag+);二是正离子的变形性比负离子要小。以上分析和讨论,需要学生将无机化学的基础知识与分析化学的实践应用有机的结合起来,既能巩固旧有知识,又能学到运用知识解决实际问题的手段和方法,可谓一举两得。
三、讨论内容应有利于学生发散思维的训练和应用
当今教育非常强调对受教育者创新能力的培养,美国心理学家吉尔福特认为:发散思维是创造思维的核心,代表一个人的创造能力[2]。大一的学生,刚从中学阶段的应试教育中摆脱出来,这方面的能力较为欠缺,因此,利用讨论式教学的机会,有意识的进行发散思维的培养和训练,就显得非常重要了。为了达到这一目的,我们以学科或实践要求为依据,拟定了一些开放性或颠覆性的问题给学生思考,以拓展其思维。
例如,在酸碱滴定的教学中,讲到两性物质[H+]的计算时,我们以质子平衡为基础,推导出了一个能用于各类两性物质的计算通式(忽略二级及以下解离)
H■=■
在介绍了该关系式的应用之后,我们提出了一个问题让学生讨论:该关系式有什么特点和重要意义?从特点看,某些细心的同学可以发现该关系式的分子对应的是弱酸[H+]的计算关系,分母对应的是弱碱[OH-]的计算关系,整个关系式其实是将弱酸和弱碱的处理方法融为一体了。关于它的重要意义,同学们一般难以考虑周全,对此可以适当提示:该关系式除了能够用于各类两性物质[H+]的计算以外,还有没有其它作用?能不能计算其它酸碱性物质的[H+]?经过分析和思考,多数同学能够发现该关系式可以用来计算弱酸和弱碱的[H+],也有少数思路开阔的同学能够发现该关系式可以用来计算强酸和强碱的[H+],这就意味着该关系式是所有酸碱性物质在不考虑二级及以下解离的条件下[H+]的计算通式!讨论到这里,如果同学们没有更深入的认识或发现,教师可以进一步提示:在两性物质的溶液中,如果增加一种强酸,计算关系又怎样?增加弱酸呢?增加强碱呢?增加弱碱呢?学生根据质子平衡关系,可以发现在两性物质的溶液中,增加一种强酸,溶液[H+]的计算只需要在该通式的分子中增加一项{[H+]c酸}即可;而增加一种弱酸,只需要在该通式的分子中增加一项{Ka[弱酸]}即可。反过来,如果增加的是一种强碱,则只需在通式的分母中增加一项{[OH-]c碱}即可;若增加一种弱碱,只需在该通式的分母中增加一项{Kb[弱碱]}即可。这样一来,就使一些复杂的酸碱体系[H+]的计算问题变得比较有规律和简单了。
又如,在氧化还原滴定中,我们向学生介绍了对称性氧化还原滴定φsp的计算关系以后,不失时机地向学生提出:不对称性氧化还原滴定φsp又该怎样处理?以拓展他们的思维。为了便于检验同学们的讨论结果,我们将滴定反应的形式作了统一规定
aO1+bR2 = cR1+dO2
并且要求结果内只应含有一种物质即R1的浓度cR1。在本题的分析中,容易出错的是电极反应的书写,教师可以适当提示同学们应按实际的滴定反应方向和关系配置和处理系数。由于本题对大一的学生来讲难度较大,我们给予他们思考的时间也相对较长,分值也相对较大,以激发他们讨论的积极性。再如沉淀滴定中,按照相应原理,莫尔法是不能用来直接滴定未知Ag+溶液的,但我们给学生提出的问题是“能否用莫尔法直接测定Ag+?”(见沉淀滴定思考题③)这里我们将“直接滴定”改为了“直接测定”,虽然只是一字之差,但后者所包含的操作條件和方式却更为灵活。同学们如果不仔细琢磨,容易掉入否定的陷阱。实际上,操作时只要倒过来,将NaCl标准溶液置于锥形瓶中,将未知的Ag+溶液装在滴定管内,即可直接测定[Ag+]。这就需要学生具备一定的发散思维能力,才能得到这种相对于一般教材而言具有一定颠覆性的结论。
经过上述分析讨论,学生们逐渐打开了思维的禁锢,审视事物的角度和视野均得到了较大的张扬,学习氛围也日趋活跃,在学术上不时冒出一些新的观点和想法。比如在沉淀滴定中,就有一些学生经分析后指出:用佛尔哈德法测SCN-时,根本不用返滴定法,只需将未知的SCN-溶液装在滴定管中,标准的Ag+溶液置于锥形瓶内,直接滴定即可。这种情况,在用传统的方法进行教学时期是不可想象的。
至于讨论式教学的具体组织形式、成绩的评定及学生的反馈意见,已在有关文献中作了详细介绍[3],这里不再繁述。
总之,在容量分析的教学中,根据知识体系和教学大纲要求,精选出一部分内容展开讨论式教学,不仅可以使学生更好的理解和掌握相应知识,还可以拓展学生思维,掌握分析问题和解决问题的思路和方法,并培养他们的创新意识和团结协作能力。
参考文献:
[1]华中师大,陕西师大,东北师大,等.分析化学:上册[M].第四版.北京:高等教育出版社,2011:117-301.
[2]杨福能. 新课程数学教学中必须加强发散思维的培养[J].教育界,2013,118(22):151-152.
[3]刘凯,卢茂健,殷艳.讨论式教学法在滴定分析概论教学中的具体应用[J].课程教育研究,2013,10下旬刊:36-37.

