磁芯-硫脲壳聚糖微柱在线流动注射-原子吸收光谱法测定大米中痕量镉
申东方, 周方钦, 王 珍
(环境友好化学与应用省部共建教育部重点实验室,湘潭大学化学学院,湖南湘潭 411105)
镉是一种很重要的工业原料,广泛应用于冶金、塑料、电子等行业,但镉又是一种毒性很强的重金属元素,对环境和人体健康会产生严重危害[1]。人们通过食物链摄取的微量镉会在体内慢慢累积,直至引起镉中毒。镉在骨骼中可取代其中的钙,使骨骼严重软化并损害人体组织中其它器官[2],因而对食物尤其是对大米中痕量镉的检测就显得格外重要。但痕量Cd2+的检测往往受一般仪器检测灵敏度的限制和其他共存离子的干扰,故在测定前需要预富集和分离。目前,对痕量Cd2+进行分离富集的方法主要有共沉淀法[3]、离子交换法[4]、膜分离法[5]和浊点萃取法[6]等。
磁芯壳聚糖吸附剂对金属离子具有很大的吸附能力[7,8],为了提高其对重金属离子的吸附容量,对壳聚糖表面进行修饰可增加新的具有较高分离能力的官能团[9],如乙二胺、硫脲、硫代尿素等。本文采用油/水乳化交联技术合成磁芯-壳聚糖,再用硫脲对其表面进行修饰,合成了具有良好吸附性能的有机-无机磁性复合材料磁芯-硫脲壳聚糖,并以自制磁芯-硫脲壳聚糖作为固定相填充到自制的微柱中,采用流动注射在线分离富集与火焰原子吸收光谱法联用技术[10],对大米中痕量镉进行测定。
1 实验部分
1.1 仪器与试剂
AA6000型原子吸收分光光度计(上海天美科学仪器公司);镉空心阴极灯(北京有色金属研究总院)。仪器工作条件:波长228.80 nm,狭缝宽度0.2 nm,灯电流10 mA,乙炔流量2.0 L/min,空气流量7.5 L/min,燃烧器高度7.5 mm。SHA-C型超级恒温振荡器(常州国华国器有限公司)。pHS-3D型精密酸度计(上海精密科学仪器公司)。202-1型电热恒温干燥箱(天津泰斯特仪器有限公司。LZ-2000型流动注射仪(沈阳肇发实验仪器研究所)。JEM-6360LV型扫描电镜仪(日本,电子牛津能谱公司)。FTIR-1710型傅立叶变换红外光谱仪(美国,PE公司)。
Cd2+标准贮备溶液(1 g/L):称取1.000 g金属镉于250 mL烧杯中,加入50 mL HCl (1+1)和几滴浓HNO3,加热溶解,冷却后移入1 000 mL容量瓶中,定容摇匀,使用时用水稀释到所需浓度。壳聚糖(脱乙酰度>90%,济南海得贝公司),硫脲(广州化学试剂厂),环氯丙烷(湖南江虹试剂有限公司),戊二醛(50%,成都市科龙化工试剂厂),正硅酸乙酯(TEOS,广东汕头市西陇化工厂),NaH2PO4-Na2HPO4(pH=7.0)。以上试剂均为分析纯,实验用水为二次石英蒸馏水。
1.2 磁芯-硫脲壳聚糖的制备
1.2.1磁性Fe3O4/SiO2微球的制备称取5.0 g自制的 Fe3O4(采用化学共沉淀法[11]制备)溶于50 mL 0.1 mol/L HCl中,超声10 min 后进行磁分离,产物用水洗涤后分散到100 mL 乙醇和40 mL水的混合溶液中,继续滴加20 mL 浓氨水和6 mL TEOS,在30 ℃油浴下搅拌6 h,过滤分离,固相依次用乙醇、水洗涤后,于60 ℃下真空干燥4 h。制成磁性 Fe3O4/SiO2微球,备用。
1.2.2硫脲壳聚糖的制备将10 mL 环氧氯丙烷溶于100 mL 丙酮中,加入5.0 g 壳聚糖混合,混合物在30 ℃下搅拌反应24 h,再加入5.0 g 硫脲,混合物于60 ℃下搅拌反应6 h,加入10.0 g 硫脲及1 mol/L NaOH溶液50 mL,混匀后于60 ℃下搅拌4 h。过滤分离,固相产物依次用丙酮、水、甲醇洗涤,在60 ℃真空干燥1 h。制成硫脲壳聚糖,备用。
1.2.3磁芯-硫脲壳聚糖的制备称取3.0 g 硫脲壳聚糖溶解于180 mL 质量分数为5%乙酸溶液中,加入1.2 g Fe3O4/SiO2于500 mL 圆底烧瓶中,超声分散30 min。加入130 mL 液体石蜡和2 mL Span 80,用30 mL 25% 氨水调节反应溶液pH为8.0~9.0。加入25 mL 质量分数为50% 的戊二醛,混合液在60 ℃油浴中搅拌反应2 h,过滤分离,固体产物依次用石油醚、乙醇、水洗涤至中性后,于60 ℃真空干燥2 h,制成黑色粉末磁芯-硫脲壳聚糖,置于玻璃瓶中备用。具体的合成路线见图1。
1.3 实验方法
称取10 mg吸附材料装入自制的微柱中,按图2所示将微柱连接到流路中,设置好工作参数并激活泵,用稀氨水和HCl调节试液的pH至7.0左右,加入5 mL pH=7.0 的NaH2PO4-Na2HPO4缓冲溶液,按表1操作程序完成对Cd2+的吸附、洗脱及测定。具体操作步骤是:首先,将阀位转至进样(图2a),用水以流速3.9 mL/min 洗涤微柱60 s,以充分洗涤泵中残留物;其次,对pH=7.0的Cd2+试液,以流速3.9 mL/min 进行采样,对Cd2+进行吸附,富集时间为120 s;然后,将阀位切换到洗脱(图2b),用水调节基线;最后,用0.5 mol/L HNO3-0.1 mol/L硫脲为洗脱液,以流速3.6 mL/min对微柱进行洗脱,洗脱液直接进入火焰原子吸收(FAAS)的雾化器,记录吸光度,计算试液中Cd2+的含量。
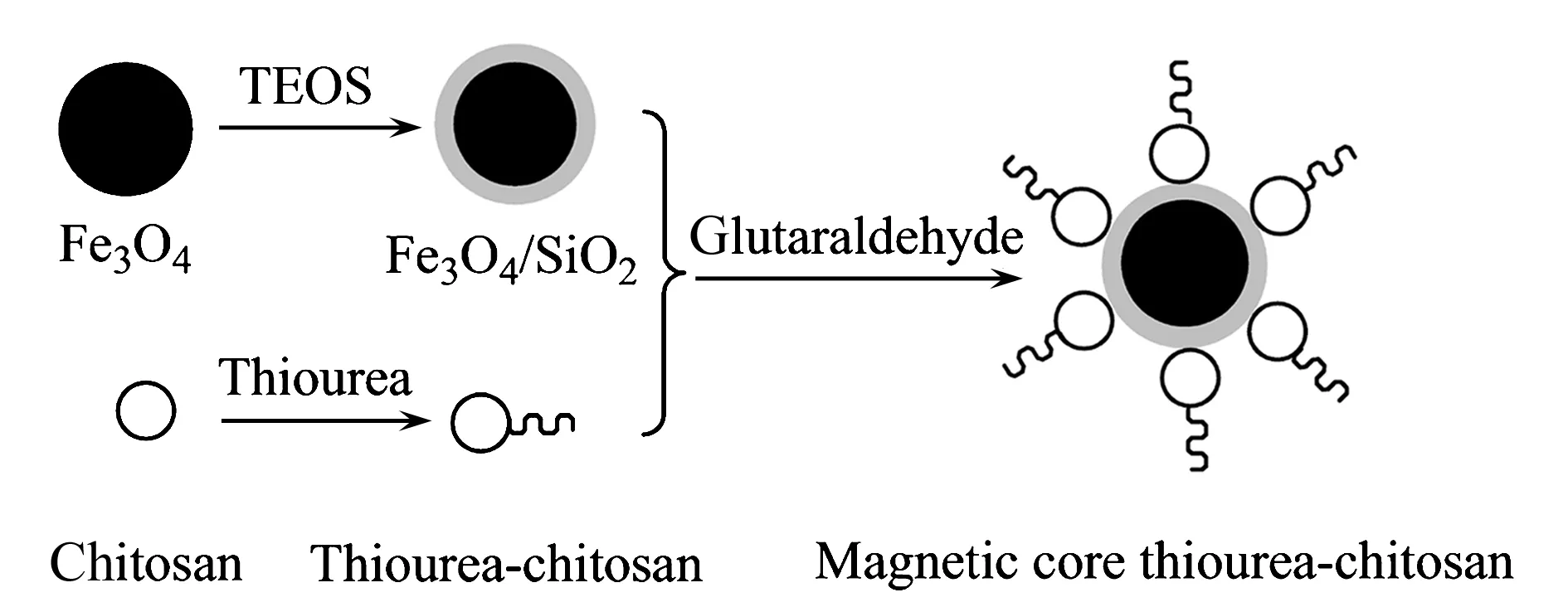
图1 磁芯-硫脲壳聚糖的形成原理图Fig.1 Schematic depiction of the formation of magnetic core thiourea-chitosan
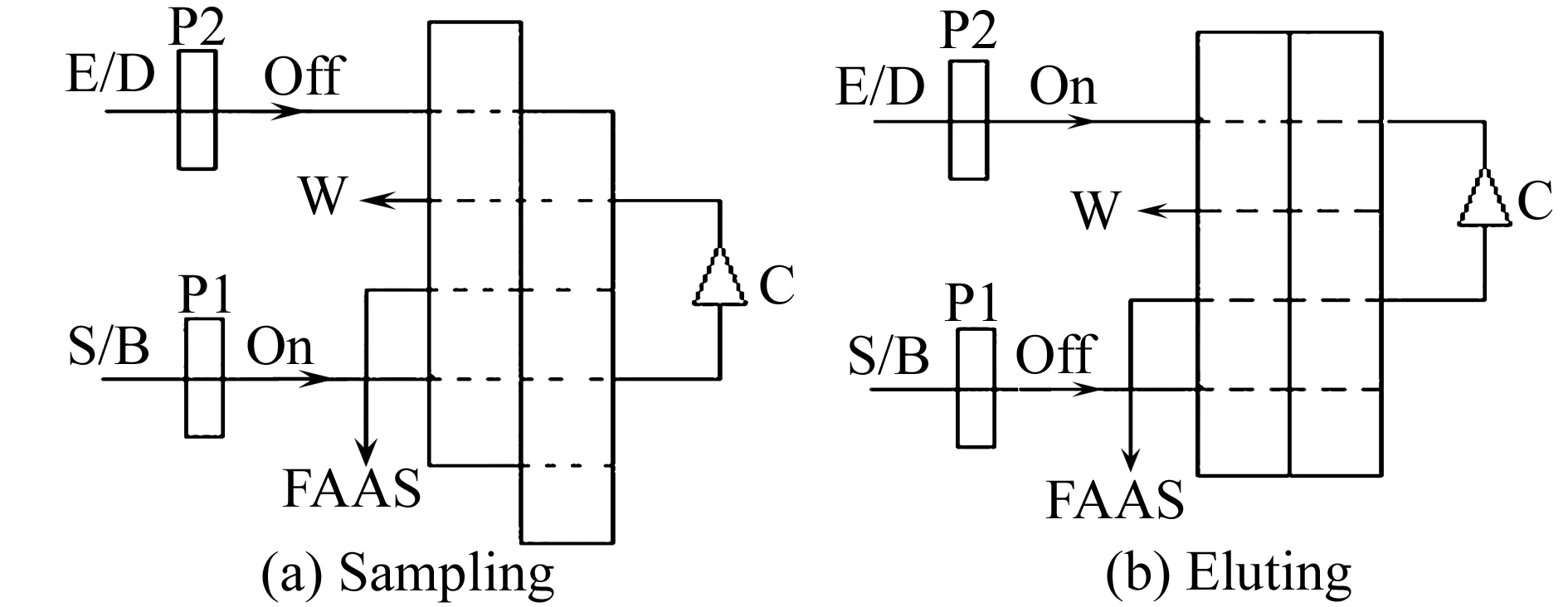
图2 流动注射仪程序图Fig.2 Schematic diagram of flow injection instrumentB:blank solution.S:cadmium solution.C:micro column.D:deionized water.E:eluent.P1,P2:peristaltic pump.W:waste.FAAS:flame atomic absorption spectrophotometer.
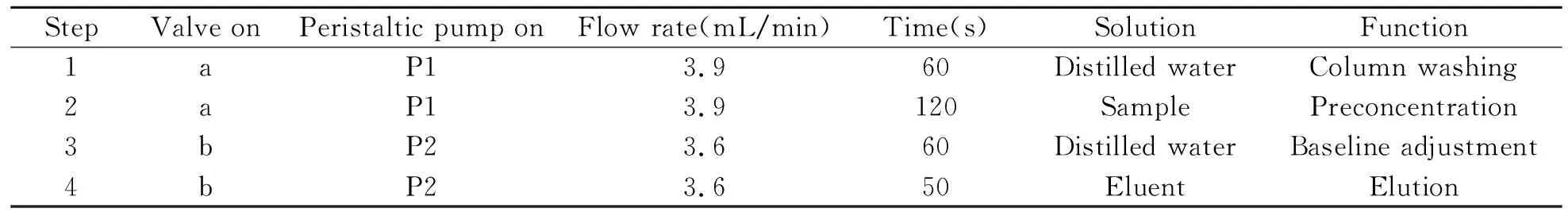
表1 流动注射仪操作程序
2 结果与讨论
2.1 磁芯-硫脲壳聚糖材料的表征
对合成的磁芯-硫脲壳聚糖进行扫描电镜(SEM)(图3)、红外(IR)光谱(图4)和磁性表征(图5)。由图3可知,磁芯-硫脲壳聚糖具有材质疏松、管状孔径大、分布均匀、比表面积大等特点。如图4所示,在578 cm-1处的吸收峰是Fe-O的特征吸收峰;在1 101 cm-1处的吸收峰是由于Si-O的伸缩振动所致,在1 568 cm-1处的吸收峰是硫脲中的C-N的特征吸收峰;而1 377、1 645 cm-1处出现的吸收峰分别对应壳聚糖分子中C-N的伸缩振动和N-H的弯曲振动;2 854 和2 904 cm-1处的强吸收峰是由于壳聚糖分子中的C-H伸缩振动所致;3 388 cm-1处出现的强吸收峰是由于壳聚糖的O-H和N-H伸缩振动所致。以上结果表明,制备的材料为磁芯-硫脲壳聚糖。为了验证磁芯-硫脲壳聚糖是否具有磁性,将磁芯-硫脲壳聚糖分散于水溶液中,在外磁场的作用下观察溶液状态。图5a和图5b分别为磁芯-硫脲壳聚糖分散于水溶液和在外磁场作用下的溶液状态,由图5可知,烧杯中黑色悬浮液的磁芯-硫脲壳聚糖移向磁铁方向的一边,溶液变为澄清(图5b),表明该物质具有磁性。

图3 磁芯-硫脲壳聚糖的扫描电镜(SEM)图Fig.3 SEM image of magnetic core thiourea-chitosan

图4 磁芯-硫脲壳聚糖的红外(IR)光谱图Fig.4 IR spectrum of magnetic core thiourea-chitosan

图5 分散于水溶液(a)和在外磁场作用下(b)的溶液状态Fig.5 Images of the maganetic composites suspended in water (a) and separated by a magnet(b)
2.2 酸度对Cd2+吸附率的影响
将一系列不同pH值的1.0 μg/mL的Cd2+试液,按照1.3节的实验方法,以相同的采样流速和采样时间(小于最佳采样时间)进行采样,根据吸附后吸光度测定值,计算吸附率,结果如图6所示。从图6可见,pH为7.0时,微柱对Cd2+的吸附效果最好。故本实验选择最佳pH=7.0为吸附酸度。
2.3 采样速率对Cd2+吸附率的影响
采样速率直接影响Cd2+与微柱内吸附材料的接触时间,从而影响其吸附效果。因此,在pH=7.0 条件下,改变泵的转速,在不同的采样速率下进行实验,结果如图7所示。由图7可知,当采样速率在2.6~4.0 mL/min之间时Cd2+能被磁芯-硫脲壳聚糖完全吸附,当采样速率大于4.0 mL/min 时,单位时间内绝对进样量大,Cd2+在微柱上的保留效率会降低。综合考虑,本实验最后选定采样速率为3.9 mL/min。

图6 酸度对吸附率的影响Fig.6 Effect of pH on adsorption rate

图7 采样速率对吸附率的影响Fig.7 Effect of sampling rates on adsorption rate
2.4 采样时间对吸附率的影响
将已调节好pH=7.0 的1.0 μg/mL Cd2+试液,以3.9 mL/min的流速通过装有吸附材料的微柱,并设置采样时间从30 s开始,依次增加10 s到160 s,按实验方法测定。实验结果表明:随着采样时间的加长,测定信号不断变大,当时间达到120 s时,测定信号达到最大值且不再变化,此时微柱的吸附达到平衡,故选择采样时间为120 s。
2.5 洗脱剂的选择
在相同采样速率和采样时间的条件下,分别考察不同浓度的乙酸、EDTA、HNO3、HCl、HNO3-硫脲等洗脱剂对Cd2+洗脱性能的影响。结果表明:当洗脱剂为HNO3-硫脲时,瞬时信号峰值(吸光度)最大、没有拖尾峰且洗脱时间最短,同时随硫脲浓度的增大吸光度增大;但硫脲浓度太大时,燃烧器易结垢,影响最终测定的结果。因此,在不降低洗脱效果的情况下,本文选择0.5 mol/L HNO3-0.1 mol/L硫脲混合溶液作为洗脱剂。
2.6 洗脱速率和时间的选择
在最佳吸附条件下,改变泵的转速,使洗脱液在同一条件下以不同的流速对微柱中所吸附的Cd2+进行洗脱,根据流出曲线考察洗脱剂流速对洗脱效果的影响(图略)。当流速为3.6 mL/min时,瞬时信号峰值(吸光度)最大,故实验选择3.6 mL/min作为最佳洗脱速率。同时考察洗脱时间的影响,结果表明,当洗脱时间为50 s时,微柱内吸附的Cd2+可完全被洗脱。
2.7 共存离子的影响

2.8 微柱的重复使用性能考察
为了考察以磁芯-硫脲壳聚糖为吸附材料自制微柱的重复使用性,在最佳的实验条件下,连续对装有吸附材料的微柱不断地进行在线吸附-解吸实验。结果表明,微柱在重复使用9次后,Cd2+回收率仍在98%以上,吸附性能基本不受影响,说明该微柱至少可重复使用9 次以上。
2.9 分析特性
在最佳实验条件下,按1.3节实验方法对不同浓度的Cd2+试液进行测定,得到测定Cd2+的线性范围为0.02~1.20 μg/mL,线性回归方程为:A=0.9718c(μg/mL)+0.2456,相关系数r=0.9922,检出限(3σ)为 2.5 ng/mL 。对 1.0 μg/mL 的Cd2+平行测定7 次,相对标准偏差(RSD)为0.79%。
3 实际样品分析
准确称取从市面上购买的大米样品5.0 g,置于25 mL瓷坩埚中,并在其表面覆盖一层薄薄的NaHCO3,然后将坩埚放入马弗炉中于600 ℃下灼烧1 h,冷却至室温后,用10 mL 0.5 mol/L HCl溶解,过滤,将滤液转入25 mL 容量瓶中,用水定容。按照实验方法测定大米中Cd2+的含量,同时做加标回收实验,结果见表2。
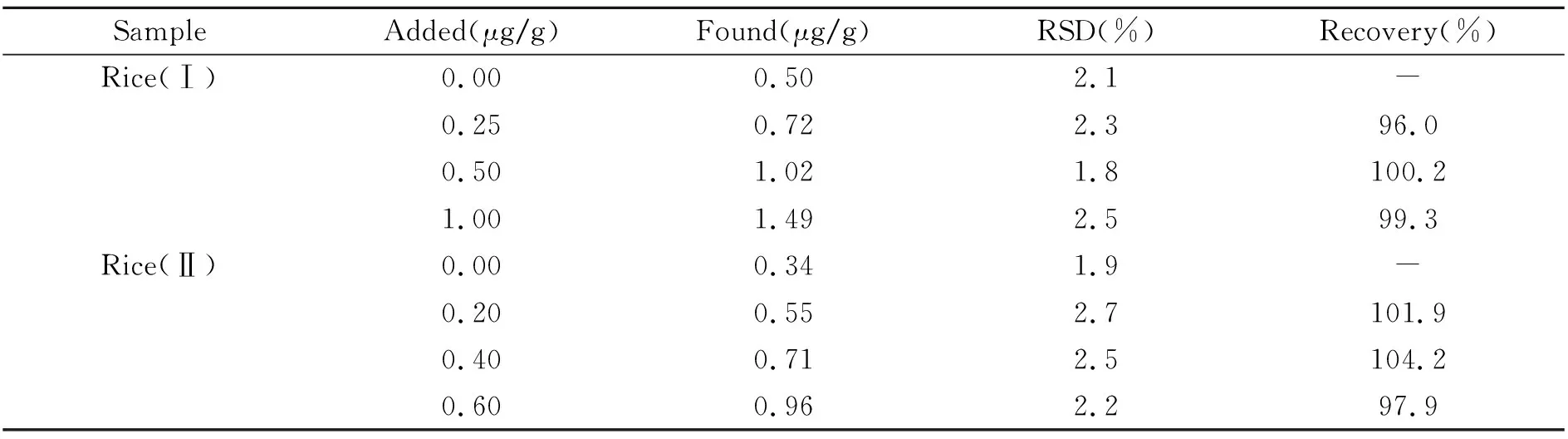
表2 大米中镉的测定及加标回收实验(n=5)
4 结论
本文使用自行合成的磁芯-硫脲壳聚糖吸附材料,可显著提高痕量重金属镉的分离富集能力。与传统的固相萃取方法相比,采用流动注射与火焰原子吸收联用技术,可提高分析速度,减少样品消耗。该方法成本低、简单、快速、选择性好和精确度高。

