同原射线计量分析-荧光猝灭法同时测定Eu(Ⅲ)和Ce(Ⅳ)
陈科平, 张 敏, 朱乾华, 周 尚, 杨季冬*,3
(1.重庆市涪陵环境监测中心,重庆涪陵 408000;2.长江师范学院化学化工学院,重庆涪陵 408100;3.重庆三峡学院化学与环境工程学院,重庆万州 404000)
我国有丰富的稀土资源,而稀土元素的应用十分广泛,可用于军事、冶金工业、石油化工、玻璃陶瓷工业、农业及高新技术等各个行业。植株可吸收环境中的Eu,人类可通过食物链摄入,人体中Eu超标会导致许多疾病的发生[1]。Ce是自然界中分布较多的一种稀土元素,它具有很好的生物活性和一定的抗肿瘤潜能,对一些农作物有促长增产作用[2]。Eu(Ⅲ)和Ce(Ⅳ) 常相互依存于自然界的独居石、磷灰石等稀土矿物中,在发光材料和分子筛等功能材料中Eu(Ⅲ)和Ce(Ⅳ)有互补的物化性能[3,4]。因此,同时测定环境样品或功能材料中痕量的Eu和Ce对人类健康与环境保护均具有十分重要的意义。目前Eu(Ⅲ)和Ce(Ⅳ) 的检测方法主要有分光光度法[5]、荧光光度法[6]、化学发光法[7]、原子光谱法[8 ]和电化学方法[9]。采用荧光猝灭法测定Eu(Ⅲ)也有文献报道[10]。但以核苷抗病毒类药物泛昔洛韦为探针,用荧光猝灭法结合同原射线计量分析法[11]同时测定稀土Eu(Ⅲ)和Cu(Ⅳ)还未见有文献报道。
本文研究发现,在B-R缓冲溶液介质中,微量Eu(Ⅲ)和Ce(Ⅳ)的加入可使泛昔洛韦(FCV)的内源性荧光显著猝灭,且在一定范围内荧光猝灭程度(△F)与Eu(Ⅲ)和Ce(Ⅳ)的质量浓度成正比,但荧光强度随Eu(Ⅲ)和Ce(Ⅳ)的质量浓度的线性增幅存在显著差异。因此,可用荧光猝灭光谱和同原射线计量分析法对Eu(Ⅲ)和Ce(Ⅳ)进行同时测定。
1 实验部分
1.1 仪器与试剂
Hitachi F-2500型荧光分光光度计,U-3010型紫外-可见分光光度计(日本,日立公司);pH-S20K型精密pH计(梅特勒-托利多(上海)仪器有限公司)。
泛昔洛韦标准品(FCV,中国药品生物制品检定所)贮备溶液:6.2×10-4mol/L,工作溶液为6.2×10-5mol/L;Eu(Ⅲ)标准溶液:1 mg/mL,使用时稀释至10.0 μg/mL;Ce(Ⅳ)标准溶液:100 μg/mL,使用时稀释至10.0 μg/mL;B-R缓冲溶液:用0.04 mol/L H3PO4、H3BO3和乙酸与0.2 mol/L NaOH溶液按一定比例混合,配成不同pH值的缓冲溶液,用酸度计校正。实验用水为二次蒸馏水。
1.2 实验方法
在室温下,向10 mL比色管中,依次加1.0 mL pH=3.6的B-R缓冲溶液,0.45 mL 6.2×10-5mol/L的FCV溶液,适量的Eu(Ⅲ)和Ce(Ⅳ)标准溶液(每加一种溶液后均混合均匀),加水稀释至刻度并摇匀,静置5 min,用1 cm石英荧光池,以304 nm为激发波长,扫描220~500 nm范围内的荧光光谱,并在波长为370 nm处测量溶液的荧光强度(F),同时做试剂空白(F0),计算△F=F0-F。测定参数:狭缝宽度10 nm,扫描速度1 200 nm/min。
2 结果与讨论
2.1 荧光光谱图
FCV具有强荧光发射,其荧光发射光谱如图1 A所示,最大发射波长为370 nm(曲线a、a′),当有Ce(Ⅳ) 或Eu(Ⅲ)存在时,FCV的荧光峰位置不变,但荧光强度受到明显的抑制(曲线b、b′和曲线c、c′),且荧光猝灭值△F均随Eu(Ⅲ)、Ce(Ⅳ)质量浓度的增大而增大,但两体系的相对荧光强度有显著差异。由图1 B可知,在370 nm处其荧光猝灭程度(△F)随Eu(Ⅲ)和Ce(Ⅲ)混合物的质量浓度的增大而增强,说明以上2种稀土离子在混合体系中具有光谱加和性,且在一定浓度范围内荧光猝灭程度与混合物的浓度呈线性关系。基于此,可根据Eu(Ⅲ)和Ce(Ⅳ)的浓度及体系的荧光猝灭程度制得2条标准曲线,并根据2条标准曲线围成的扇形面积和二元一次方程图解法,求得扇形面积内测量点的混合物总量和2种稀土离子的含量比。据此,建立荧光光谱和同原射线计量分析同时测定Eu(Ⅲ)和Ce(Ⅳ)的分析方法。
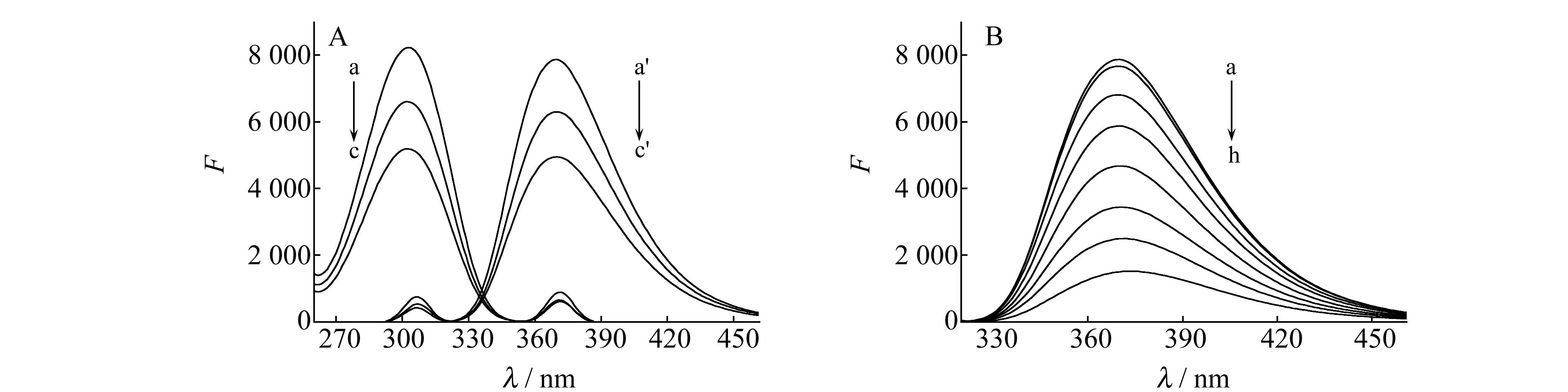
图1 反应体系的荧光光谱图Fig.1 Fluorescence spectra of the reaction systemA:a,a′.FCV;b,b′.FCV+Ce(Ⅳ);c,c′.FCV+Eu(Ⅲ);cFCV=5.6×10-6 mol/L;cEu(Ⅲ)=cCe(Ⅳ)=1.0 μg·mL-1;pH=3.6.B:a-h:cEu(Ⅲ)+Ce(Ⅳ)=0,0.05,0.32,0.72,1.2,2.0,2.4,2.8 μg/mL;cFCV=5.6×10-6 mol/L;pH=3.6.
2.2 适宜的反应条件
2.2.1反应介质和酸度的影响考察了B-R、HAc-NaAc和HCl-NaAc等不同缓冲溶液对反应体系的影响。结果表明,B-R缓冲溶液作反应介质时效果最好。当用B-R缓冲溶液作反应介质时,溶液酸度对荧光强度的影响如图 2所示,两体系的最佳pH范围为3.35~3.85。实验选用 pH=3.6的B-R缓冲溶液作为反应介质,其用量为1.0 mL。
2.2.2FCV浓度的影响在选择的最佳酸度条件下,考察了FCV的浓度对体系荧光强度的影响。如图 3所示,2种反应体系FCV适宜的浓度范围均为5.0×10-6~6.2×10-6mol/L。FCV为荧光物质,其用量对体系的荧光强度有直接影响。浓度太大时,猝灭作用不明显;浓度太小,线性范围变窄。兼顾灵敏度和线性范围,本实验选用FCV的浓度为5.6×10-6mol/L。
2.2.3温度对荧光强度的影响考察了温度对体系荧光强度的影响。结果表明,在温度15~35 ℃条件下,△F最大且稳定;温度在35~45 ℃之间呈直线下降趋势,温度在超过45 ℃时下降趋势更加明显,故实验选择在室温下进行。
2.2.4试剂加入顺序及体系的稳定性实验考察了稀土离子、FCV、B-R缓冲溶液;稀土离子、B-R缓冲溶液、FCV;FCV、B-R缓冲溶液、稀土离子3 种试剂加入顺序对体系△F的影响。结果发现,试剂加入顺序对△F几乎没有影响。同时实验还考察了体系的稳定性,体系在室温下可以稳定120 min以上,稳定性良好。
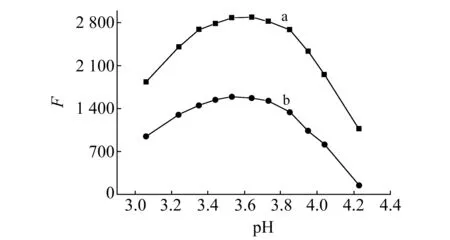
图2 酸度对荧光强度的影响Fig.2 Effect of pH on fluorescence intensitya.FCV-Eu(Ⅲ);b.FCV-Ce(Ⅳ);cFCV=5.2×10-6 mol/L;cEu(Ⅲ)=cCe(Ⅳ)=1.0 μg/mL.
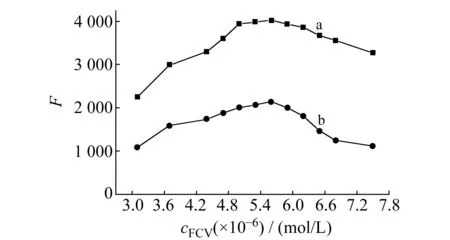
图3 泛昔洛韦浓度对荧光强度的影响Fig.3 Effect of FCV concentration on fluorescence intensitya.FCV-Eu(Ⅲ);b.FCV-Ce(Ⅳ);cEu(Ⅲ)=cCe(Ⅳ)=1.5 μg/mL;pH=3.6.
2.2.5离子强度的影响考察了离子强度对荧光猝灭的影响。结果表明,NaCl的加入对体系的△F值影响不大。
2.2.6表面活性剂的影响研究了表面活性剂溴化十六烷基三甲基铵(CTMAB)、十二烷基硫酸钠(SDS)以及十二烷基苯磺酸钠(DDBS)对体系荧光强度的影响。结果表明,表面活性剂对体系的△F均无作用,因此实验中不加入表面活性剂。
2.3 标准曲线及其相关参数
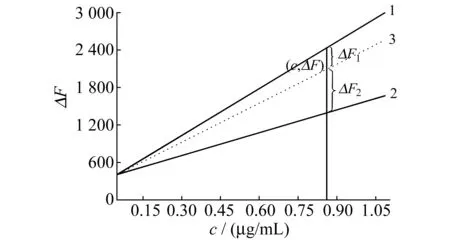
图4 泛昔洛韦与Eu(Ⅲ)和Ce(Ⅳ)相互作用的同原射线图Fig.4 Rays chart with same one point of FCV-rare earth ions system1.FCV-Eu(Ⅲ);2.FCV-Ce(Ⅳ);3.FCV-Eu(Ⅲ)+Ce(Ⅳ);the experimental conditions were the same as those described in Fig.1.
在适宜的反应条件下,分别以不同质量浓度的Eu(Ⅲ)、Ce(Ⅳ)及其混合物与FCV反应,在最大发射波长处测定荧光强度,并以荧光猝灭值(△F)对稀土离子的质量浓度作图,绘制标准曲线,标准曲线的有关参数列于表1。
图4是FCV与Eu(Ⅲ)、Ce(Ⅳ)相互作用的同原射线示意图。图中直线 1和直线 2分别为FCV-Eu(Ⅲ)、FCV-Ce(Ⅳ)体系的标准曲线,形似“射线”,两条直线相交于“同一原点”(0.06,423.0),围成一定范围的扇形面积;直线 3是Eu(Ⅲ)和Ce(Ⅳ)以 3∶1混合后与FCV反应体系的标准曲线。3条标准曲线相交于原点。据此可测量得到混合物总量(通过扇形面积内的计量校正可得)和2种稀土离子的含量比c1/c2=(△F2+△F1)/△F1,从而可通过图解法得到Eu(Ⅲ)和Ce(Ⅳ)的含量[12,13]。
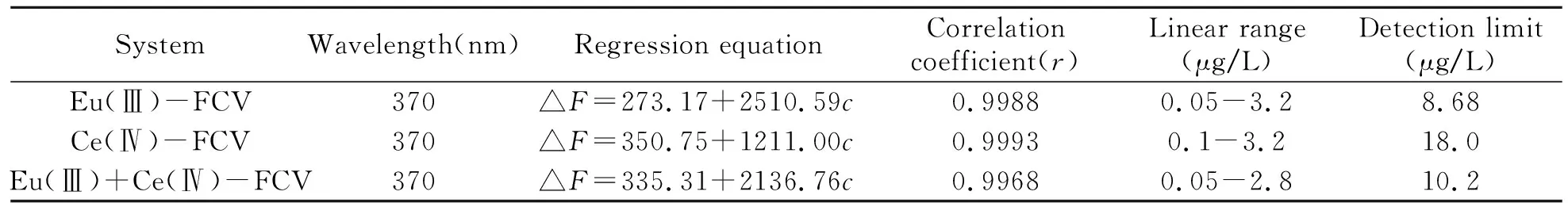
表1 标准曲线的相关参数及其检测限
2.4 荧光猝灭反应类型
荧光猝灭包括静态猝灭和动态猝灭[14]。图6显示了FCV本身的最大吸收光谱λmax=304 nm,Eu(Ⅲ)、Ce(Ⅳ)与FCV反应后吸收光谱发生明显变化,不仅吸光度值降低,而且最大吸收波长略为红移,△λmax分别为12 nm和6 nm。温度对△F/F0的影响见图7。吸收光谱的改变和荧光猝灭作用随着温度升高而降低是静态猝灭反应的两个重要特征,因此推断Eu(Ⅲ)、Ce(Ⅳ)对FCV的荧光猝灭是静态猝灭。
2.5 分析应用
2.5.1荧光光谱同时测定Eu(Ⅲ)和Ce(Ⅳ) 由标准混合物测得的荧光强度以及单组分标样测得的荧光强度之和的结果表明,在所选波长下相对误差小于5%,说明其加和性好。在370 nm以Eu(Ⅲ)-Ce(Ⅳ)(3∶1)(总量1.0 μg/mL)进行实验,相对误差≤±5%时,共存离子干扰情况如表2。由于其它稀土离子浓度较大时干扰Eu(Ⅲ)和Ce(Ⅳ)的测定,故采用多点增量法测定合成样品的回收率。

图6 吸收光谱Fig.6 Absorption spectraa.FCV;b.FCV-Ce(Ⅳ);c.FCV-Eu(Ⅲ);cFCV=1.8×10-5 mol/L;cEu(Ⅲ)=cCe(Ⅳ)=30 μg/mL;pH=3.6.
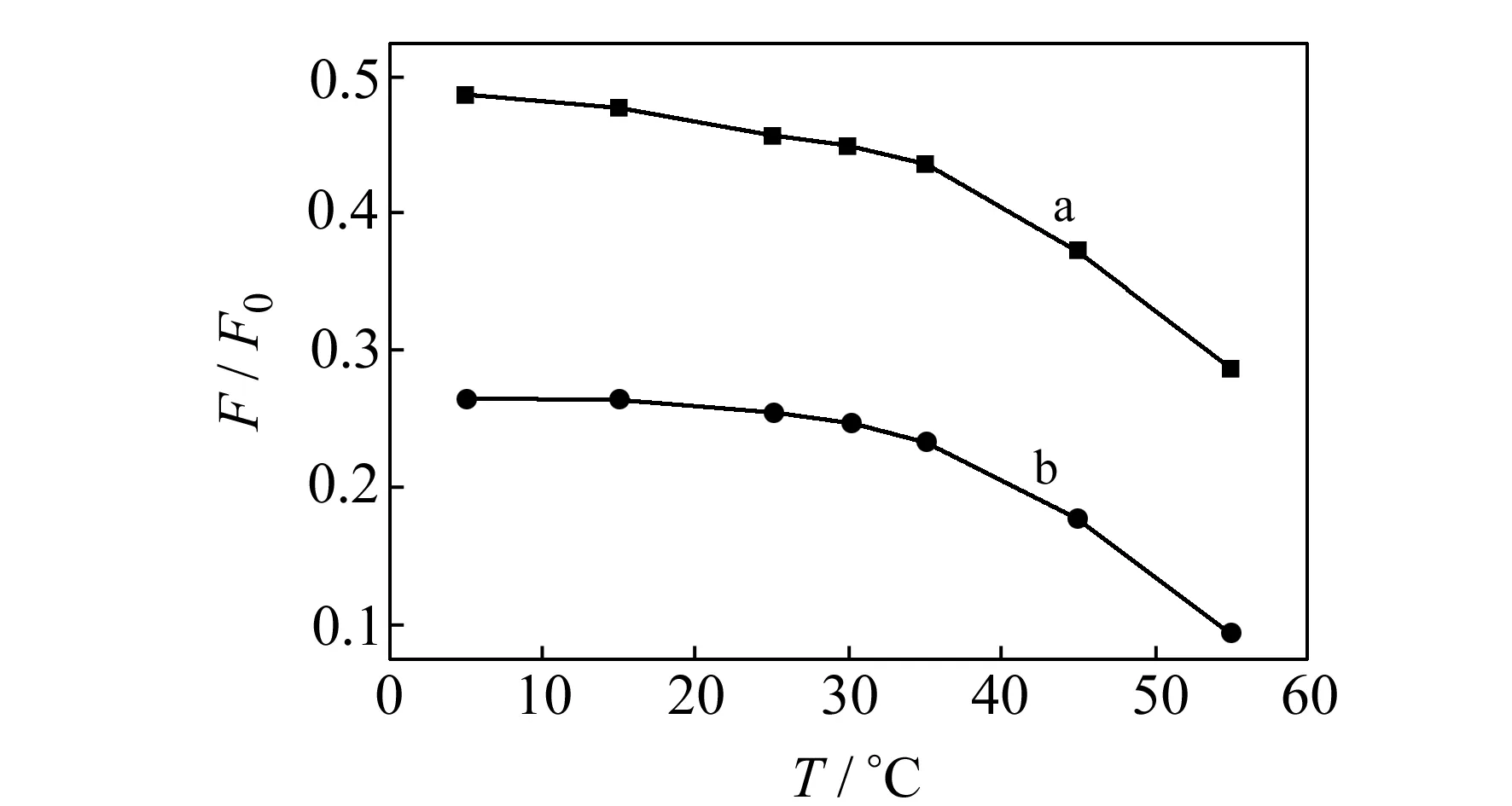
图7 温度对△F/F0的影响Fig.7 Effect of temperature on △F/F0a:FCV-Eu(Ⅲ);b.FCV-Ce(Ⅳ).

Co-existing ionCo-existing concentration(μg/mL)Relative error(%)Co-existing ionCo-existing concentration(μg/mL)Relative error(%)K+400-1.8Sc3+10-3.7Na+400-2.0Ti4+12-3.3NH+4250-2.1Y3+10-4.5Ca2+150-2.3Zr4+12-4.4Mg2+160-2.5La3+15-3.4Ba2+220-2.2Gd3+8-4.8Mn2+200-1.9U4+15-3.9Fe3+35-2.8Th4+16-4.0Cu2+45-2.6Cl-4002.1Zn2+100-1.9NO-31002.6Hg2+55-2.7CO2-32002.3Ni2+50-2.6SO2-41502.5Sb3+15-3.4PO3-41202.8As3+20-3.0C5H7O5COO-902.9
2.5.2合成样品分析由于自然界的稀土矿物中所含稀土元素众多,且可能在本法中相互干扰,所以我们先行实验合成样品以验证方法的实用性。按照前述实验过程,用荧光光谱法和同原射线计量分析法同时测定人工合成样品中的Eu(Ⅲ)和Ce(Ⅳ)。结果列于表3中。
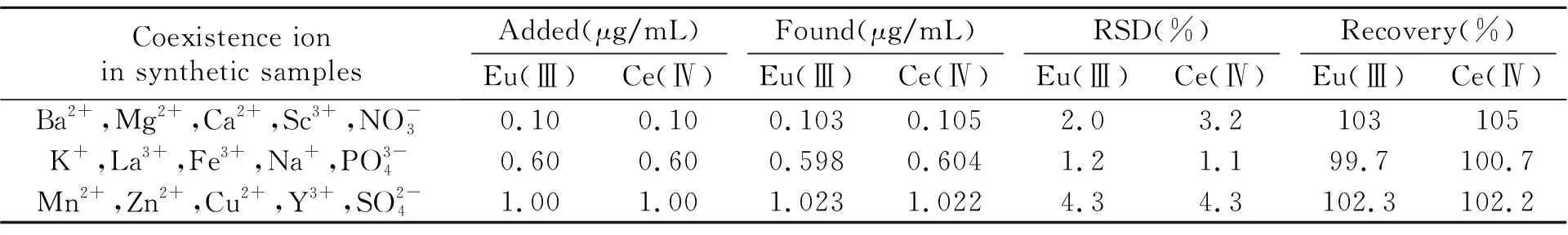
表3 合成样品的回收率测定(n=5)
3 结论
研究发现,当泛昔洛韦与Eu(Ⅲ)和Ce(Ⅳ)分别反应形成络合物时泛昔洛韦的强荧光(λex/λem=304/370 nm)可显著猝灭,且反应体系荧光猝灭程度(△F)在一定范围内荧光与Eu(Ⅲ)和Ce(Ⅳ)的质量浓度成正比。据此可用荧光猝灭光谱和“同原射线计量分析法”对Eu(Ⅲ)和Ce(Ⅳ)进行同时测定。该方法可应用于环境样品和功能材料合成样品中痕量双组分混合物的同时测定。

