谷胱甘肽在多壁碳纳米管-离子液体修饰碳糊电极上的间接电化学测定
黄娅婷, 黄 颖*
(福建师范大学化学与化工学院,福建福州 350007)
还原型谷胱甘肽(GSH)是一种富含生物活性的三肽化合物,具有清除自由基、解毒、维持细胞正常生长及增强免疫等多种生理功能。阿兹海默症、帕金森症及癌症等[1 - 3]与谷胱甘肽的含量下降有关,因此其含量检测尤为重要,现已发展出光谱法[4]、电泳法[5]、色谱法[6]及电化学法[7,8]。其中,电化学法因其灵敏、简单、快速而成为谷胱甘肽检测的重要方法。
谷胱甘肽在一般电极上过电位较高,且易发生吸附而污染电极,制约了直接电化学测定方法的应用。基于电催化介质间接测定谷胱甘肽的方法[9,10]存在重金属离子污染或检测限高等缺陷。多壁碳纳米管(MWCNTs)比表面积大,电子传导速率高,经其修饰的电极能有效地改善巯基类化合物在碳材料电极上的敏感度[11]。离子液体(ILs)导电能力强,黏合性良好,可较大提高电子传递速率和电流响应[12]。为此,本文采用多壁碳纳米管-离子液体复合修饰碳糊电极(MWCNTs-ILs/CPE),以对乙酰氨基酚(PA)为电催化介质,实现对谷胱甘肽的间接电化学测定。
1 实验部分
1.1 仪器、试剂与材料
CHI660d电化学工作站(上海辰华),三电极体系:修饰电极为工作电极,Ag|AgCl|KClsat为参比电极,铂丝电极为辅助电极。
还原型谷胱甘肽(Sigma);对乙酰氨基酚(百灵威);多壁碳纳米管(直径:20~40 nm,长度:1~2 μm,纯度≥95%)(深圳纳米技术);1-丁基-3甲基咪唑六氟磷酸盐([BMIM]PF6)(美国Strem Chemicals);磷酸盐缓冲溶液(PBS):pH=7.0。其他试剂均为分析纯。
依士安滴眼液(株式会社ISEI,广州百济新特药业)。
1.2 MWCNTs分散液及电极的制备
按文献方法[13],将1 g MWCNTs与120 mL HNO3+H2SO4(1+1)混酸混合,超声3 h得均匀分散溶液,离心分离,用二次水洗涤至中性,85 ℃真空干燥箱中烘干,即得含氧功能团的MWCNTs。取1 mg纯化后的MWCNTs加水配制成1 mL溶液,超声1 h分散均匀,即得MWCNTs分散液。
将石墨粉和液体石蜡以质量比7∶3 混合,研磨均匀,压入聚四氟乙烯管(内径25 mm)中,一端插入铜棒做导线,常温下固化12 h即得裸碳糊电极(CPE)。按上述方法将质量比为0.5∶7∶2.5的离子液体([BMIM]PF6)、石墨粉和液体石蜡制成离子液体修饰碳糊电极(ILs/CPE)。将ILs/CPE在称量纸表面抛光打磨,清洗晾干,滴加10 μL MWCNTs分散液于电极表面,自然晾干,即可得多壁碳纳米管-离子液体修饰碳糊电极(MWCNTs-ILs/CPE)。
2 结果与讨论
2.1 不同电极的电化学表征
以亚铁氰化钾为还原探针,测定三种不同电极对1 mmol/L [Fe(CN)6]4-/3-(含0.5 mol/L KCl)溶液的循环伏安响应(图1)。由图可知,[Fe(CN)6]4-/3-在MWCNTs-ILs/CPE(图1c)上的氧化还原峰电流明显高于ILs/CPE(图1b)和裸CPE(图1a)。图1A中不同扫速下氧化峰电流Ipa和还原峰电流Ipc的比值接近于1,表明MWCNTs-ILs/CPE电极具有良好可逆性,且Ipa和Ipc对扫速(0.01~0.3 V/s)平方根v1/2均呈良好的线性关系。根据Randles-Sevcik方程计算有效表面积[14]:I=2.69×105n3/2AD1/2v1/2c。式中,n为1;D为7.6×10-6cm2/s;c为[Fe(CN)6]4-/3-的浓度(1 mmol/L);A为电极的有效表面积。CPE、ILs/CPE和MWCNTs-ILs/CPE的Ipa-v1/2曲线斜率分别为52.38、77.89和109.2 μA/(V/s)1/2,按公式计算有效表面积分别为0.074、0.105和0.147 cm2。MWCNTs-ILs/CPE的有效表面积约是ILs-CPE的1.4倍,是CPE的2.0倍,表明修饰后电极的有效表面积有较大提高。
2.2 不同电极上对乙酰氨基酚的电化学行为
图2a、2b分别显示GSH在CPE和MWCNTs-ILs/CPE上在电位0~1.0 V内均无明显电化学响应。在电位0~0.7 V内,PA在MWCNTs-ILs/CPE上的峰电流响应(图2A-c)大于MWCNTs/CPE(图2A-b)和ILs/CPE(图2A-a),表明经离子液体和多壁碳纳米管复合修饰后的电极,对PA的峰电流响应有明显提高。加入GSH后,PA的峰电流响应有明显提高,且在MWCNTs-ILs/CPE上的电流响应(图2e)高于CPE(图2d)。上述实验表明在MWCNTs-ILs/CPE上PA对GSH存在着明显的电催化作用。

图2 不同条件下的循环伏安(CV)图Fig.2 CVs of different conditionsCVs of 20 μmol/L GSH at CPE (a) and MWCNTs-ILs/CPE (b);10 μmol/L PA at CPE (c);10 μmol/L PA with 20 μmol/L GSH at CPE (d) and MWCNTs-ILs/CPE (e),respectively.scan rate:0.05 V/s.Inset A:CVs of 10 μmol/L PA at ILs-CPE(a),MWCNTs-CPE(b) and MWCNTs-ILs/CPE (c).
2.3 电化学动力学参数
2.3.1电荷传递系数α对三种不同浓度的谷胱甘肽溶液进行塔菲尔(Tafel)曲线测定(图略),结果表明GSH的logI与Ep呈良好的线性关系。完全不可逆扩散控制过程方程[15]:Ep=(blogv)/2+constant。式中b表示Tafel斜率,根据n(1-α)F/2.303RT(T=298 K,n为电子转移数,α为电荷传递系数,F=96487 C/mol)可求得α。假定该反应中GSH的n为2,可得α=0.96。
2.3.2电催化氧化表观速率常数kh和扩散系数D0运用计时电流法在只含10 μmol/L PA(图3a)和不同GSH浓度下(图3b-f)对MWCNTs-ILs/CPE进行测试。表观速率常数kh根据计时电流公式:IC/IL=π1/2γ1/2=π1/2(khcbt)1/2计算[16]。式中cb表示GSH浓度。通过绘制GSH加入前后的电流比值(IC/IL)随时间平方根(t1/2)变化曲线,由曲线平均斜率可得表观速率常数kh=1.31×10-4cm3/(mol·s)。
通过Cottrell’s方程[17]:I=nFAD0c0/(π1/2D01/2t1/2)。式中n为电子转移数,F为法拉第常数,c0是GSH的浓度,可计算得D0,绘制不同浓度GSH时电流扣除背景电流(只含PA)之后的峰电流(I)随时间平方根倒数(t-1/2)的变化曲线,由I-t-1/2曲线斜率可得扩散系数D0为7.55×10-6cm2/s。
2.4 线性范围和检测限
最优实验条件下,采用MWCNTs-ILs/CPE测得GSH在不同浓度时的示差脉冲伏安(DPV)曲线(图4)。该催化氧化峰电流(Ipa)与GSH浓度(c)在7.50×10-7~1.00×10-4mol/L范围内呈良好线性关系,线性回归方程为:Ipa(μA)=0.0381c(μmol/L)+4.05,R2=0.9993,检测限为1.65×10-7mol/L。

图3 计时电流法及IC/IL-t1/2和I -t-1/2 曲线Fig.3 Chronoamperograms,plot of IC/IL-t1/2 and I -t-1/2curve a-f:0,50,100,150,200,300 μmol/L GSH with 10 μmol/L PA;Inset:plots of IC/IL-t1/2 curves and plots of I -t-1/2 curves after background subtracted (a-e:50-300 μmol/L).
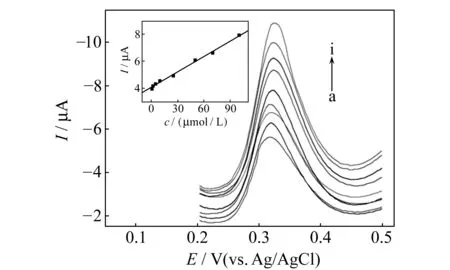
图4 不同浓度GSH的示差脉冲伏安曲线及工作曲线Fig.4 DPV curves of GSH at different concentrations and linear calibration curvea-i:0,0.75,1,2,5,7.5,10,50,100 μmol/L GSH;Inset:linear calibration curve.
2.5 共存物质干扰实验

2.6 重现性和稳定性
用同一批次5支电极平行测定10-5mol/L的GSH,其峰电流的相对标准偏差(RSD)为3.14%;用同一电极平行测定7次,峰电流的RSD为4.18%。将该修饰电极置于冰箱中4 ℃保存一个月后测定,峰电流基本保持不变,说明此修饰电极具有良好的重现性与稳定性。
2.7 样品测定
在相同实验条件下对市售依士安滴眼液(Tathion Eye Drops,65.1 mmol/L)中GSH含量进行测定。对样品进行定量分析和回收率实验,结果如表1所示。表明该方法准确可靠。
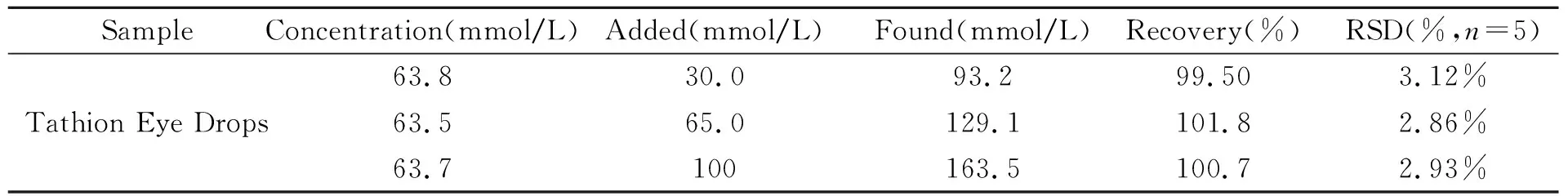
表1 样品的测定结果
3 结论
本文采用新型的多壁碳纳米管-离子液体修饰碳糊电极(MWCNTs-ILs/CPE),以对乙酰氨基酚(PA)为电催化媒介,建立了对谷胱甘肽(GSH)进行间接测定的电化学分析方法。通过计时电流法等获得了电催化氧化表观速率常数kh及扩散系数D0等。在优化的条件下,采用DPV的方法测得电催化氧化峰电流与GSH浓度之间在7.50×10-7~1.00×10-4mol/L范围呈良好线性关系,检出限(S/N=3)为1.65×10-7mol/L。利用该方法对实际样品中GSH进行了测定,测定值与标准值误差小于5%,结果可靠。

