几种常用激光解吸电离/质谱基质的基质簇峰行为研究
周丽华, 唐连凤, 邓慧敏
(1.广东工业大学轻工化工学院,广东广州 510006;2.中山大学测试中心,广东广州 510275)
基质在基质辅助激光解吸电离/质谱(MALDI/MS)表征生物分子、合成聚合物及其他小分子量物质中起到不可代替的辅助作用。但基质在激光作用下也会发生电离、裂解以及聚合等复杂的化学行为,导致MALDI谱图中出现与基质相关的质谱峰。Ehring 等[1]研究了60多种基质自身的MALDI行为;郝春雁等[2]对常用基质2,5-二羟基苯甲酸(DHB)、α-腈基-4-羟基肉桂酸(CCA)和芥子酸(SA)的MALDI/MS也进行了研究。此外,基质还易于与碱金属离子如Na+、K+等结合,产生金属加合峰。基质相关峰可干扰出现在m/z500~2 000范围的目标物,如寡聚物或小分子量物质(脂类、蛋白质酶解液)等的谱峰分析[3]。基质相关峰中对分析物影响最为显著的是基质簇峰。基质簇峰的产生与许多因素有关,如基质本身的性质、基质/样品溶液的盐浓度、pH值、基质与样品相对含量以及激光强度等。Keller 等[4]曾较系统地研究了CCA分析多肽混合物稀溶液时产生基质簇峰的情况;Reilly 等[5]采用CCA分析蛋白质酶解液能较好区别出基质簇峰、多肽峰。
本文主要对测定DNA的常用基质3-羟基吡啶甲酸(3-HPA),以及测定高分子聚合物的常用基质2-(4-羟基苯基偶氮)苯甲酸(HABA)、反式-3-吲哚基丙烯酸(IAA)和1,8,9-三羟基蒽(Dithranol)在LDI/MS 中产生基质簇峰的情况进行了研究和分析,考察了基质溶剂、浓度及激光强度对基质本身在LDI过程中产生基质簇峰的影响;对基质簇峰可能形成的过程进行了推测;对各基质簇峰进行了归属,并提出了基质簇离子峰m/z值遵循的计算公式。
1 实验部分
1.1 仪器及参数
REFLEXTMⅢ型MALDI-TOF质谱仪(德国,Bruker 公司)。氮激光器,激光波长337 nm,脉冲2 ns,延迟时间为200 ns。加速、反射器和检测器电压分别为20、23和1.55 kV。正离子反射检测模式。仪器激光强度设定为0%~100%。所用激光强度远大于引导激发阈值(激光强度阈值为能够重复产生样品谱峰所需的最低激光强度)。 谱图平均累加激光点数为50~100。
1.2 试剂
3-羟基吡啶甲酸(3-HPA)、2-(4-羟基苯基偶氮)苯甲酸(HABA)、反式-3-吲哚基丙烯酸(IAA)和1,8,9-三羟基蒽(Dithranol),均购自Aldrich公司(美国),使用前未进行任何前处理。3-HPA分别采用水、乙腈(ACN)-0.1 mol·L-1的柠檬酸氢二铵(DHC)(体积比1∶1),及ACN-0.1%三氟乙酸(TFA)(体积比7∶3)配成5、10、15 mg/mL或饱和溶液。 HABA、IAA和Dithranol分别采用四氢呋喃(THF)和二甲基甲酰胺(DMF)配成0.2 mol·L-1溶液或饱和溶液。其它试剂均购自广州试剂一厂。样品和试剂均为分析纯。
1.3 操作步骤
直接取1 μL基质溶液置于样品靶点上,室温干燥结晶,送入离子源后进行分析。
2 结果与讨论
2.1 不同溶剂体系和基质浓度对3-HPA基质簇峰的影响
3-HPA为测定DNA样品的基质,也用于测定糖类物质、磷酸化蛋白质[6]等。实验对3-HPA的水、 ACN-0.1%TFA及ACN-0.1 mol·L-1DHC的不同浓度溶液,在一定激光激发下产生基质簇峰的情况进行了研究。图1为3-HPA饱和水溶液及ACN-DHC饱和溶液的基质簇峰图。由图1a可知,图中相邻主峰之间的m/z差值为161,该值比3-HPA基质的相对分子质量(MW3-HPA=139)大22。可推测,3-HPA在形成基质簇峰的过程中,主要由基质分子中的活泼H+首先与溶液中的Na+进行交换,生成相应的Na盐(M-H+Na),然后由基质钠盐分子在MALDI过程中产生一系列相关的基质簇峰。图1(b)与图1(a)相比,最大基质簇峰离子的m/z值为873.2;主要基质簇相邻峰差值为139,恰为一个3-HPA基质的相对分子质量。表1为3-HPA在三种不同溶剂体系中产生的部分基质簇峰的归属。

图1 3-HPA(H2O)(a)和3-HPA(ACN-DHC)(b)的基质簇峰图Fig.1 Matrix-cluster peaks of 3-HPA(H2O)(a)and 3-HPA(ACN-DHC)(b)

Matrix systemm/zm/zCluster=nM3-HPA-xH+yK+zNaIon of matrix-cluster3-HPA989.2n=6,x=6,y=0,z=76(3-HPA)-6H+7Na(H2O)1 005.1n=6,x=6,y=1,z=6 6(3-HPA)-6H+K+6Na1 150.1n=7,x=7,y=0,z=87(3-HPA)-7H+8Na1 166.1n=7,x=7,y=1,z=7 7(3-HPA)-7H+K+7Na1 311.0n=8,x=8,y=0,z=98(3-HPA)-8H+9Na1 327.0n=8,x=8,y=1,z=8 8(3-HPA)-8H+K+8Na3-HPA506.4n=3,x=3,y=0,z=43(3-HPA)-3H+4Na(ACN-TFA)667.4n=4,x=4,y=0,z=54(3-HPA)-4H+5Na828.3n=5,x=5,y=0,z=65(3-HPA)-5H+6Na989.2n=6,x=6,y=0,z=76(3-HPA)-6H+7Na1 150.1n=7,x=7,y=0,z=87(3-HPA)-7H+8Na3-HPA595.4n=4,x=0,y=1,z=04(3-HPA)+K(ACN-DHC)734.3n=5,x=0,y=1,z=05(3-HPA)+K873.2n=6,x=0,y=1,z=06(3-HPA)+K
3-HPA产生的基质簇峰m/z值均遵循Keller 等[4]提出的CCA在正离子模式下的规律:
m/zCluster=nM-xH+yK+zNa
(1)
式中,x=y+z-1,y+z≤n+1,n=1,2,3,…,y或z=0,1,2,3,…,M为基质分子。
3-HPA在ACN-TFA溶液中产生的基质簇峰图与其在饱和水溶液中产生的基质簇峰图相似。但3-HPA的ACN-TFA饱和溶液相对水溶液较难产生基质簇峰,表现为在相对高的激光强度(50%)下,特别是在低于m/z500的区域中杂峰更少。另外,可检测到的基质簇峰相关峰(S/N>3)最大值为m/z1 150,远小于水溶液可检测到的值m/z2 500。由此可知,在基质溶液体系中,有机溶剂的参与虽然增加了3-HPA的溶解性,但同时可大大减少固体基质所含盐分的溶入,在一定程度上可减少基质簇峰的产生[7]。表1列出了图1中扩展图中基质簇峰可能的归属。可知,3-HPA的ACN-DHC饱和溶液产生的m/zCluster值虽然仍遵循Keller 等总结的CCA的m/zCluster公式,但与3-HPA水溶液产生3-HPA钠盐的形式形成的基质簇峰不同,其主要由3-HPA分子自身簇合而成。DHC是MAlDI测定DNA时常用的基质添加剂之一[8],可控制碱金属加合物的形成和防止分析物裂解[9]。DHC的存在可大大减少基质中盐的影响,可有效抑制钠盐参与的基质簇峰的形成。
2.2 不同激光强度对3-HPA基质簇峰的影响
实验对不同溶剂的3-HPA基质体系,分别考察了不同激光强度对基质簇峰产生的影响。对于3-HPA水溶液体系,获得分子离子峰[3-HPA+H]+(m/z140)所需激光强度为25%。 随着激光强度的增加,大于m/z140的峰逐渐产生,可观察到的基体簇峰m/z值(S/N>3)范围逐渐增大。当激光强度>45%时,可观察到基体簇峰m/z范围基本不变,小于m/z500的谱峰进一步增加,使谱图变得更复杂难解;对于3-HPA的ACN-TFA溶液体系,获得分子离子峰的激光强度为10%。激光强度>50%时,基体簇峰m/z范围基本不变;对于3-HPA ACN-DHC溶液体系,获得分子离子峰的激光强度为15%,激光强度>80%时基体簇峰m/z范围基本不变。由上可知,三种不同的基质溶液体系中,ACN-TFA与ACN-DHC体系产生基质簇峰所需激光强度远大于激光强度阈值,适当调节激光强度更易控制基质簇峰的产生。含TFA的基质体系可以更低的激光强度获得分子离子峰,这可能是由于TFA可促进3-HPA溶解,并在正离子模式下可作为质子源提供体辅助3-HPA,以[3-HPA+H]+解吸/电离的缘故。
2.3 不同溶剂体系及激光强度对高分子聚合物常用基质的簇峰的影响
实验重点研究了在LDI正离子模式下,HABA、IAA和Dithranol在不同溶剂体系及不同激光强度下产生相关基质峰的情况。结果表明,HABA、IAA和Dithranol饱和溶液比非饱和溶液更易产生基质簇峰,在DMF溶剂中比在THF中更易在较低的激光强度下获得最大m/z基质簇峰。获得HABA分子离子峰[HABA+H]+(m/z243)所需激光强度为15%,激光强度>60%时,可以观察到基体簇峰m/z范围基本不变,小于m/z400的谱峰区域杂峰变得更多,每组簇峰峰数增多,谱图变得更复杂难解;获得IAA饱和溶液的分子离子峰[IAA+H]+(m/z188)所需激光强度为15%,激光强度接近20%时,可以观察到m/z144出现;激光强度>50%时,可以观察到m/z值相差143的离子簇峰产生;激光强度>75%时,此类簇峰m/z范围基本不变,小于m/z600的谱峰区域杂峰变得更多。获得Dithranol饱和溶液的分子离子峰[Dithranol+H]+(m/z227)所需激光强度为10%,当激光强度>90%时可以观察到基体簇峰m/z范围基本不变,小于m/z600的谱峰区域杂峰变多,获得的谱峰分辨率同时也大大减低。图2为HABA( DMF)的基质簇峰图。HABA(DMF)基质簇峰的m/z值与CCA的m/zCluster值遵循相同的计算公式。图2中的一组主峰中,相邻两峰之间的m/z差值为264,该值比HABA基质的分子质量(MWHABA=242)大22。由此推测,HABA在形成基质簇峰的过程中,主要由基质分子中的活泼H+首先与溶液中的Na+离子进行交换反应,生成相应的Na盐(M-H+Na),然后由基质钠盐分子在MALDI过程中产生一系列相关的基质簇峰。图3和表2分别为IAA(DMF)的基质簇峰图和IAA谱图中各基质簇峰的归属。图中相邻两峰的m/z差值为143,比IAA的分子质量(187)小44,根据谱图中m/z值和IAA分子结构推测,这些m/z值相差143的离子簇峰由IAA的脱羧产物簇合而成。IAA在MALDI过程中的脱羧反应如下:


图2 HABA(DMF)的基质簇峰图Fig.2 Matrix-cluster peaks of HABA(DMF)
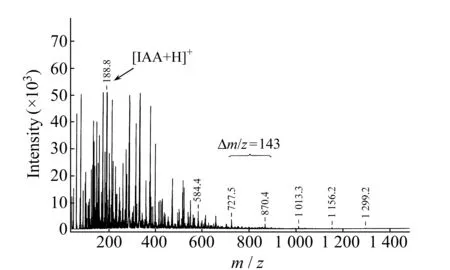
图3 IAA( DMF)的基质簇峰图Fig.3 Matrix-cluster peaks of IAA( DMF)
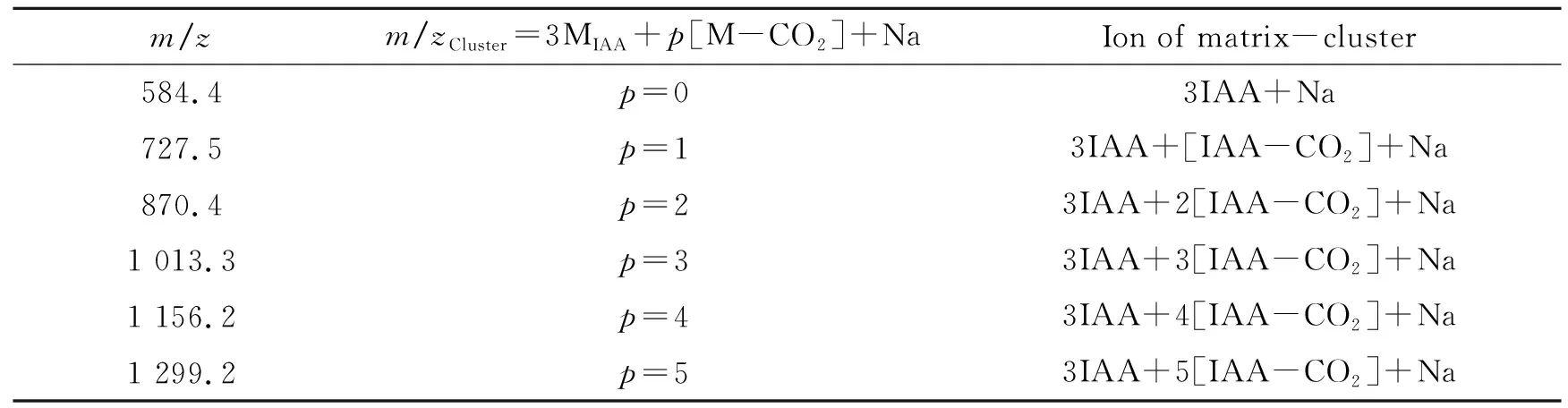
m/zm/zCluster=3MIAA+p[M-CO2]+NaIon of matrix-cluster584.4p=03IAA+Na727.5p=13IAA+[IAA-CO2]+Na870.4p=23IAA+2[IAA-CO2]+Na1 013.3p=33IAA+3[IAA-CO2]+Na1 156.2p=43IAA+4[IAA-CO2]+Na1 299.2p=53IAA+5[IAA-CO2]+Na
IAA分子在形成基质簇时,首先是自身分子之间相簇合(如m/z584.4为3IAA+Na)。当簇合分子数达到3个后,再逐渐与IAA的脱羧产物[IAA-CO2]簇合产生一系列的基质簇峰。IAA这种特殊基质簇峰的产生可能主要与其分子结构有关。由IAA(DMF)的基质簇离子的归属可知,其m/zCluster值既不符合Keller 等[4]总结的CCA基质簇峰数值规律,也不符合其总结的DHB基质簇峰数值规律:
m/zCluster=nM+p[M-H2O]-xH+yK+zNa
(2)
式中,x=y+z-1,y+z≤n+p+1,n或p=1,2,3,…,n+p> 0,y或z=0,1,2,3,…。
(IAA(DMF)的基质簇离子m/zCluster值遵循以下公式:
m/zCluster=3M+p[M-CO2]+Na
(3)
其中,M为IAA基质分子,p=0,1,2,3,…。

图4 Dithranol(DMF)的基质簇峰图Fig.4 Matrix-cluster peaks of dithranol(DMF)
图4和表3分别为Dithranol的DMF溶液的基质簇峰图和扩展图中离子峰的归属。图中显示的一组强基质簇峰的相邻两峰之间的m/z差值为226,恰与Dithranol的分子质量相符。每个强峰的右边都有一个m/z值比其大14的小峰。根据m/z值和Dithranol分子结构推测,这些小峰可能是Dithranol基质簇与一个Dithranol氧化物结合后产生的离子峰。Dithranol及其相关衍生物分子结构上10位的亚甲基可在相应条件下氧化为羰基[10]。在MALDI过程,Dithranol在激光的作用下氧化生成了分子质量比其大14的氧化产物,即1,8-二羟基蒽醌。氧化反应如下:

Dithranol(DMF)的m/zCluster值也不遵循Keller等[4]总结的规律。其遵循规律可总结为:
m/zCluster=nM+p[Onidate of M]+H
(4)
其中,M为Dithranol基质分子,n=1,2,3,…,p=0,1。

表3 Dithranol的DMF溶液基质簇扩展图离子峰的归属
3 结论
从上述对MALDI的四种常用基质的基质簇峰的研究结果可知,基质在LDI中的行为比较复杂,充分了解所用基质在LDI-TOF/MS中的行为,识别及正确解析基质簇峰,无疑有助于取得更准确的分析结果。
——饱和溶液与不饱和溶液

