微流控芯片中磁珠表面免疫反应动力学研究
韩 雪, 庞代文, 张志凌
(武汉大学化学与分子科学学院,生物医学分析化学教育部重点实验室,湖北武汉 420072)
免疫分析因其灵敏度高、特异性好已成为生物分析中重要分析方法[1],目前已在生化分析、临床检验、环境监测、食品安全等领域得到非常广泛的应用。微流控芯片具有微型化、集成化和便携化的特点,将微流控芯片与免疫分析结合可以改善免疫分析性能,减少试剂和样品消耗,缩短分析时间[2 - 4]。磁珠具有易于操控、比表面积大、偶联效率高的特点[5]。在微流控非均相免疫分析中,磁珠作为固相载体已引起了广大研究者的兴趣。因此,了解微流控芯片中磁珠表面免疫反应动力学行为对于免疫分析技术的改进与提高具有非常重要的意义,并可为设计和优化芯片结构提供参考。
本文建立了一种实时监测微流控芯片中磁珠表面免疫反应的方法。采用该方法探究了流速、分析物浓度等对磁珠表面偶联的小鼠IgG与溶液中Cy3标记的羊抗小鼠IgG的反应动力学的影响,并求出了磁球表面免疫反应的结合速率常数和解离速率常数。
1 实验部分
1.1 主要仪器与试剂
Olympus IX-70型倒置荧光显微镜(日本);IIC-200型增强型电荷耦合器件(ICCD,Princeton Instruments);旋转式恒温振荡器(太仓实验设备厂);恒流泵(保定兰格恒流泵有限公司)。
Cy3标记的羊抗小鼠IgG,小鼠IgG,2-吗啉乙磺酸(MES),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),N-羟基琥珀酰亚胺(NHS),均购于Sigma公司;牛血清白蛋白(BSA)购于BIOSHARP公司;磁珠购于AdemTech公司;聚二甲基硅氧烷(PDMS)购于GE Toshiba silicones公司;AZ400K,AZ9260购于AZ Electronic Materials公司;ITO玻璃购于深圳莱宝高科技股份有限公司。所有实验用水均为超纯水(18.2 MΩ·cm,美国Millipore公司)。
1.2 免疫磁珠的制备
免疫磁珠参考文献方法[6,7]制备:取10 μL 300 nm羧基修饰的磁珠,用1×磷酸盐缓冲溶液(PBS,pH=7.4)洗涤,除去NaN3。将磁珠分散在含有EDC和NHS的MES溶液(pH=6.0)中活化30 min。用磁力架分离磁珠,去除上层清液后,加入12 μL 1 mg/mL小鼠IgG溶液和88 μL 1×PBS溶液,在摇床上于37 ℃、150 r·min-1孵育反应4 h。反应结束后,用磁力架分离,弃去上层清液,用1×PBS清洗3~4次,以除去未反应的小鼠IgG。加入100 μL 1%BSA溶液,混匀后置于摇床上于37 ℃、150 r·min-1孵育30 min。磁力架分离后,分别用含有0.05%Tween的1×PBS清洗三次和1×PBS清洗一次。最后将偶联有IgG的磁珠分散在含有1%BSA,0.05%NaN3的1×PBS溶液中,在冰箱中4 ℃保存备用。依据文献方法[8],测定得到每个磁珠表面平均偶联约300个IgG分子。
1.3 含有镍点阵的微流控芯片的制备
芯片设计图如图1a所示,主要包括两部分:一是含有反应通道的PDMS层,二是含有镍点阵的ITO玻璃基底。芯片制作参考文献方法[9]进行。
PDMS层制作步骤如下:在硅片上旋涂AZ50XT光刻胶,75 ℃烘4 min,再于105 ℃烘8 min,在掩模下紫外曝光35 s,显影得硅阳模;将聚二甲基硅氧烷预聚体(A胶)和交联剂(B胶)按10∶1比例混匀后浇注在硅阳模上,75 ℃固化3 h,即可得到带有反应通道的PDMS层,其反应通道宽约31 μm,高约505 μm。
ITO玻璃上的镍点阵图案制作步骤如下:在ITO玻璃上旋涂光刻胶AZ9260, 75 ℃ 烘3 min,105 ℃烘5 min,在掩模下紫外曝光70 s后显影;然后利用电镀将镍沉积在ITO玻璃上,依次用丙酮、乙醇、超纯水洗去光刻胶,即得到含有镍点阵的ITO玻璃。将A胶和B胶以15∶1的比例均匀混合后旋涂在带有镍点阵的ITO玻璃上,75 ℃固化1 h,即可得到表面覆盖有PDMS的含有镍点阵的ITO玻璃。镍点阵由大小约为47 μm的正方形组成,正方形水平间距约为33 μm,垂直间距约为77 μm。将PDMS微流控芯片和含有镍点阵的ITO玻璃在氧等离子器中处理1 min后,对准键合即得到实验所用芯片。在外置磁铁作用下,镍点阵产生感应磁场,捕获磁珠形成磁珠阵列,可用于磁珠表面免疫反应过程的实时监测。当外磁场撤去时,镍柱磁性消失,通过简单冲洗即可更新芯片。
1.4 动力学实验
动力学实验步骤如下:(1)用含1%BSA的1×PBS的封闭液对通道进行封闭,流速5 μL·min-1。(2)封闭完成后用1×PBS冲洗通道,除去多余的封闭剂,流速5 μL·min-1。(3)通入偶联有小鼠IgG的免疫磁珠溶液,在镍点阵前端形成均匀稳定的磁结构,流速10 μL·min-1。(4)通入1×PBS溶液对进样孔和通道进行清洗,除去进样孔和通道中未被捕获的磁珠,流速5 μL·min-1。(5)通入Cy3标记的羊抗小鼠IgG溶液。(6)采用ICCD在线实时监测免疫磁珠表面荧光强度随时间的变化。(7)用IPP软件分析并处理实验结果。
2 实验原理
与常规免疫分析不同,微流控免疫分析通常以持续流方式将目标分析物运送到固相载体表面。微流控中免疫分析信号是固相表面免疫反应过程和溶液中分析物传质过程共同作用的结果。将免疫磁珠通入微流控芯片,在外加磁场作用下形成均匀的磁珠阵列,在不同条件下通入Cy3标记的羊抗小鼠IgG与免疫磁珠反应,用ICCD记录芯片中磁珠表面荧光信号变化,通过分析即可研究不同因素对磁珠表面免疫反应动力学的影响。芯片的设计、实验原理和实验流程见图1。

图1 芯片的设计图(a)、实验原理图(b)和实验流程图(c)Fig.1 Schematic diagrams of the designed microfluidic chip(a), the heterogeneous immunoassay in a microfluidic channel(b) and the experimental process(c)
将含有Cy3标记的羊抗小鼠IgG(A)溶液以一定流速持续流过微流控芯片通道中偶联小鼠IgG(B)的磁珠表面,磁珠表面的免疫反应可表示为:
(1)
其中,A代表抗体,B代表抗原,AB为磁珠表面免疫复合物,kf和kr分别为结合速率常数和解离速率常数。
设注射泵中羊抗小鼠IgG初始浓度为[A0],微流控芯片通道中羊抗小鼠IgG浓度为[A],磁珠表面小鼠IgG的反应位点浓度为[B],磁珠表面免疫复合物的浓度为[AB]。由磁珠表面免疫复合物质量平衡可知磁珠表面免疫复合物浓度为:
(2)
其中,DAB为免疫复合物的扩散系数,等号右边第一项是磁珠表面免疫复合物的扩散项,室验中此项可忽略。且溶液中A的浓度保持不变时,符合“Well-mixed”模式[10],磁珠表面的反应可视为准一级反应,由于检测信号荧光强度与抗原抗体复合物浓度正相关,因此磁珠表面反应动力学方程可表示为:
(3)
其中,F(t)为磁珠表面的荧光强度,Fmax为磁珠表面所有小鼠IgG反应位点都参与反应时的荧光强度。由公式(3)可得:
(4)
其中,表观速率常数kapp=kf[A0]+kr。
3 结果与讨论
3.1 流速对磁珠表面免疫反应动力学影响
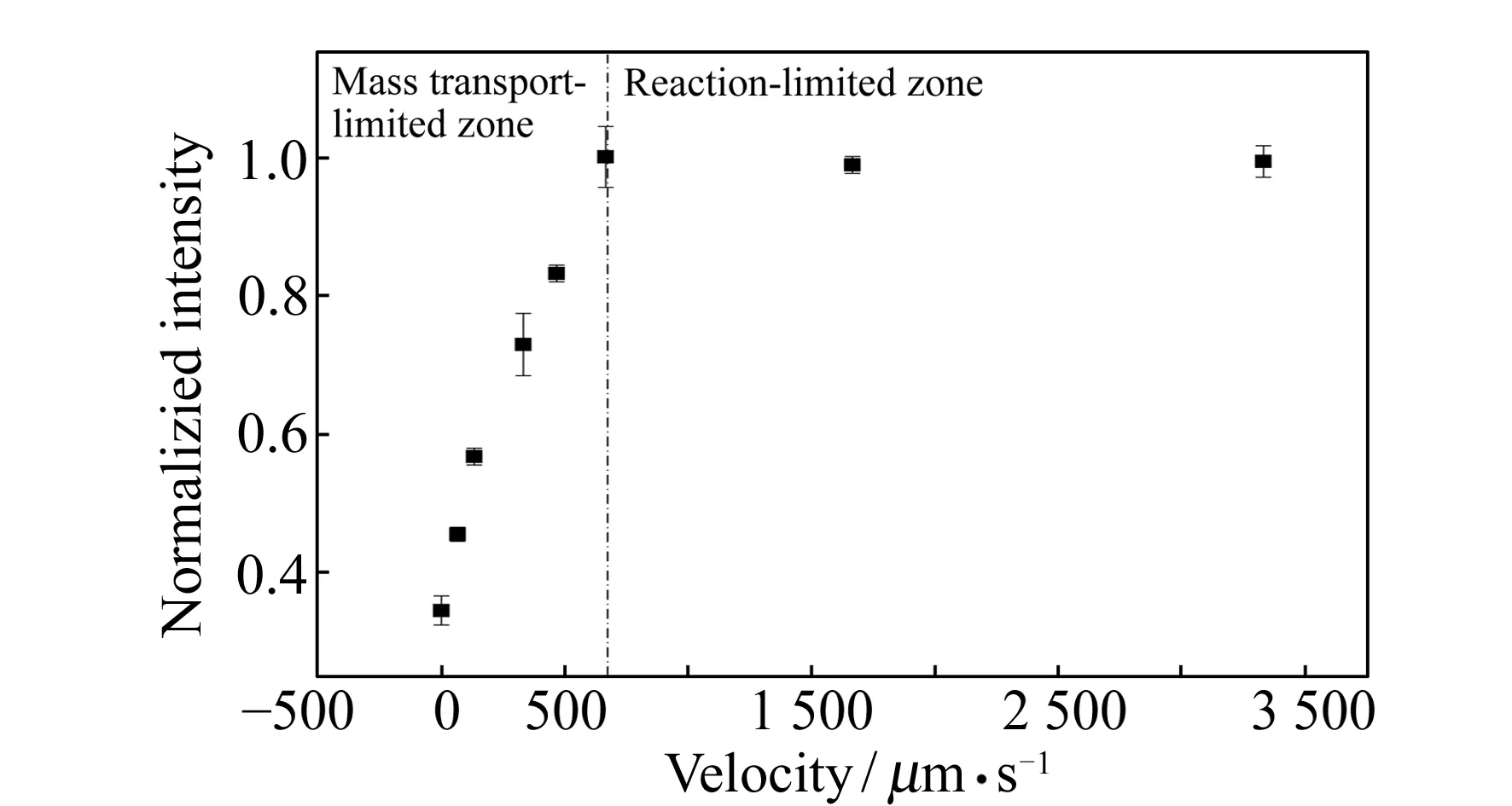
图2 流速对磁珠表面免疫动力学的影响Fig.2 Effect of flow velocity on immunoassay kinetics on magnetic bead surface
为了探究分析物的流速对磁珠表面免疫反应动力学影响,在固定抗体浓度为1 nmol·L-1时,分别在流速为0、66.7、133.3、333.3、466.7、666.7、1 666.7、3 333.3 μm·s-1时进行实验,相应条件下得到的荧光强度归一化后得到图2。由实验结果可知,注射泵中抗体浓度为1 nmol·L-1时,随着流速的增加,磁珠表面荧光强度显著增加,当流速增加到一定程度时,荧光强度不再随流速的改变而变化。这是因为微流控芯片通道中磁珠表面荧光强度是流体中分析物传质过程和磁珠表面免疫反应共同作用的结果[11]。分析物(抗体)以浓度c0进入通道并与磁珠表面的抗原发生免疫反应。流速较小时,分析物补充较慢,此时反应处于传质限制区域;当增加流速时,佩克莱数(对流项与扩散项的比值,Pe=uw/D,u为流速,w为混合长度,D为扩散系数)增加,对流作用的比例增加,分析物得到较快补充,直至分析物的传质速率大于磁珠表面免疫反应的速率,此时磁珠表面的免疫反应不再受传质限制,进入反应限制区域[11],此时由于分析物补充充分,增大流速对反应影响不大。由上述分析可知,当反应在传质限制区域时,增大流速免疫反应速率加快,能在较短的时间内得到较大的检测信号,然而这是以试样的消耗为代价的,当样品稀少时可以选择较低的流速反应较长的时间。
3.2 浓度对磁珠表面免疫反应动力学影响
分别采用浓度为1、3、5、7、10 nmol·L-1的Cy3标记的羊抗小鼠IgG溶液,以666.7 μm·s-1的流速持续流过磁珠表面,得到相应的荧光强度如图3所示。由图可知,随着分析物浓度的增加,磁珠表面的荧光强度变大。由于流速为666.7 μm·s-1时抗体浓度≥1 nmol·L-1,磁珠表面的免疫反应进入反应限制区域,实验条件满足“Well-mixed”模式对于通道中分析物浓度保持不变的要求,实验结果良好的符合“Well-mixed”模式。图4为磁珠表面免疫反应的结合率(Binding%)在不同浓度下随时间的变化。结合率为每点的荧光强度与理论拟合得到的反应平衡时最大荧光强度的比值。由图可知,反应相同时间,分析物浓度越大,反应达到平衡所需时间越短。

图3 抗体浓度对磁珠表面免疫反应动力学的影响Fig.3 Effect of antibody concentration on immunoassay kinetics on magnetic bead surface
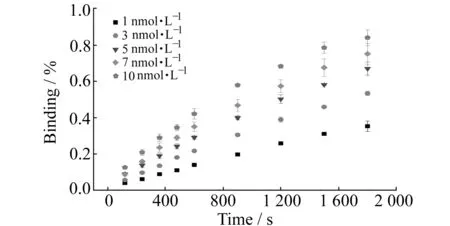
图4 不同浓度抗体的结合率随时间的变化Fig.4 Plots of binding ratio vs time at different antibody concentrations

图5 表观速率常数随浓度的变化Fig.5 Relationship between apparent rate constant and antibody concentration
3.3 结合速率常数和解离速率常数
表观速率常数与浓度的关系见图5。可知,当抗体浓度≥1 nmol·L-1,流速为666.7 μm·s-1时,磁珠表面的免疫反应进入反应限制区域。此时微流控芯片通道中分析物浓度保持不变,磁珠表面的免疫反应可用准一级速率方程来描述,其中表观速率常数为:kapp=kfc+kr。表观速率常数与抗体浓度成正比,通过将不同浓度的抗体溶液持续流过微流控芯片通道中磁珠表面,即可求出免疫反应的结合速率常数。由实验结果可知kapp=7.9×104c+1.7×10-4·s-1,kf=7.9×104L·mol-1·s-1,kr=1.7×10-4s-1。
在不受传质限制的条件下,实验发现在磁珠表面免疫反应最初结合阶段(0~600 s),磁珠表面的荧光强度随时间线性增大(图6)。对前600 s的数据点进行线性拟合得到不同抗体浓度时的斜率值,然后将斜率(y)对相应浓度(x)作图。结果表明斜率值随Cy3标记的羊抗小鼠IgG浓度增大而呈线性增长,线性方程为:y=0.15x+0.048,也就是说反应开始10 min后就可以估计通入的抗体浓度。此方法可用于分析物浓度的初步确定。
3.4 浓度和流速对磁珠表面免疫反应动力学共同影响结果
为评估不同抗体浓度在不同流速下对磁珠表面免疫反应的影响,进行了如下实验:采用浓度分别为1、10、100 nmol·L-1的分析物溶液,在流速分别为66.7、333.3、666.7 μm·s-1时进行实验,直到磁珠表面的荧光强度不再变化,反应达到平衡,记录平衡时间。
由图7可知,当分析物浓度为1 nmol·L-1,流速为667 μm·s-1时达到平衡所需时间仅为流速为66.7 μm·s-1时的40%左右。这是因为磁珠表面免疫反应受传质限制影响大,增大流速有效减少传质限制,在这种情况下,选择较大流速有利于实现快速检测。当分析物浓度为100 nmol·L-1时,改变流速对达到平衡所需时间无明显影响。这是因为磁珠表面免疫反应受传质限制影响小,在这种情况下可以选择小流速进行实验,在减少试剂消耗的情况下达到同样的反应效果。总之,合理的搭配流速和分析物浓度对于实现快速、低消耗检测具有重要意义。
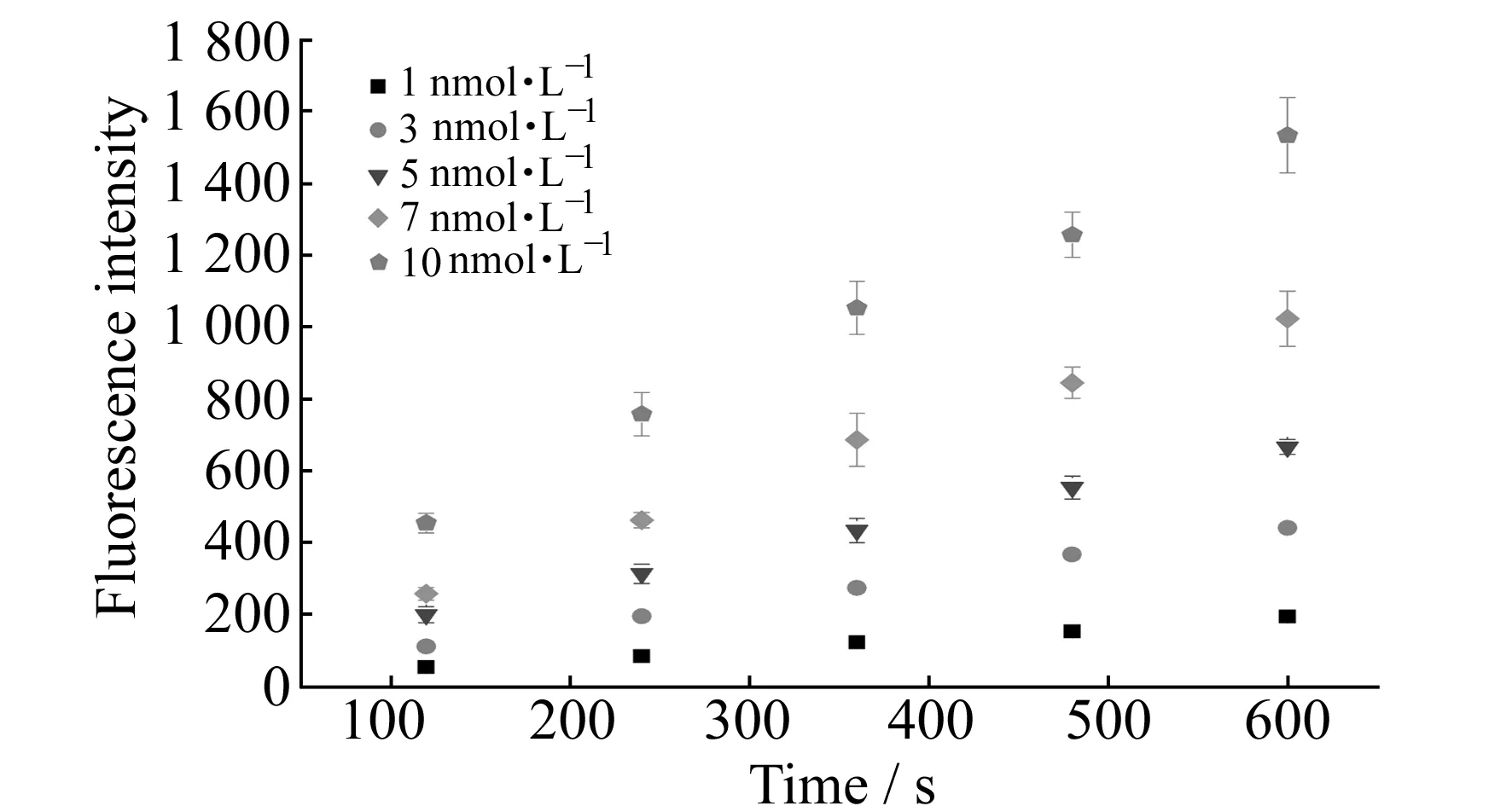
图6 流速和浓度对磁珠表面免疫反应共同作用结果Fig.6 Effects of flow rate and concentration on the immunoassay on magnetic bead surface
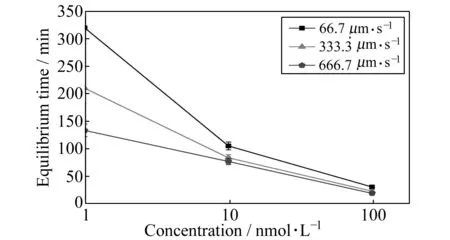
图7 不同浓度的分析物前600 s内荧光强度随时间的变化Fig.7 Fluorescence intensity changes of different concentration analytes within the first 600 seconds
4 结论
本文建立了一种实时监测微流控芯片中磁珠表面免疫反应的方法。通过该方法探究了流速、分析物浓度对磁珠表面免疫反应动力学的影响,并获得了相关的结合速率常数和解离速率常数。实验结果表明,增加流速可以有效减小传质限制,提高免疫反应效率,但当流速增大到一定程度时,继续增大流速对免疫反应的贡献较小,并且会增加试剂消耗。溶液中分析物浓度较大时,磁珠表面的免疫反应速度快,流速大小对免疫反应的影响不大,此时选择较小的流速有利于减少试剂消耗;当溶液中分析物浓度较小时,增大流速有利于分析物的快速补充,可以有效地缩短分析时间。因此根据实验条件选择合理的流速有利于实现快速、低消耗检测。

