基于核酸的疾病诊断技术新进展
彭双,李娓,田沺,周翔
武汉大学化学与分子科学学院,武汉430072
基于核酸的疾病诊断技术新进展
彭双,李娓,田沺,周翔
武汉大学化学与分子科学学院,武汉430072
随着现代生活品质的不断提升,疾病早期诊断的重要性日益凸显,因此越来越多研究工作致力于发展新的疾病诊断技术。“精准医学”的提出,为新技术的发展提出了更高的要求,也代表着人们更高的期盼。在“精准”的道路上,化学生物学,小分子作为探针,用于生命体系内重要生物靶标的检测与功能调控,已成为生物与医药领域发展的新的趋势与方向。与此同时,核酸作为遗传物质,其结构、功能、化学修饰等,皆与基因表达、蛋白质的合成、细胞信号转导等重要生命过程密切相关。因此,核酸相关的生物靶标具有重大研究价值,对于重大疾病的机制研究,创新药物的开发,疾病诊断等有重要意义。这里,我们将对适配子技术和一些核酸相关重要靶标,如核酸表观遗传修饰、循环miRNA等的化学法检测这几个方向的新进展,进行讨论和总结,为后续研究工作提供参考。
核酸;疾病诊断;适配子;核酸表观遗传修饰;循环miRNA;检测
在生命健康备受关注的今天,重大疾病的早期诊断越来越成为人们迫切的需求,因此也成为了科学家们积极追求的目标。随着人们对生命科学的不断探索,许多重大疾病的发病机制正在被逐渐阐明,尤其是核酸这个遗传物质,在众多重大疾病发生发展过程中所扮演的重要角色,正在得到越来越广泛的认识[1]。与此同时,化学生物学是近几十年发展起来的交叉领域,其利用化学法及小分子来干预一些重大的生命过程[2],以研究相关作用机制,从而对重要生物靶标进行靶向和功能调控,最终为临床医学服务。与传统的生物学方法相比,化学法更为灵活多变,探针设计更易控制,成本也相对较低,因此已经被广泛用于生物分子的研究[3]。
正是这些理论与技术的创新,使得基于核酸的疾病早期诊断以及在此基础上的靶向治疗成为可能,以此为目标的科学技术和理论研究也蓬勃发展起来,并且在此基础上,提出了精准医学[4]。所谓精准医学,既包括精准诊断,又包括精准治疗。精准,换言之也就是靶向性和特异性,此外简单和快速也是基本前提。关于靶向性和特异性,除抗体以外,适配子是一个理想的选择,且由于其易修饰、易调控、廉价易得的特性,正在被越来越广泛的应用于各种疾病相关生物靶标的检测[5]。精准医学的所谓精准,另一层面上意味着个体化的诊断或治疗,即在了解不同个体基因组信息的基础上,设计的具有针对性的诊断和治疗方案。这个前提是基于测序技术的突飞猛进和价格的不断降低。
与此同时,近年来核酸表观遗传修饰研究的兴起[6],告诉大家,影响人体疾病发生的,除了基因组信息的改变之外,还有表观遗传信息的改变[7]。因此发展高效、高选择性的方法,用于各种核酸表观遗传修饰的检测和表观遗传信息图谱的绘制,对于疾病的早期诊断至关重要。此外,随着研究的不断深入和拓展,核酸家族中,一些曾经被忽略的成员,主要包括各种非编码的核酸,它们的重要功能被发现。这引起了人们极大的兴趣,包括研究它们与各重大疾病的相关性,在疾病发展中所起的功能以及针对它们的特异性检测。
1 适配子技术在重大疾病诊断及治疗中的应用
适配子是人工合成的单链寡核苷酸( DNA 或RNA),能够与靶物质进行高特异性与亲和性地结合[8],其功能类似抗体,但比抗体具有更多的优势。它可以通过指数富集的配体系统进化技术进行体外筛选、扩增和富集。这项技术最早源于1990年Gold课题组[9]和Szostak课题组[8]的研究,他们分别从人工合成的随机寡核苷酸库中筛选得到了特定靶标的寡核苷酸配体,并命名了这项技术,筛选得到的靶物质的相应寡核苷酸配体则是所谓的适配子。适配子技术是基于包含随机序列文库的设计和多轮文库与靶标相互作用、洗脱、扩增、再相互作用这样一个循环操作,来达到适配子对靶标的高选择性和高亲和力,以及其针对不同类型靶标筛选的广泛的适用性。同时,体外筛选的操作过程也更简单可控。由于适配子本质上是一段寡核苷酸链,因此各种修饰、偶联简单易行,这为其在诊断医学及靶向药物输送方面的应用,提供了广阔的空间。目前研究和应用最多的适配子主要有凝血酶thrombin的适配子TBA[10]、进入二期临床的抗肿瘤活性适配子AS1411[11]、细胞特异性的适配子sgc8[12]等等,以及它们各自的衍生化适配子序列。目前的研究主要致力于将这些经典的适配子通过化学修饰,与荧光团、纳米材料、药物分子等偶联在一起,实现活体检测或可控药物释放的目的。
1.1 适配子技术在重要生物靶标检测中的应用
适配子作为一个核酸分子,其与靶标的结合通常依赖于特定构型的形成和稳定,例如茎环结构、G-四链体等,因此,适配子用于特定靶标的检测通常是基于其与靶标相互作用前后,构型变化导致信号单元发生变化而输出检测信号[13]。这方面的例子有很多,例如早期凝血酶的适配子TBA发现后,结合纳米粒子或荧光小分子作为探针,用来检测凝血酶。又如ATP、金属离子、可卡因等这些小分子的适配子筛选出来后,结合分子信标、量子点等设计,也被用于这些生物分子的检测[14]。近年来,适配子在生物靶标检测中的应用更为广泛,并且探针体系的设计更为多元化,常常是与新材料、新的分析技术结合在一起,作为复合体系,例如显色体系、电化学检测体系、荧光体系、质量响应体系等,以达到灵敏度更高的检测,以及在活体内的应用[13]。
适配子与纳米材料相结合最大的优点就在于,多种纳米材料都可以通过内吞而进入细胞,这样适配子可以轻易被携带进入细胞,这是适配子用于活细胞内的检测或诊断的前提。最近就有报道一个基于石墨烯的检测体系,如下图所示(图1),能同时在细胞内检测ATP和GTP[15]。ATP、GTP这类小分子的适配子很容易筛选得到,也容易被荧光标记,它们通过π-π堆积,就可以与石墨烯结合,同时荧光被淬灭。当进入细胞后,与各自的靶标作用后会脱离石墨烯,并产生荧光恢复。由于石墨烯的应用已较为成熟,因此该体系从简单、廉价及能在活细胞内应用等角度来看,都具有临床应用的前景。

图1 基于适配子的石墨烯检测ATP、GTP示意图[15]Fig.1 Schematic illustration of in vitro and in situ molecular probing in living cells by using the aptamer/GO-nS nanocomplex
最近,谭蔚泓教授课题组结合适配子和MnO2nanosheet,构建了一个荧光/磁共振双重响应的检测平台,用于肿瘤细胞成像[16]。如下图所示(图2),在这个体系中,适配子sgc8是作者前期筛选得到的细胞适配子,其具有G-四链体的二级结构,通过调控这种结构的形成和打开,已经被应用到多个药物释放体系,进行靶向药物释放。这里,纳米体系与细胞的相互作用就依赖于sgc8与细胞表面受体的作用。而纳米体系选择的是可被还原的MnO2nanosheet,其被还原成为Mn2+后,可用于磁共振造影。同时这种nanosheet又可以作为适配子的运载工具,以及荧光团的淬灭剂。这样多重的功能使得这个体系可以成为荧光和磁共振双重响应的细胞成像体系:荧光响应来自于荧光标记的适配子,其被MnO2nanosheet荷载,且荧光被淬灭,通过内吞进入细胞后,在MnO2nanosheet被细胞内GSH还原而瓦解后,自然而然释放出来,并恢复荧光;磁共振响应来自MnO2nanosheet被还原后产生的Mn2+。荧光和磁共振用于细胞成像各有优势,一个灵敏度高,一个组织穿透力强,因此,这个报道中,两者的结合,使得这两个优势结合在了一起。

图2 基于适配子和MnO2 nanosheet的荧光/磁共振双重响应的检测平台[16]Fig. 2 Activatable fluorescence/MRI bimodal platform for tumor cell imaging via MnO2 nanosheet-aptamer nanoprobe
适配子也被用来检测循环肿瘤细胞。循环肿瘤细胞检测是近年来研究领域和临床诊断的一个热门课题,由于其对于预后评估十分重要,因此大量研究工作致力于开发更灵敏、简单的循环肿瘤细胞检测体系。传统基于抗体识别的循环肿瘤细胞检测和捕获方式较为费时费力,而基于细胞适配子技术筛选出来的特定肿瘤细胞的适配子,提供了简单廉价且特异性良好的循环肿瘤细胞识别基础。如下图所示(图3)的这个例子,适配子选用针对肿瘤细胞标志物CD30 biomarker的适配子,并设计成为一个带有荧光团和淬灭团的发夹结构[17]。当适配子识别其相应的位于肿瘤细胞表面的特定受体时,其通过受体介导的内吞可进入细胞,随后会进入溶酶体,在低pH的溶酶体中,这个适配子探针可以被降解,随之产生被单个的荧光标记碱基,而荧光释放。这个体系检测循环肿瘤细胞可以在全血或穿刺组织中完成,而且背景极低,几乎无脱靶效应,较抗体更灵敏。

图3 适配子用于检测循环肿瘤细胞[17]Fig. 3 Schema of the tumor cell-activatable aptamer-reporter for one-step assay of circulating tumor cells (CTCs) in a whole blood sample
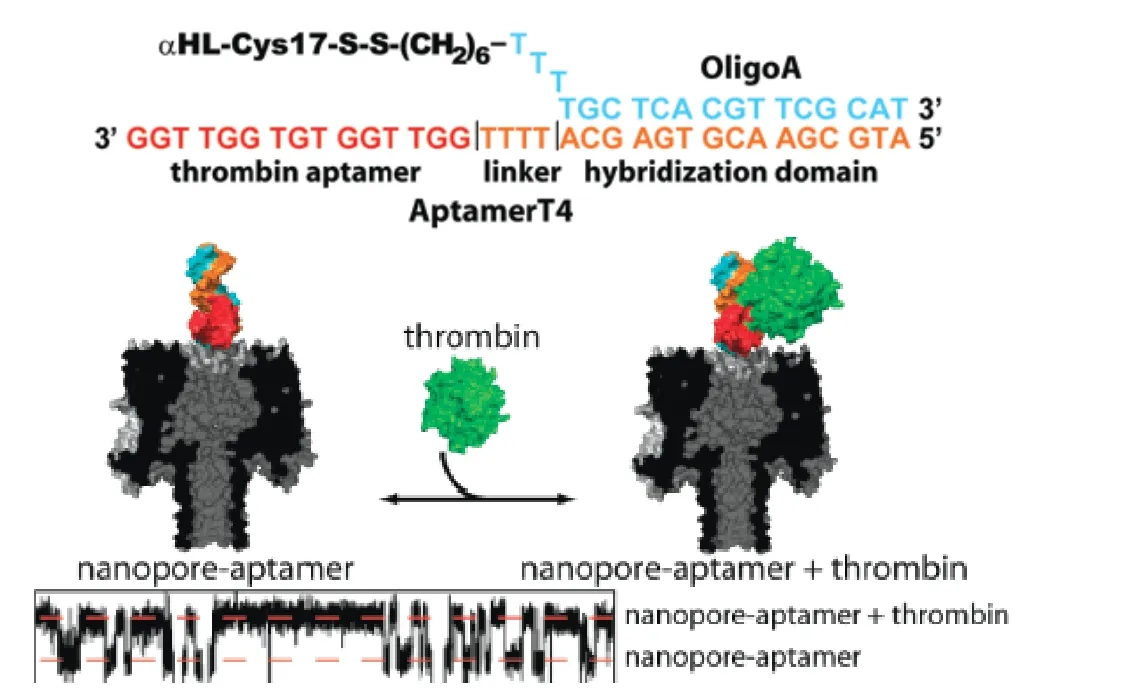
图4 纳米孔用于凝血酶检测[18]Fig. 4 Protein detection by nanopores equipped with aptamers
适配子的应用不仅通过与各种新型纳米粒子结合实现,近年来也被引入到纳米孔的设计体系中。纳米孔是近年来开发的一种新型纳米材料,被成功用于许多靶物质的单分子检测,检测的信号通常是源于单个待测靶物质分子通过纳米孔材料时,与纳米孔作用而产生的电信号变化。而纳米孔被用于检测蛋白时,由于蛋白较大,通常不易穿过孔道,因此常常是通过各种设计,将孔道外结合某待测靶标产生的变化,转变为孔道内的某种改变,从而产生电信号变化。最近有报道,将核酸适配子通过特定的DNA接头固定到纳米孔的入口处,由于适配子可选择的范围非常广,可以是任意靶标的适配子,因此这种纳米孔的体系可以用于广泛的生物靶标检测。下图(图4)所示的是将凝血酶适配子TBA序列固定到纳米孔的入口处,用于检测凝血酶[18]。这里用于连接纳米孔和TBA的DNA接头是一条18nt 的单链序列OligoA,通过二硫键与纳米孔相连。适配子TBA序列通过设计成能与OligoA杂交的aptamerT4,而与纳米孔关联起来。待测物质凝血酶加入后,可导致电信号的增加。
1.2 适配子在药物靶向释放中的应用
适配子除广泛用于各种生物靶标的检测或成像外,还有很多时候被用在靶向药物释放中,或者有些适配子本身就具有抗肿瘤活性,而作为潜在抗肿瘤药物。作为药物释放工具的适配子,通常都是利用其特定的二级结构,作为药物的载体,在细胞内环境中,低pH或还原性环境,适配子结构打开或被降解,而使得药物释放出来。有时适配子结合多孔材料,像盖子一样将药物封闭起来,在特定细胞内环境中被打开,而释放药物。
图5所示的是一个基于转铁蛋白受体的RNA适配子的药物释放体系,适配子结合DOX和一个针对NF-κB的抑制剂,在细胞内同时释放这两种药物,起到协同的抗肿瘤效果[19]。在适配子体系的设计中,该文在转铁蛋白适配子的基础上增加了一段双链的尾巴,用来与DOX结合,这样成功的增加了DOX的荷载量。而针对NF-κB的抑制剂是一段双链DNA,叫做NF-κB decoy,它被通过二硫键连接在适配子尾巴的5’-端,这成功解决了NF-κB decoy不易进入细胞的问题。在细胞内环境中,二硫键可以顺利被还原而断开,使得NF-κB decoy释放出来。

图5 基于适配子的DOX、NF-κB抑制剂双重药物释放体系[19]Fig. 5 Aptamer-mediated codelivery of doxorubicin and NF-κB decoy
基于适配子的药物释放体系设计非常丰富多样,早些时候,谭蔚泓课题组设计了一个自组装的3D DNA纳米结构(图6)[20]。在这个DNA纳米结构中,包含有适配子、抗肿瘤药物、反义核酸等多种要素,是这个体系具备靶向性和抗肿瘤活性双重功效。如下图所示,负责携带适配子、抗肿瘤药物、反义核酸的功能区域,被设计组装成Y形的结构,并通过杂交,与一个X形的connector结合,形成构成3D DNA纳米结构的单元。这些结构单元通过光交联可以形成最终的3D结构,它可以通过适配子与癌细胞表面相应受体的作用,而被内吞进入细胞。这个体系构建之后,作者用其同时荷载DOX、适配子sgc8、针对P-糖蛋白(P-gp)的反义核酸MDR1,达到了提高药物荷载量和靶向性,降低肿瘤细胞产生化疗药物抗性的复合疗效。这个体系的构建具有广泛的应用范围,可以结合不同适配子、不同药物等其他元素,组装成针对各种癌细胞的活性体系。
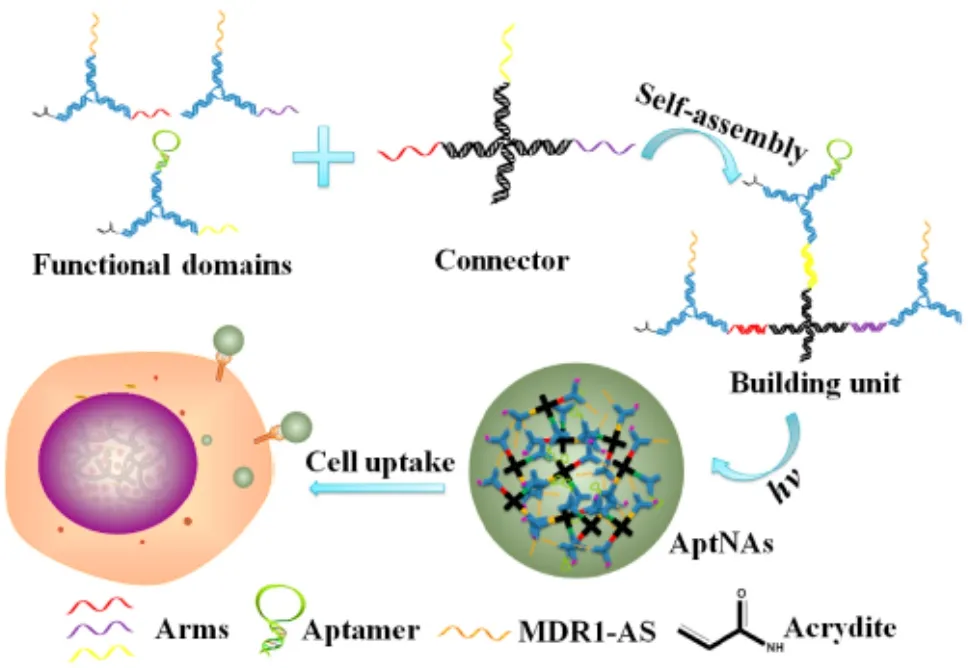
图6 基于适配子的自组装体系[20]Fig. 6 A multifunctional aptamer-based DNA nanoassembly for targeted cancer therapy
2 化学法用于核酸表观遗传修饰的检测
表观遗传现象和相应的理论是经典遗传学的有益补充和扩展,其与生命体的生长、发育,众多疾病的形成、发展,甚至癌症等重大疾病有着密切的关系,因此近年来,引起了学术界越来越多的关注。随着认识的不断深入,所谓表观遗传,这些碱基顺序改变以外的基因改变,以及组蛋白翻译后修饰和非编码RNA等,已被普遍认为在生命体系中扮演者至关重要的作用[21]。最近研究发现,这些表观遗传修饰不仅可遗传,同时也是可逆的。因此,对于它们的靶向和调控,在疾病诊断和治疗以及药物开发方面更具意义。
由于胞嘧啶羟甲基化(5hmC)、醛基化(5fC)、羧基化(5caC)等新的胞嘧啶氧化产物的发现[22],曾用于5mC特定位点检测的经典方法重亚硫酸钠法,不能完全满足对各种胞嘧啶氧化产物的区分,抗体及特异性的酶也没有发展完善,因此化学法及小分子探针的发展成为了热点问题。在化学法和有机小分子用于5mC的定性、定量及在全基因中的图谱绘制方面,Okamoto, A.[23],[24]、Carell, T.[25]、王树[26]、周翔[27,28]等在前期均有大量工作报道。这里我们重点介绍5-羟甲基胞嘧啶(5hmC)的化学法检测。
对于5-羟甲基胞嘧啶(5hmC)的化学法选择性标记,目前主要的途径有几种,一是利用β-糖基化转移酶β-GT将5hmC上C5羟基糖基化修饰,然后通过click反应偶联亲合标签,进行富集和测序分析[29];二是将其氧化成醛基,再进行检测分析[30]。由于糖基化酶转移葡萄糖的反应,对于CpG上羟甲基化位点对称分布的情况效率不高,这带来前一种策略在分析一些高5hmC分布样本时的一些问题。此外,测序分析虽然能达到单碱基分辨率,但由于其中涉及到的酶较为昂贵,因此实验成本仍然较高。最近,Ebenstein, Y.等在该策略基础上,发展了一个荧光检测体系(如图7所示),将此前用于富集的亲合标签生物素换成荧光团Cy5,从而将富集测序分析转变为直接荧光检测[31]。这个体系对于全基因水平上5hmC的定量是有效的,并且将这个体系植入芯片上,可以做到较高通量的检测,具有较好的实际应用前景。

图7 基于糖基转移酶的荧光标记体系[31]Fig. 7 Spectroscopic quantification of 5-hydroxymethylcytosine in genomic DNA.
除了上述通过β-糖基化转移酶,转移叠氮基标记的糖环至5hmC的羟甲基上,作为后续富集或荧光标记的反应位点,Bayley,H.等发展了另一种直接对5hmC上羟甲基进行化学修饰的方法,实现在非酶反应条件下,对其简单高效的生物素或荧光团标记,并结合纳米孔技术,达到了对基因组中5hmC的单分子检测 (图8)[32]。该体系利用的是亚硫酸氢钠介导的巯基取代反应,将5hmC中羟甲基转化为巯基化物,而生物素或荧光团则通过与巯基化物偶联,而间接的与5hmC相连。这里所用的巯基化物为含有巯基的氨基酸,即GSH或半胱氨酸,它们除巯基外,也含有易于发生衍生化反应的胺基及羧基取代基,有利于进行多种功能化修饰。在低浓度亚硫酸氢钠42 ℃、pH 5.0反应条件下,5hmC上羟甲基先生成的exo-甲烯基中间体,再与巯基亲核试剂发生加成及消除反应,最终生成巯基取代物。另一方面,由于GSH及半胱氨酸上都有能与生物素或荧光团反应的胺基,因此,通过经典的胺基与羧基化物的偶联反应,就可以实现多样化的化学修饰。这个巯基取代反应的应用很大程度上减小了之前β-糖基化转移酶反应体系的成本和操作的复杂性。
在氧化策略方面,Balasubramanian S.等首先用高钌酸钾氧化的策略结合亚硫酸氢钠法,实现了基因组水平上对5hmC单碱基分辨率的测序分析[30]。但这种方法需要进行差减分析,来区分5mC与5hmC,这一方面增加了实验操作和背景信号,另一方面对样本量也有较高要求。

图8 亚硫酸氢钠介导的巯基化物标记5hmC体系[32]Fig. 8 Single-molecule detection of 5-hydroxymethylcytosine in DNA through chemical modification and nanopore analysis
周翔教授课题组发展了氧化法结合荧光探针分子的策略,实现了对5hmC的荧光标记 (图9)[33],在对特定位点进行5hmC的判断时,仅通过凝胶电泳扫描成像就能分辨。研究中,采用更温和的氧化剂二氧化锰,将5-羟基胞嘧啶氧化为5-醛基胞嘧啶[34],随后只需选择合适具有高反应活性的带胺基荧光团与之偶联,即可实现其荧光标记。在用于长链DNA中5hmC测试分析时,发现二氧化锰氧化效率只能达到50%,这可能限制其在基因组样本检测中的应用。不过只要将氧化剂换为氧化效率更高的高钌酸钾,我们荧光小分子标记的策略仍然有效。荧光标记的方法最大的优点是可以通过荧光强度的测定,进行5hmC在基因组中的定量分析。由于越来越多的文献报道5hmC在基因组中的水平与一些疾病,如糖尿病、肿瘤相关,通过我们开发的荧光小分子标记策略,实现对临床样本进行高效简单的5hmC水平分析,意义十分重大。

图9 荧光小分子检测5-羟甲基胞嘧啶[34]Fig. 9 5-hydroxymethyl cytosine detection through direct chemical modification
上述方法通过荧光小分子直接标记修饰碱基,检测可以通过凝胶电泳直观地定性观察,也可以通过测定荧光强度定量分析。与此同时,基于荧光共振能量转移(FRET)的荧光标记体系,是另一个常用的生物靶标定量检测的体系,其高灵敏度及低背景的特点均使其被广泛应用。周翔教授课题组发展一种基于FRET的荧光检测体系 (图10),结合以上高钌酸钾氧化策略,检测5-羟甲基胞嘧啶[35]。FRET体系采用前期文献报道的阳离子荧光聚合物(CCP),其与DNA相互结合的性能,及与荧光标记dNTP发生FRET的性质。我们先用高钌酸钾将5-羟甲基胞嘧啶氧化成5-醛基胞嘧啶,5-醛基胞嘧啶与前期发展的带羟胺的BODIPY化合物发生反应,从而标记上荧光,进而与阳离子荧光聚合物(CCP)发生FRET。通过检测FRET荧光强度可定量检测DNA中 5-羟甲基胞嘧啶的含量,该方法成本低、简单、快速,并且定量检测时,线性范围较宽。
最近,袁必锋教授课题组发现一个小分子化合物2-bromo-1-(4-dimethylamino-phenyl)- ethanone (BDAPE)如下图11 结构所示,其能与胞嘧啶碱基反应成环,结合液-质联用检测技术,不同种类的胞嘧啶表观遗传修饰与之反应后,在质谱图上显示不同的分子离子峰[36]。这里,小分子化合物BDAPE的应用,将几种胞嘧啶修饰在液相色谱中的差异大大提高,原本由于含量低、保留时间接近,而无法分开的几种胞嘧啶修饰,在被小分子修饰后,能在液相色谱中被明显区分开来,随后通过质谱就可以鉴定其种类。由于质谱检测一个显著的优点在于灵敏度高,因此,这种方法可以检测这些在细胞中含量极低的胞嘧啶表观遗传修饰。对于5-mC, 5-hmC, 5-foC及5-caC,检测限分别能达到0.10, 0.06, 0.11, 0.23 fmol。虽然这个质谱检测体系无法实现基因组水平上的特定位点检测,但对于整体上的定量分析却是切实可行的,对于不同样本,包括动物组织,植物等各种样本的全基因胞嘧啶表观遗传修饰定量分析十分有效。

图10 FRET原理用于DNA中5-羟甲基胞嘧啶的检测[35]Fig. 10 Fluorescent strategy based on cationic conjugated polymer fluorescence resonance energy transfer for the quantification of 5-(Hydroxymethyl) cytosine
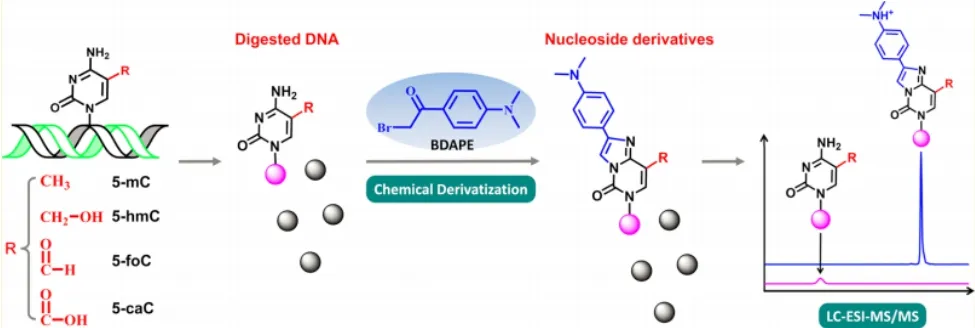
图11 化学修饰结合质谱技术的各种修饰胞嘧啶检测体系[36]Fig. 11 Determination of 5-Methylcytosine and its oxidation products by chemical derivatization coupled with Liquid Chromatography-Tandem Mass Spectrometry Analysis
3 循环miRNA及其检测
MiRNAs是一类长度为18~25nt的非编码RNA,通过与靶mRNA作用降解或者抑制转录来调控基因表达。越来越多的研究证明miRNAs在癌症的引发、生长、转移过程中发挥着重大作用[37-40]。而循环miRNA是一种稳定性更好的RNA分子,在经过反复的冻融、极端的pH环境、长时间在室温存储等条件下依旧表现出良好的稳定性。它在体内的发现,最早见于Chim等在孕妇血浆中发现胎盘miRNAs(miR-135b, miR-141, miR-149, and miR-299-5p等)[41],自此揭开了身体细胞分泌和释放miRNAs的帷幕。接下来科学家们在各种体液(血清、血浆、唾液、眼泪、乳汁和尿液)中发现了一些miRNAs。这些胞外miRNAs和分泌miRNAs,总称脱细胞miRNAs(cell free miRNAs)或循环miRNAs(circulating miRNAs)。循环miRNA并不是裸露的RNAs而是和蛋白质(比如Ago-2蛋白,Ago-2蛋白是RISC的主要组成成分)相结合。这些蛋白在cfmiRNAs的具有调控细胞间通讯的作用,而细胞间通讯对于靶细胞的miRNA库具有重大影响[42-44]。总的来说,miRNAs与蛋白形成复合物能增加其在体液中循环时的稳定性。
循环miRNA进入体内可能有三种方式(1)凋亡或坏死细胞的被动释放(2)微泡的主动释放(3)非微泡的RNA结合蛋白依赖的主动释放[45]。在过去的几年里,越来越多的文献已经证实 miRNA的表达在正常细胞与癌细胞中存在显著差异。这使得miRNA作为肿瘤诊断及预警标志物成为可能。最近的一些发现表明,癌细胞与正常细胞一样,也有能力将miRNAs分泌到细胞外环境,这一特点被认为与肿瘤性症状是相关的。循环miRNA在肿瘤中的作用还不甚明确,有待进一步研究,但目前认为它们可能与肿瘤转移有关,同时也可能对远端器官有作用。
鉴于循环miRNA的重要性,人们曾经关注的miRNA检测逐渐延伸到了循环miRNA上。循环miRNA的检测,本质上和常规miRNA的检测没有区别,因此早期发展的miRNA经典检测方法,如 qRT-PCR[47-49], 基因芯片[50-52],RNA测序[53-57]等,仍然是循环miRNA检测的主要方法,差异主要来自于循环miRNA更低的含量,以及相较普通miRNA更复杂的存在环境。对于循环miRNA而言,最理想的检测体系应该是能够实现原位检测,因为额外的提取步骤对于存在于血液或其他体液中的循环miRNA来讲,有更多不好的影响存在。因此,在新的检测体系设计中,除了需要注意靶标miRNA之间高度的同源性、链长较短等问题外,体系的抗干扰能力也是设计的要点。这里,我们介绍一些最新报道的循环miRNA检测体系。

图12 循环miRNA进入体液方式1)miRNA形成RISC行使其调控基因表达的功能 2)以多泡体(MVB)的方式进入体液 3)以微观粒子的自由形态进入体液 4)miRNA与蛋白结合进入到体液[46]Fig. 12 Three modes of circulating miRNAs’ entering to body fluid
3.1 电化学检测
已经报道了很多电化学方法检测循环miRNA,这些方法基于核酸杂交,已有综述总结[58,59]。2014年,Mahmoud Labib等人[60]报道,在电极表面修饰捕获序列,加入目标miRNA和亚甲蓝分子标记的核酸探针,一起孵育后洗去未杂交结合的探针,葡糖氧化酶氧化检测电信号,如图13。

图13 基于链杂交电化学检测方法示意图[60]Fig. 13 Protein electrocatalysis for direct sensing of circulating microRNAs

图14 结合DSN酶电化学方法检测循环miRNA[61]Fig. 14 Electrochemical biosensor for direct detection of microRNAs in serum
2014年,Yuqian Ren等人[61]报道了应用DSN酶(特异性识别DNA/RNA杂交链中的DNA链,并将其切割),在金纳米电极表面修饰捕获miRNA的序列,当有miRNA存在时与捕获序列结合,DSN将杂交链中的DNA切断,miRNA释放后有可以跟新的捕获序列结合,起到循环信号放大的作用。当有miRNA存在时,电极上的捕获序列被切割,与完好的的电极相比,由于电化学阻抗作用产生电化学信号的差别,无需标记,如图14。
3.2 光学传感器检测循环miRNA
光学传感器检测循环miRNA今本上通过设计DNA探针与miRNA作用使得荧光信号或者紫外吸光度产生变化去检测出miRNA。已有的一些光学传感器方法[62-64]虽然还没有应用到循环miRNA的检测当中,但具有巨大的潜力。
2014年,See-Lok Ho[65]等人报道用全内反射荧光(TIRF)成像技术检测分析循环miRNA,TIRF是一种研究单分子的有力工具。他们将锁核苷酸应用到分子信标中,可以提高检测特异性,分子信标通过FRET效应荧光是淬灭的,当与miRNA作用时荧光信号恢复,通过TIIRF观察荧光强度可以得到miRNA的浓度,如图15。
3.3 纳米材料类传感器
纳米材料具有其特殊的性能,应用到miRNA的检测中具有很好的效果。Mustafa Salih Hizir等人[66]应用纳米石墨烯,荧光标记的寡核苷酸序列可以吸附到纳米石墨烯表面,并且荧光信号被淬灭,当有miRNA存在时,寡核苷酸和miRNA由于碱基互补配对作用形成双链,从纳米石墨烯表面释放下来,荧光恢复,根据荧光信号的强弱检测miRNA的浓度,如图16。
本文就适配子技术和核酸胞嘧啶羟甲基化的化学法检测,这两个方面做了一些介绍和讨论。适配子作为一种靶向性的分子,发展到现阶段,更多的工作是集中在其与各种材料,分析技术相结合,作为检测和载药应用的工具。适配子技术也存在一些问题,例如稳定性的问题。适配子通常具有一些二级结构,而二级结构往往易受环境影响,这无论在筛选过程中,还是做衍生化进行应用的过程中,都会产生一些问题,可能还会带来实验的假阳性或假阴性。所以现在也有研究工作,通过化学修饰,进一步增强适配子在细胞中的稳定性,使其更好地用在诊断和治疗中。

图15 TIRF方法观察荧光信号检测循环 miRNA[65]Fig. 15 Direct quantification of circulating miRNAs in different stages of nasopharyngeal cancerous serum samples with Total Internal Reflection Fluorescence Microscopy
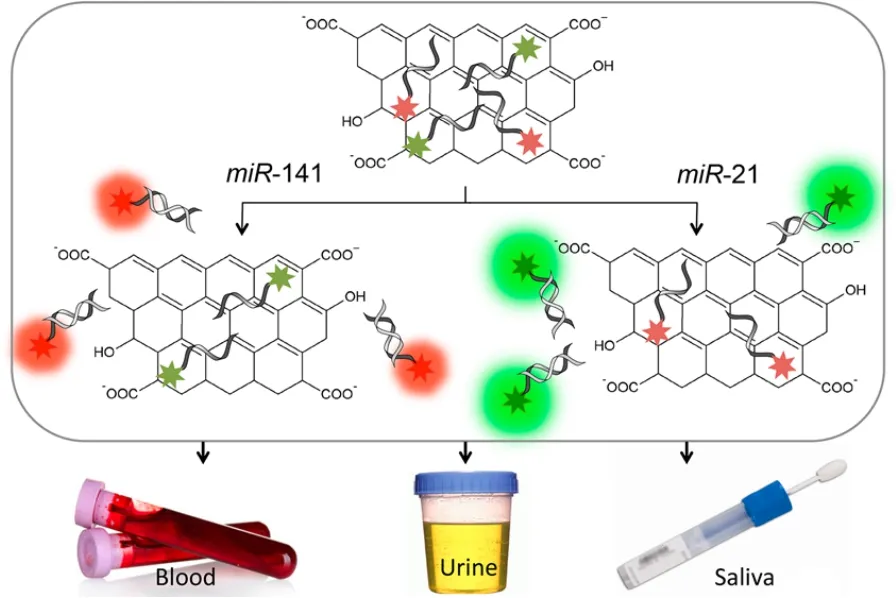
图16 结合纳米石墨烯的淬灭效果检测循环miRNA[66]Fig. 16 Simultaneous detection of circulating oncomiRs from body fluids for prostate cancer staging using nanographene oxide
而核酸胞嘧啶羟甲基化的化学法检测,主要是发展一些有机小分子或有机化学反应,选择性的将5-羟甲基化胞嘧啶与其他胞嘧啶形式分开,进一步结合测序或电泳等方法,将这些表观遗传学的信息绘制出来。在这方面,化学反应的选择性和反应产率往往是决定其能否广泛应用的关键,此外,反应条件是否温和,也是实际应用的前提。
对于循环miRNA的检测,难度在于开发适用于复杂环境下的原位检测方法,而避免复杂的miRNA提取过程。此外,结合使用肽核苷酸(PNA)和锁核苷酸(LNA)等修饰核酸的探针可大大提高检测体系的灵敏度和特异性。纳米材料的应用也是一个不错的选择,在未来将纳米材料应用到循环miRNA可以实现高灵敏度和分布式检测,但是他的缺点是纳米材料检测响应时间长于溶液检测体系。毋庸置疑,这几个方向都是化学生物学的重要方向,随着不断的探索,它们都将为疾病诊断技术的提升提供有利的支持。
(References)
[1] Cheng C J, Bahal R, Babar I A, et al. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment [J]. Nature, 2015, 518(7537): 107-10.
[2] Chen S, Do J T, Zhang Q, et al. Self-renewal of embryonic stem cells by a small molecule [J]. Proceedings of the National Academy of Sciences of the United States ofAmerica, 2006, 103(46): 17266-71.
[3] Velagapudi S P, Vummidi B R, Disney M D. Small molecule chemical probes of microRNA function [J]. Current Opinion in Chemical Biology, 2015, 24:97-103.
[4] Cully M. Anticancer drugs: Advancing precision medicine in silico [J]. Nature Reviews Drug Discovery, 2015, 14(5):311.
[5] Liang C, Guo B, Wu H, et al. Aptamer-functionalized lipid nanoparticles targeting osteoblasts as a novel RNA interference-based bone anabolic strategy [J]. Nature Medicine, 2015, 21(3): 288-94.
[6] Wang X, Lu Z, Gomez A, et al. N6-methyladenosinedependent regulation of messenger RNA stability [J]. Nature, 2014, 505(7481): 117-20.
[7] Portela A, Esteller M. Epigenetic modifications and human disease [J]. Nature Biotechnology, 2010, 28(10): 1057-68.
[8] Ellington A D, Szostak J W. Selection in vitro of singlestranded DNA molecules that fold into specific ligandbinding structures [J]. Nature, 1992, 355(6363): 850-2.
[9] Tuerk C, Gold L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase [J]. Science, 1990, 249(4968): 505-10.
[10] Bock L C, Griffin L C, Latham J A, et al. Selection of single-stranded DNA molecules that bind and inhibit human thrombin [J]. Nature, 1992, 355(6360): 564-6.
[11] Rosenberg J E, Bambury R M, Van Allen E M, et al. A phase II trial of AS1411 (a novel nucleolin-targeted DNA aptamer) in metastatic renal cell carcinoma [J]. Investigational New Drugs, 2014, 32(1): 178-87.
[12] Shangguan D, Li Y, Tang Z, et al. Aptamers evolved from live cells as effective molecular probes for cancer study [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(32): 11838-43.
[13] Shi H, He X, Wang K, et al. Activatable aptamer probe for contrast-enhanced in vivo cancer imaging based on cell membrane protein-triggered conformation alteration [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(10): 3900-5.
[14] Bagalkot V, Zhang L, Levy-Nissenbaum E, et al. Quantum dot-aptamer conjugates for synchronous cancer imaging,therapy, and sensing of drug delivery based on bifluorescence resonance energy transfer [J]. Nano Letters,2007, 7(10): 3065-70.
[15] Wang Y, Tang L, Li Z, et al. In situ simultaneous monitoring of ATP and GTP using a graphene oxide nanosheet-based sensing platform in living cells [J]. Nature Protocols, 2014, 9(8): 1944-55.
[16] Zhao Z, Fan H, Zhou G, et al. Activatable fluorescence/ MRI bimodal platform for tumor cell imaging via MnO2 nanosheet-aptamer nanoprobe [J]. Journal of the American Chemical Society, 2014, 136(32): 11220-3.
[17] Zeng Z, Tung C H, Zu Y. A cancer cell-activatable aptamer-reporter system for one-step assay of circulating tumor cells [J]. Molecular Therapy Nucleic acids, 2014,3-184.
[18] Rotem D, Jayasinghe L, Salichou M, et al. Protein detection by nanopores equipped with aptamers [J]. Journal of the American Chemical Society, 2012, 134(5):2781-7.
[19] Porciani D, Tedeschi L, Marchetti L, et al. Aptamer-Mediated Codelivery of Doxorubicin and NF-kappaB Decoy Enhances Chemosensitivity of Pancreatic Tumor Cells [J]. Molecular Therapy Nucleic acids, 2015, 4-235.
[20] Wu C, Han D, Chen T, et al. Building a multifunctional aptamer-based DNA nanoassembly for targeted cancer therapy [J]. Journal of the American Chemical Society,2013, 135(49): 18644-50.
[21] Bird A. Perceptions of epigenetics [J]. Nature, 2007,447(7143): 396-8.
[22] Tahiliani M, Koh K P, Shen Y, et al. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1 [J]. Science,2009, 324(5929): 930-5.
[23] Tanaka K, Tainaka K, Okamoto A. Methylcytosineselective fluorescence quenching by osmium complexation[J]. Bioorganic & Medicinal Chemistry, 2007, 15(4):1615-21.
[24] Okamoto A, Tainaka K, Kamei T. Sequence-selective osmium oxidation of DNA: efficient distinction between 5-methylcytosine and cytosine [J]. Organic & Biomolecular Chemistry, 2006, 4(9): 1638-40.
[25] Bareyt S, Carell T. Selective detection of 5-methylcytosine sites in DNA [J]. Angew Chem-Int Edit, 2008, 47(1): 181-4.
[26] Feng F D, Liu L B, Wang S. Fluorescent conjugated polymer-based FRET technique for detection of DNA methylation of cancer cells [J]. Nature Protocols, 2010,5(7): 1255-64.
[27] Guo P, Yan S, Hu J, et al. Selective detection of 5-formyl-2'-deoxycytidine in DNA using a fluorogenic hydroxylamine reagent [J]. Org Lett, 2013, 15(13): 3266-9.
[28] Wang T, Hong T, Tang T, et al. Application of N-halogeno-N-sodiobenzenesulfonamide reagents to the selective detection of 5-methylcytosine in DNA sequences[J]. Journal of the American Chemical Society, 2013,135(4): 1240-3.
[29] Song C X, Szulwach K E, Fu Y, et al. Selective chemical labeling reveals the genome-wide distribution of 5-hydroxymethylcytosine [J]. Nature Biotechnology,2011, 29(1): 68-72.
[30] Booth M J, Branco M R, Ficz G, et al. Quantitative sequencing of 5-methylcytosine and 5-hydroxymethylcytosine at singlebase resolution [J]. Science, 2012, 336(6083): 934-7.
[31] Shahal T, Gilat N, Michaeli Y, et al. Spectroscopic Quantification of 5-Hydroxymethylcytosine in Genomic DNA [J]. Analytical Chemistry, 2014, 86(16): 8231-7.
[32] Li W W, Gong L, Bayley H. Single-molecule detection of 5-hydroxymethylcytosine in DNA through chemical modification and nanopore analysis [J]. Angewandte Chemie, 2013, 52(16): 4350-5.
[33] Hu J, Xing X, Xu X, et al. Selective chemical labelling of 5-formylcytosine in DNA by fluorescent dyes [J]. Chemistry, 2013, 19(19): 5836-40.
[34] Hu J ., Chen Y Q, Xu X W, Wu F, Xing X W, Xu Z H, Xu J H, Weng X C, X. Zhou, Bioorg. Med. Chem. Lett. 2014,24, 294-297.
[35] Hong T T, Wang T L, Guo P, et al. Fluorescent Strategy Based on Cationic Conjugated Polymer Fluorescence Resonance Energy Transfer for the Quantification of 5-(Hydroxymethyl)cytosine in Genomic DNA [J]. Analytical Chemistry, 2013, 85(22): 10797-802.
[36] Tang Y, Zheng S-J, Qi C-B, et al. Sensitive and Simultaneous Determination of 5-Methylcytosine and Its Oxidation Products in Genomic DNA by Chemical Derivatization Coupled with Liquid Chromatography-Tandem Mass Spectrometry Analysis [J]. Analytical Chemistry, 2015, 87(6): 3445-52.
[37] Babashah S. MicroRNAs: Key Regulators of Oncogenesis[J]. Springer Ebooks, 2013.
[38] Babashah S, Sadeghizadeh M, Tavirani M R, et al. Aberrant microRNA expression and its implications in the pathogenesis of leukemias [J]. Cell Oncol, 2012, 35(5):317-34.
[39] Babashah S, Soleimani M. The oncogenic and tumour suppressive roles of microRNAs in cancer and apoptosis[J]. Eur J Cancer, 2011, 47(8): 1127-37.
[40] Lynam-Lennon N, Maher S G, Reynolds J V. The roles of microRNA in cancer and apoptosis [J]. Biological Reviews of the Cambridge Philosophical Society, 2009,84(1): 55-71.
[41] Chim S S C, Shing T K F, Hung E C W, et al. Detection and characterization of placental MicroRNAs in maternal plasma [J]. Clinical Chemistry, 2008, 54(3): 482-90.
[42] Wang K, Zhang S L, Weber J, et al. Export of microRNAs and microRNA-protective protein by mammalian cells [J]. Nucleic Acids Res, 2010, 38(20): 7248-59.
[43] Zernecke A, Bidzhekov K, Noels H, et al. Delivery of MicroRNA-126 by Apoptotic Bodies Induces CXCL12-Dependent Vascular Protection [J]. Sci Signal, 2009,2(100): ra81-ra81.
[44] Vickers K C, Palmisano B T, Shoucri B M, et al. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins [J]. Nature Cell biology, 2011, 13(4): 423-433.
[45] Zhang Q P, Xu J, Chen Q, et al. Selective secretion of microRNA in CNS system [J]. Protein Cell, 2013, 4(4):243-7.
[46] Tavallaie R, De Almeida S R M, Gooding J J. Toward biosensors for the detection of circulating microRNA as a cancer biomarker: an overview of the challenges and successes [J]. Wiley Interdisciplinary Reviews Nanomedicine & Nanobiotechnology, 2014.
[47] Kroh E M, Parkin R K, Mitchell P S, et al. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR (qRT-PCR)[J]. Methods, 2010, 50(4): 298-301.
[48] Chen C F, Ridzon D A, Broomer A J, et al. Real-time quantification of microRNAs by stem-loop RT-PCR [J]. Nucleic Acids Res, 2005, 33(20): 179.
[49] Ell B, Mercatali L, Ibrahim T, et al. Tumor-Induced Osteoclast miRNA Changes as Regulators and Biomarkers of Osteolytic Bone Metastasis [J]. Cancer Cell, 2013,24(4): 542-56.
[50] Dong H F, Lei J P, Ding L, et al. MicroRNA: Function,Detection, and Bioanalysis [J]. Chemical Reviews, 2013,113(8): 6207-33.
[51] Lu J, Getz G, Miska E A, et al. MicroRNA expression profiles classify human cancers [J]. Nature, 2005,435(7043): 834-8.
[52] Castoldi M, Schmidt S, Benes V, et al. A sensitive array for microRNA expression profiling (miChip) based on locked nucleic acids (LNA) [J]. Rna-a Publication of the Rna Society, 2006, 12(5): 913-20.
[53] Jiang L, Duan D M, Shen Y, et al. Direct microRNA detection with universal tagged probe and time-resolved fluorescence technology [J]. Biosensors & Bioelectronics,2012, 34(1): 291-5.
[54] Ryan B M, Robles A I, Harris C C. Genetic variation in microRNA networks: the implications for cancer research[J]. Nat Rev Cancer, 2010, 10(6): 389-402.
[55] Shendure J, Ji H L. Next-generation DNA sequencing [J]. Nat Biotechnol, 2008, 26(10): 1135-45.
[56] Chang H T, Li S C, Ho M R, et al. Comprehensive analysis of microRNAs in breast cancer [J]. Bmc Genomics, 2012, 13 suppl 7.
[57] Chiang H R, Schoenfeld L W, Ruby J G, et al. Mammalian microRNAs: experimental evaluation of novel andpreviously annotated genes [J]. Gene Dev, 2010, 24(10):992-1009.
[58] Batchelor-McAuley C, Wildgoose G G, Compton R G. The physicochemical aspects of DNA sensing using electrochemical methods [J]. Biosensors & Bioelectronics,2009, 24(11): 3183-90.
[59] Odenthal K J, Gooding J J. An introduction to electrochemical DNA biosensors [J]. Analyst, 2007,132(7): 603-10.
[60] Labib M, Khan N, Berezovski M V. Protein electrocatalysis for direct sensing of circulating microRNAs [J]. Anal Chem, 2015, 87(2): 1395-403.
[61] Ren Y Q, Deng H M, Shen W, et al. A Highly Sensitive and Selective Electrochemical Biosensor for Direct Detection of MicroRNAs in Serum [J]. Analytical Chemistry, 2013, 85(9): 4784-9.
[62] Fang S P, Lee H J, Wark A W, et al. Attomole microarray detection of MicroRNAs by nanoparticle-amplified SPR imaging measurements of surface polyadenylation reactions [J]. Journal of the American Chemical Society,2006, 128(43): 14044-6.
[63] Qavi A J, Bailey R C. Multiplexed Detection and Label-Free Quantitation of MicroRNAs Using Arrays of Silicon Photonic Microring Resonators [J]. Angew Chem-Int Edit,2010, 49(27): 4608-11.
[64] Yang W J, Li X B, Li Y Y, et al. Quantification of microRNA by gold nanoparticle probes [J]. Anal Biochem,2008, 376(2): 183-8.
[65] Ho S L, Chan H M, Ha W Y, et al. Direct Quantification of Circulating MiRNAs in Different Stages of Nasopharyngeal Cancerous Serum Samples in Single Molecule Level with Total Internal Reflection Fluorescence Microscopy [J]. Analytical Chemistry, 2014,86(19).
[66] Hizir M S, Balcioglu M, Rana M, et al. Simultaneous detection of circulating oncomiRs from body fluids for prostate cancer staging using nanographene oxide [J]. Acs Applmaterinterfaces, 2014, 6(17): 14772-8.
《中外医疗》稿约

《中外医疗》是由国家卫生和计划生育委员会主管,卫生部医院管理研究所主办的专业性学术期刊,中国核心数据期刊(遴选)数据库收录期刊、中国期刊全文数据库收录期刊、中文科技期刊数据库收录期刊。国际刊号:ISSN 1674-0742,国内统一刊号:CN11-5625/R,邮发代号:80-541。
本刊服务于医学创新研究,以医疗事业改革和广大医疗工作者探究学习,增强医德,提升医术为主旨,努力体现专业性、学术性、权威性,贴近实际,追求实用。本刊长期面向全国征集医学学术论文,在本刊发表的论文可获得国家继续教育学分。
《中外医疗》杂志为半月刊,大16开,每月15日、25日出版,定价15元。
主要栏目: 院长论坛、创新视点、临床研究、病例(案)探析、名医名院、治院方略、管理之窗、后勤服务、医药互动、法规在线、医院文化、护理天地、影像特析、综合医学、中医中药、卫生防疫、妇幼保健、特室特科、论著、综述等。
联系电话:010-63385386
投稿邮箱:bjb@chinazwyl.com
Advance in technologies of disease diagnosis based on nucleic acids
PENG Shuang, LI Wei, TIAN Tian, ZHOU Xiang
College of Chemistry and Molecular Sciences, Wuhan University, Wuhan 430072
Early diagnosis has become more and more important with the elevation of peoples' life, so developing novel technologies and strategies for early diagnosis is urgent and has become the focus in the field of biology and medicine. Especially after the introduction of the concept of “Precision Medicine”, people placed high hopes on the development of more advanced diagnostic technologies. For purpose of this, the chemical biology, probing and regulating living systems with small molecules, has proved to be a potential aspect. Meanwhile, nucleic acids are most important biomacromolecules in vivo, which play key roles in multiple living processes. Thus, studies aimed at nucleic acid associated target are meaningful. Herein, we discuss and summarize the latest progress in technologies for early diagnosis based on nucleic acids, including the technology of SELEX (systematic evolution of ligands by exponential enrichment) detection of epigenetic modifications on nucleic acids and detection of circulating miRNAs.
nucleic acids; diagnosis; aptamer; nucleic acid epigenetic modification; circulating miRNAs; detection
Q599
A
10.11966/j.issn.2095-994X.2015.01.03.05
2015-07-30 ;
2015-08-05
国家重点基础研究发展计划(973计划)项目(2012CB720600, 2012CB720603)
彭双,武汉大学化学与分子科学学院研究生,电子信箱:pengshuang@whu.edu.cn;李娓, 武汉大学化学与分子科学学院研究生,电子信箱:1539565048@qq.com;周翔(通信作者),武汉大学化学与分子科学学院,教授,电子信箱:xzhou@whu.edu.cn;田沺(通信作者),武汉大学化学与分子科学学院,副教授,电子信箱:ttian@whu.edu.cn
引用格式:彭双,李娓,田沺,等.基于核酸的疾病诊断技术新进展[J].世界复合医学,2015,1(3):212-222

