放射性脑损伤的动物模型及神经组织放射损伤生物学系统研究
陈波,唐博,邓玉林,马宏
北京理工大学生命学院,北京100011
*论著——认知神经科学与神经工程*
放射性脑损伤的动物模型及神经组织放射损伤生物学系统研究
陈波,唐博,邓玉林,马宏
北京理工大学生命学院,北京100011
伴随医疗科技的迅猛发展,放疗成为癌症治疗的重要手段之一,但是放疗在减轻患者痛苦的同时也会给患者造成极大的副作用,其中放射性脑损伤已经成为限制放射性疗法临床上应用的一个重要因素。本研究采用30Gy Co60-γ射线一次性照射SD大鼠头部(身体其他部位用两层铅砖遮蔽),模拟放射性脑损伤的各个时期,建立既出现典型的损伤改变又不明显影响动物生存的放射性脑损伤模型。通过观察血液中氧化应激水平、细胞因子含量,脑组织中氧化应激水平、细胞因子含量、凋亡因子含量来分析脑损伤发生的可能机制。
放射性脑损伤;动物模型;γ射线
众所周知,威胁当代人类健康的三大疾病分别是心脑血管病,癌症和糖尿病。癌症是人类的二号杀手,死亡率较高。调查发现,70%不能进行手术或是对化疗有禁忌征的癌症患者在治疗过程中都要接受放疗。但是放疗会给患者造成极大的副作用,尤其是脑部的放疗会损伤神经干细胞,而神经干细胞最主要的作用就是增殖并生成新的神经元,新的神经元不能产生就会导致认知、记忆等功能的损害[1]。而且电离辐射后,星形胶质细胞可出现肿胀和坏死,大剂量照射后部分细胞可迅速发生死亡[2-4]。电离辐射对机体的作用机理有两个方面:一方面是辐射直接作用于DNA、蛋白质等生物大分子,使其发生电离、激发或化学键断裂的变化,导致其分子结构被破坏,从而导致其功能的丧失[5]。另一方面是辐射作用于组织中的水分子,产生大量强氧化性的自由基,这些自由基能破坏细胞内的重要大分子,继而引起一系列的生物学效应[6]。DNA损伤可导致基因移位、缺失或突变,还可能导致染色体畸变,抑制细胞分裂或引发分裂异常[7]。蛋白质损伤主要表现于机体内的各种酶,酶系统对辐射极为敏感,酶分子的损伤失活将引起细胞代谢的一系列病理变化[8-9]。此外,DNA和蛋白质的分解代谢在受到电离辐射后均显著增强,尿液中核酸及氨基酸代谢产物增多,整个生物体处于负氮平衡状态,其原因可能是电离辐射破坏了细胞中的溶酶体,致使溶酶体释放DNA酶和蛋白酶,使DNA和蛋白质分子降解所致[10-12]。辐射导致的放射性脑损伤,其表现为头痛、厌食等症状,中枢神经系统损伤成为主要损伤,肠损伤和造血损伤极为严重,有时甚至可以致死[13-17]。因此,在应用放射性疗法治疗脑部疾病时所产生的副作用,即放射性脑损伤,已经成为限制放射性疗法临床上应用的一个重要因素。
建立一个准确、适宜的放射性脑损伤模型来考察放射性脑损伤的损伤机制,更可以根据相应的机制来开发治疗药物,并通过动物模型考察药物疗效具有重要意义。
1 研究方法
1.1 大鼠放射性脑损伤模型的建立及实验分组
本实验将48只大鼠进行随机分组并标号,分为短期正常组(1C)、短期辐射组(1R)、中期正常组(7C)、中期辐射组(7R)、长期正常组(28C)、长期辐射组(28R),每组各8只。辐射组将大鼠竖直悬挂,用两块铅砖重叠自颈部屏蔽下半身,一块铅砖叠放于两块铅砖之上,中间用约3cm厚度的木块隔开。这样在两块铅砖之间露出约3cm宽度的窄缝,只裸露出脑部。Co60 射线一次性照射,源距100cm。通过前期预实验的实验数据,低于20Gy的辐射剂量对于脑组织几乎没有造成很严重的损伤效果(病理切片上观察不到明显损伤),而高于40Gy的剂量会使大鼠的致死率上升,因此本实验选择30Gy的剂量作为造模剂量,模拟脑部局部照射。
1.2 大鼠存活情况及外部指标检测
实验动物的存活情况及体重变化情况是动物实验常规的检测指标,是反应动物健康状况的最基础、最直接的衡量指标。在照射前后各观察时间点(每隔三天),对大鼠头部照射区毛发与皮肤的情况及体重的变化作检查并记录。并且在各观察时间点观察大鼠精神状况、进食情况与排泄情况并记录。重点观察受辐射后大鼠有无异常行为。
1.3 大鼠脏器指数的检测
脏器指数,又称脏器系数,是实验动物某脏器的重量与其体重之比值。正常时各脏器与体重的比值比较恒定。动物免疫受损后,脏器重量可以发生改变,因而脏器系数也随之而改变。脏器系数增大,表示脏器充血、水肿或增生肥大等;脏器系数减小,表示脏器萎缩及其他退行性改变。
本试验选取胸腺指数与脾脏指数作为一个指标来研究放射性脑损伤模型是否建立成功,将实验组的结果与同时间处死的对照组作比较,并进行统计学处理。
1.4 大鼠脑组织病理切片的检测
本试验是将大鼠断头取脑后,左半脑放于10%的中性福尔马林溶液固定。送做HE染色病理切片和石蜡切片,检测的基本信息如表1所示。

表1 病理检测基本信息Fig.1 Pathological detection basic information
1.5 大鼠血液中生化指标检测
通过检测外周血液中的氧化应激水平与炎症因子水平,可以评判出辐射对于机体损伤程度。本实验主要通过检测SOD与MDA来考察氧化应激水平,TNF-α、IL-6等来考察炎症因子水平。
1.6 大鼠脑组织中生化指标检测
通过检测脑组织中的氧化应激水平、炎症因子水平与凋亡因子水平,可以评判出辐射对于脑组织损伤程度。本实验主要通过检测SOD与MDA来考察氧化应激水平,TNF-α、IL-6等来考察炎症因子水平,Caspase-3来考察凋亡因子水平。
1.7 数据统计及分析
本研究中所有实验数据利用Microsoft Office Excel 2010进行数据统计。实验数据采用IBM SPSS Statistics17.0与SPSS 13.0统计学软件处理,以误差线的形式表示标准偏差(±s),组间采用单因素方差分析法分析差异的显著性。#号用于辐射组与正常组的数据情况比较,#代表P<0.05,##代表P<0.01。所有给出显著性分析的实验中,重复样本数n均≥3。
2 结果与分析
2.1 大鼠存活情况及外部指标检测
辐射后3-15天左右,辐射组大鼠饮食、摄水量开始明显减少;出现脱毛、毛发变黄、毛发干燥不柔顺、皮肤轻度肿胀与充血现象;眼睛长时间处于半睁状态;大鼠对于外界刺激不敏感、反应迟钝、动作迟缓,对于新鲜事物反应平淡,无新奇感与恐惧感;大部分大鼠会发出类似“咕咕”的叫声,且持续时间较长。在辐射后15天左右,辐射组大鼠饮食、摄水量开始逐渐增加;皮肤轻度肿胀与充血现象逐渐消失;大鼠对于外界刺激反应速度加快,对于新鲜事物有了明显的好奇感与恐惧感;“咕咕”的叫声消失。
从上述描述结果可以看出,大剂量辐射后在短时间内除了对于脑组织有损伤外,对于外周组织也有影响。
2.1.1 大鼠头部γ辐射后体重变化情况
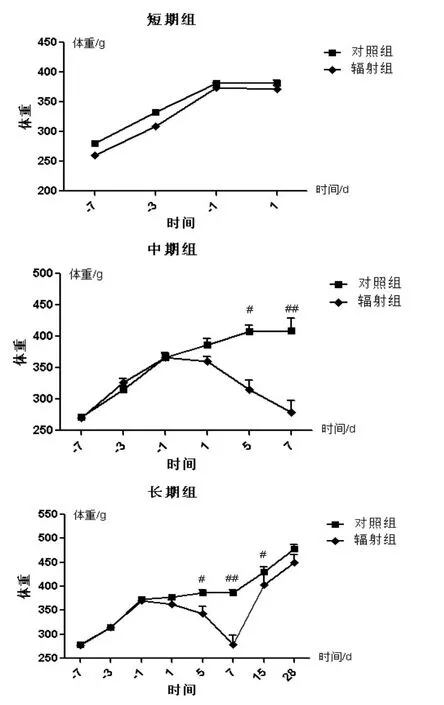
图1 大鼠头部γ辐射后体重变化情况Fig.1 Weight changes of SD rats after head radiation by γ-ray
辐射对于大鼠的生长状况会有显著地影响,这其中最直观也是最直接的就是体重的变化。如图所示。
短期组在辐射后1天就被处死,所以体重几乎没有发生什么变化。但中期组的体重变化较为显著,在辐射后三天左右,辐射组体重开始明显下降,到达第七天时,已经与正常组产生了极显著的差异。而长期组在辐射后1-3天辐射组的体重已经开始下降,但是下降的幅度不是很大。此后,辐射组体重持续下降,直到7-10天左右时达到最低值,此时,辐射组与正常组体重之间有极显著性差异。在这之后,辐射组体重开始逐渐上升,直到辐射后25天左右,体重之间的差异性消失。
2.1.2 大鼠头部γ辐射后脏器指数变化情况
辐射对于大鼠的免疫系统会有显著地影响,其免疫受损后,脏器重量可以发生改变,因而脏器指数也随之而改变。因此,脏器指数的改变可以直接反映辐射导致的免疫受损情况。
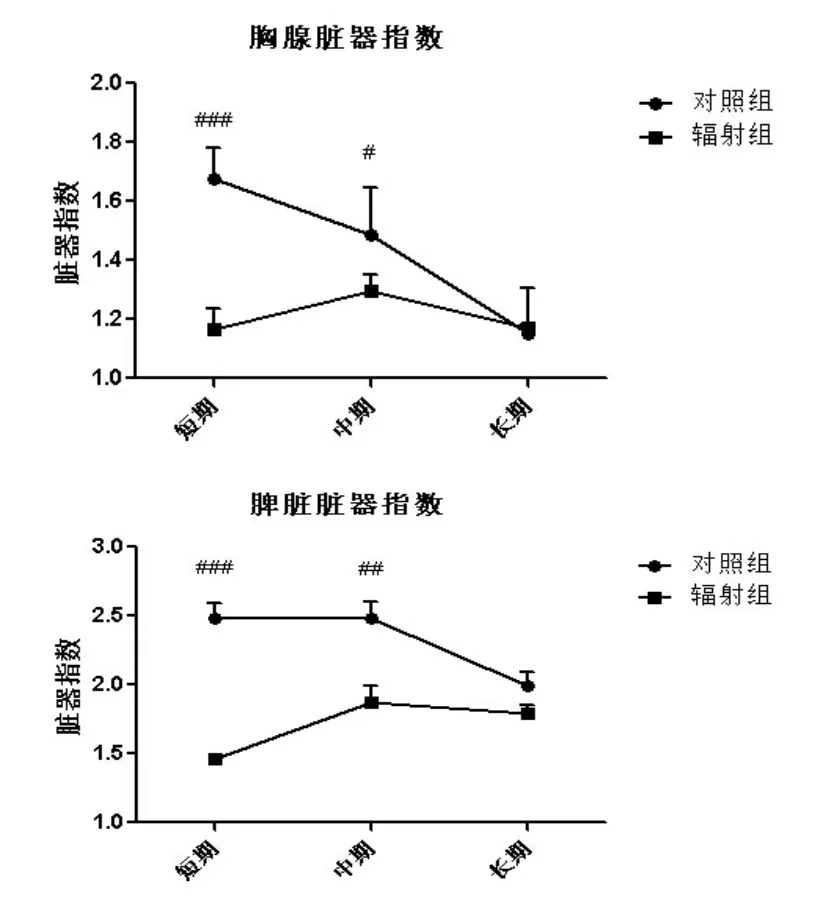
图2 大鼠头部γ辐射后脏器指数变化情况Fig.2 Viscera index changes of SD rats after head radiation by γ-ray
辐射后短期辐射组与短期正常组之间的胸腺指数与脾脏指数都出现了极显著的差异性。随着时间推移,这种差异性越来越不显著。最后可见,长期辐射组与长期正常组之间的差异已经没有显著性差异了。
2.1.3 大鼠脑组织病理切片
脑组织的结构十分复杂,每一个区域都有其独特的作用。中枢神经系统的不同部位对放射的敏感性不同,海马对放射损伤高度敏感。海马是脑边缘系统中最重要的功能区之一,在学习记忆和许多行为功能方面有着重要的作用。海马神经细胞损伤后必然从体外行为中得到反映,甚至可在无形态改变的情况下观察到,而放射性脑损伤最早出现的改变是记忆力的下降,因此将海马作为研究对象可更好的了解脑损伤的发病机制和过程[18]。所以,我们选取大脑的海马区作为病理切片的检测区域。结果如下图(脑组织切片HE染色图,400倍)。

图3 大鼠脑组织病理切片Fig.3 Brain tissue pathological slices of SD rats
短期辐射组有一定的损伤,神经细胞肿胀,细胞核位置偏移,并且呈嗜酸性染色,结构变得不清晰;胞浆的着色浅且呈苍白均质状;有些较为严重的细胞可见细胞核被染色得很浓,呈现暗红色。有些甚至出现神经细胞固缩,包体缩小变形等现象。辐射后7天,即中期辐射组的间质水肿更加明显;神经细胞出现核碎裂,核溶解坏死现象;海马齿状回神经细胞出现神经退行性改变。长期组的辐射组与正常组比较可以发现,凋亡和坏死的细胞显著性减少,并且出现了大量的再生细胞。
2.2 大鼠头部γ辐射对于大鼠外周血象的影响
2.2.1 头部γ辐射大鼠外周血中氧化应激水平的变化
如图4所示,血清中MDA含量在短期组之前存在着显著性差异,辐射组的MDA含量要多于正常组,说明照射后发生了氧化应激反应,细胞可能已经发生损伤。随着时间的推移,辐射组与正常组之间的这种差异已经没有统计学意义了,说明机体本身自我恢复,将自由基清除了。
血清中SOD活力在短期组之前存在着极显著性差异,辐射组的SOD活力要弱于正常组;中期组的辐射组与正常组之间仍然存在着显著性的差异,而这种差异在长期组之间就已经没有统计学意义了。这说明机体的清除自由基的能力正在逐渐恢复,最终的结果表明,外周血的清除自由基能力已经基本恢复正常。
2.2.2 头部γ辐射大鼠外周血中炎症因子水平的变化

图4 头部γ辐射大鼠外周血中氧化应激水平的变化Fig.4 The oxidative stress level changes in peripheral blood of SD rats after head radiation by γ-ray
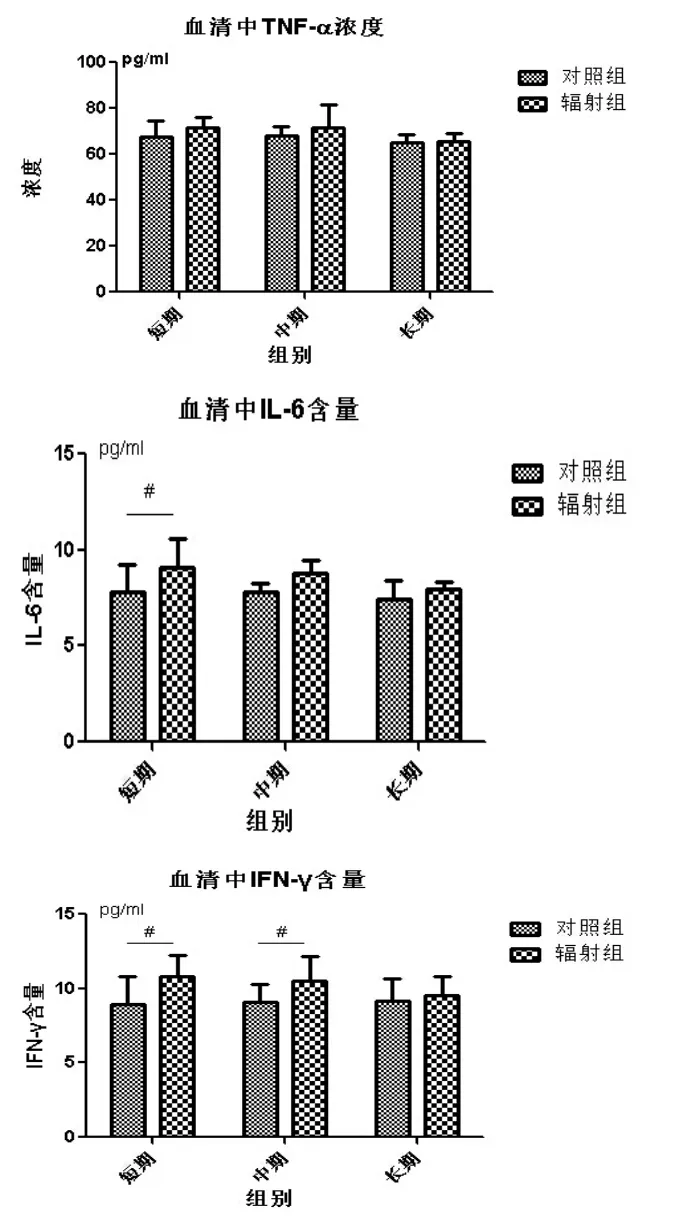
图5 头部γ辐射大鼠外周血中炎症因子水平的变化Fig.5 The cytokine level changes in peripheral blood of SD rats after head radiation by γ-ray
通过检测主要包括TNF-α、IL-6和IFN-γ等炎症因子的变化情况,就可以考察出脑部受到损伤的情况。因为这些炎症因子分子量比较小,可以通过血脑屏障进入外周血中。所以,外周血液中的炎症因子的含量在一定程度上也可以反应出脑组织的放射性损伤情况。
血清中TNF-α的浓度在辐射组与正常组之间始终没有统计学意义上的差异,而血清中IL-6含量在短期组之前存在着显著性差异,辐射组的IL-6含量要多于正常组,说明照射后发生了炎症反应。随着时间的推移,辐射组与正常组之间的这种差异已经没有统计学意义了。血清中IFN-γ含量也是辐射后随着时间的推移不断在变化。正常组大鼠IFN-γ含量基本上是维持在一个基准水平保持不变,而辐射组在辐射后的1-7天左右血液中的IFN-γ含量要显著高于正常组,这极有可能是辐射对于脑组织造成了损伤,而产生了炎症因子进而释放到血液中,但是随着时间的推移,这些炎症因子逐渐在血液被清除(长期组两组之间不存在统计学差异)。
2.3 大鼠头部γ辐射对于大鼠脑组织的影响
2.3.1 头部γ辐射大鼠脑组织中氧化应激水平的变化
在辐射后短时间内脑组织中MDA含量显著增加,这说明脑组织受到了电离辐射的攻击,产生了大量的自由基,但是自由基的含量是随时间递减的,在辐射中期(辐射后的第7天)MDA的含量仍然明显高于正常组,但在辐射后期(辐射后28天)MDA的含量已经恢复了正常。这说明辐射效应会造成短期损伤,机体会出现较大的改变。
同理,在辐射后的初期脑组织中SOD的活力降到了最低,但是随着时间的推移,脑组织中的损伤逐渐恢复,机体对于辐射损伤逐渐适应,脑内SOD的活力开始逐渐升高,但是增加的速度比较缓慢,直到辐射后期(辐射后第28天),仍然与正常组的SOD活力有着极显著的差异。这说明放射性损伤仍在继续,所以对机体会产生一定的持续的影响。
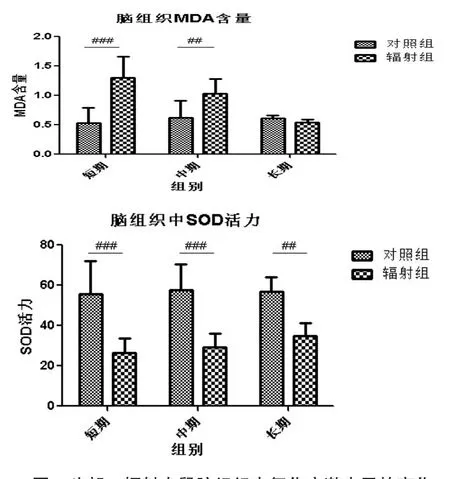
图6 头部γ辐射大鼠脑组织中氧化应激水平的变化Fig.6 The the oxidative stress level in brain tissue of SD rats after head radiation by γ-ray
2.3.2 头部γ辐射大鼠脑组织中炎症因子水平的变化
辐射后在短时间内脑组织中TNF-α浓度显著增加,直到辐射中期(辐射后第7天),辐射组与正常组仍然有极显著的差异。但是到辐射后期(辐射后第28天)辐射组脑组织中TNF-α浓度已经恢复到与正常组没有统计学差异。这说明,在辐射后,脑组织发生了急性脑损伤,并因此发生了炎症反应。随着时间的推移,炎症消失,炎症因子也逐渐减少。
同TNF-α浓度一样,脑组织中IFN-γ 和IL-6的浓度也是在辐射后短期内就达到最大值,虽然之后持续下降,但是下降的幅度并不是很大。到辐射后期,辐射组与正常组仍有极其显著的差异性。这一点与TNF-α的浓度有所不同。

图7 头部γ辐射大鼠脑组织中炎症因子水平的变化Fig.7 The the changes of Inflammatory cytokines level of SD rats after head radiation by γ-ray
以上的三种炎症因子结果显示,脑组织的中的炎症发生是急性的,并且随着时间推移,炎性症状有减弱趋势。
2.3.3 头部γ辐射大鼠脑组织中凋亡因子水平的变化
辐射后脑组织中Caspase-3的浓度就已经开始升高,辐射组与正常组之间始终保持着显著地差异并且随着时间的推移,这种显著性并没有降低,说明细胞凋亡持续的发生,损伤效应持续发生。
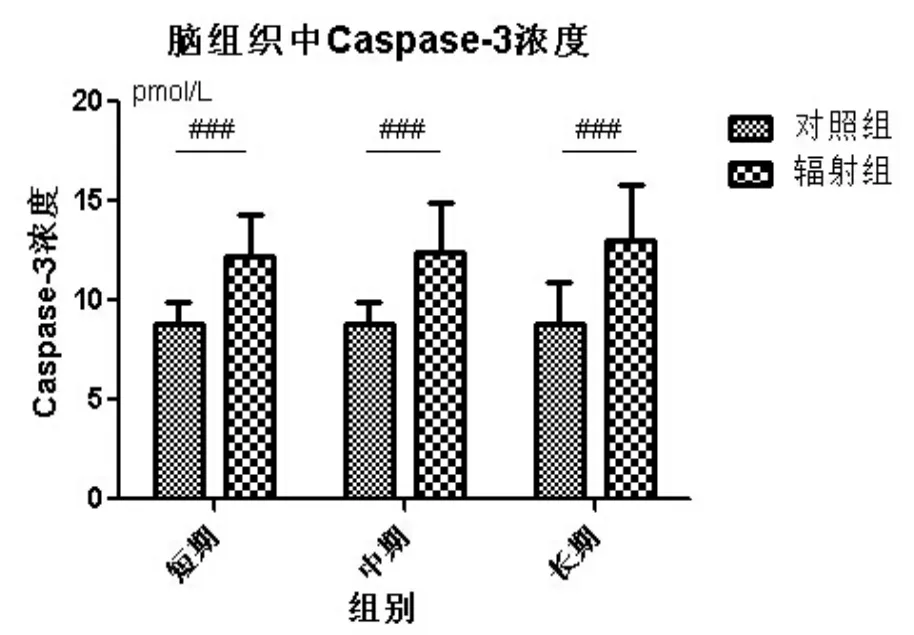
图8 头部γ辐射大鼠脑组织中凋亡因子水平的变化Fig.8 The changes of apoptosis factor level in brain tissue of SD rats after head radiation by γ-ray
3 讨论
1. 此放射模型对于大鼠一般情况在短期内会产生影响,但是在辐射后28天存活动物的外观、摄食、排泄、行为、运动、体重脏器指数等均已恢复正常,但在镜下可见不同程度的放射损伤反应,此现象说明在照射过程中除照射野中的大脑局部区域外,并没有损伤到上消化道与呼吸道,使得大鼠受照后进食与呼吸没有受到明显影响。
2. 大鼠进行脑辐射损伤后的脾和胸腺的脏器指数与对照组之间存在显著的差异而随着时间的推移这种差异逐渐减少直至消失。这说明大鼠脑的辐射损伤对免疫系统有影响,而且这是一种短期效应。
3. 此放射模型对于大鼠外周血产生影响,是由于脑组织也产生了大量的炎症因子,使得炎症因子通过血脑屏障进入外周血中,但是由于氧化应激与炎症是发生在脑组织中的,而在外周组织没有发生上述反应,所以各种因子的增加不是持续的,随着脑组织中各种因子的清除或水平降低,血液中的相应指标也在下降,最终体现在长期组的各组之间的检测指标没有显著性差异。
4.此放射模型对于大鼠脑组织的影响,说明氧化应激和炎症反应是机体的一个短期效应,随着机体各种损伤的恢复,炎症逐渐消失,氧化应激水平也恢复正常。
5.由大鼠脑辐射损伤后其脑组织中凋亡因子水平与对照组之间一直存在显著差异,这说明脑组织中细胞凋亡持续发生,辐射对脑的损伤是一种长期效应。
6. 通过比较外周血与脑组织中氧化应激水平与炎症反应水平,说明这个放射性脑损伤模型仅仅只是对于脑组织产生了损伤效应,而没有对于除脑组织以外的机体造成较大的持续影响。
(References)
[1] Pecaut MJ, Gridley DS, Smith AL, et al. Dose and dose rat effects of whole-body proton-irradiation on lymphocyte blastogenesis and hematologica variables:partⅡ[J]. Immunology Letters,2002,80 (1): 67-73.
[2] Herodin F, Bourin P, Mayol J F, et al. Short- term injection of anti-apoptotic cytokine combinations soon after lethal gamma irradiation promotes survival [J]. Blood, 2003 ,101 (7) : 2609.
[3] Li YQ, Wong CS. Radiation induced apoptosis in the neonatal and adult rat spinal cord [J]. Radiation Research,2000, 154 (3):268-276.
[4] Romero AA, Gross SR, Cheng KY, et al. An age-related increase in resistance to DNA damage-induced apoptotic cell death is associated with development of DNA repair mechanism [J]. Journal of Neurochemistry, 2003,84 (6):1275-1287.
[5] Sulieman A., Elzaki M., Kappas C., et al. Raditon dose measurement in gastrointestinal sudies[J]. Radiation protection dosimetry, 2011, 147(9): 1-2.
[6] Singh Pankaj K., Wise Stephen Y., Ducey Elizabeth J.,et al. alpha-Tocopherol Succinate Protects Mice against Radiation-Induced Gastrointestinal Injury[J]. Radiation research, 2012,177(2):133-145.
[7] De Strayo, Devasagayam Thomas P.A.. Protective effect of an aminothiazole compound against gamma-radiation induced oxidative damage[J]. Free radical research,2011,45(11): 11-12.
[8] Pratheeshkumar P., Kuttan Girija. Protective role of Vernonia cinerea L. against gamma radiation-induced immunosupression and oxidative stress in mice[J].Humanand experimental toxicology,2011,30(8):1022-1038.
[9] Kang Kyoung Ah, Lee In Kyung, Zhang Rui, et al. Radioprotective effect of geraniin via the inhibition of apoptosis triggered by gamma-radiation-induced oxidative stress[J].Cell biology and toxicology,2011,27(4):83-94.
[10] Huang Linzhang, Zhao Hongfang, Huang Baokang, et al. Acanthopanax senticosus: review of botany, chemistry and pharmacology[J].Pharmazie,2011,66(2):83-97.
[11] Somosy Z,Horvath G,Telbisz A ,et al. Morphological aspects of ionizing radiation response of small intestine[J]. Micron,2002,33:167-178.
[12] Francois A, Milliat F, Vozenin-bretons M. Bowel injury associated with pelvic radiotherapy[J].Radiat Phys Chem,2005, 72 (5):399-407.
[13] Weisdorf D, Chao N. Acute Radiation Injury :Contingency Planning for Triage, Supportive Care,and Transplantation. Biology of Blood and Marrow Transplantation[J]. 2007, 12 : 672-682.
[14] Herodin F, Bourin P, Mayol JF, et al. Short- term injection of anti-apoptotic cytokine combinations soon after lethal gamma irradiation promotes survival [J]. Blood, 2003 ,101 (7) : 2609.
[15] Lee TK, Johnke RM, Allison, et al. Radio protective potential of ginseng[J]. Mutagenesis, 2005, 20(4) : 237.
[16] Maharwal J , Samarth RM, Saini MR. Antioxidative effect of Rajgira leaf extract in liver of Swiss albino mice after exposure to different doses of gamma radiation[J]. Phytother Res, 2005, 19(8):717.
[17] Watters D. Mole eular mechanism sofionizing radiation-indueed apoptosis[J]. Immunol Cell Bl’Ol. 1999,77(3):263-271.
[18] Xin N, Li YJ, Li Y, et al. Dragon’s Blood extract has antithrombotic properties, affecting platelet aggregation functions and anticoagulation activities [J]. The Journal of Ethnopharmacology, 2011,135(2):510-514.
樊代明院士:医学远比科学复杂
医学不是纯粹的科学,也不是单纯的哲学,医学充满了科学和哲学,但还涵盖有社会学、人学、艺术、心理学等等。因而,我们不可以笼统地用科学的范律来解释医学,也不可以简单地用科学的标准来要求医生。
众所周知,医学要比科学起源早。科学一词的出现也才一千多年,而医学已有数千年甚至更早的历史。因此,应该是医学的积累、进步以及需求催生了科学。简单地把医学视为科学的一个分枝或隶属于科学、服从于科学,甚至把医学视为医学科学的简称,看来是不恰当的,甚至有失偏颇。
医学远比科学复杂
科学研究的是世界各种现象的本质及变化规律,其结果具有高度的普遍性。医学研究的不仅是疾病的本身(或其本质),而且要研究疾病这种现象的载体、即有着不同生活经历和生理体验的活生生的人,要研究人体各种机能的本质和进化规律。因此,医学不仅重视事物高度的普遍性,而且重视人体结构、功能及疾病的异质性或称独特性。医学是通过长期大量不间断的理论探索和实践检验,最终形成最大可能适合人体保健、康复和各种疾病诊疗的知识体系。
医学与科学的异同
一,个体与群体;二,体外与体内;三,外环境与内环境;四,结构与功能;五,局部与整体;六,微观与宏观;七,静态与动态;八,瞬间与长期;九,直接与间接;十,必然性与偶然性;十一,生理与心理;十二,客观与主观;十三,数据与事实;十四,证据与经验;十五,因果与相关;十六,科学与伦理;十七,理论与实践。
我曾经在《整合医学初探》《整合医学再探》等文章中反复说过:“整合医学不仅要求我们把现在已知各生物因素加以整合,而且要将心理因素、社会因素和环境因素等也加以整合”;“不仅要求我们将现存与生命相关领域最先进的科学发现加以整合,而且要求我们将现存与医疗相关各专科最有效的临床经验加以整合”;“不仅要以呈线性表现的自然科学的单元思维考虑问题,而且要以呈非线性表现的哲学的多元思维来分析问题”。“通过这种单元思维向多元思维的提升,通过这四个整合的再整合,从而构建更全面、更系统、更合理、更符合生命规律、更适合人体健康维护和疾病诊断、治疗和预防的新的医学知识体系”,最终使人类的健康能真正得到保证和保障,进而真正地“认识我们自己”,这就是本文和本人的所思、所想和所愿。
Modelling and the systemic influence of radiation-inducede brain injured
CHEN Bo, TANG Bo, DENG Yulin, MA Hong
School of Life Science, Beijing Institute of Technology, Beijing 100011
With the rapid development of medical science and technology, radiotherapy is an important measure of cancer therapy. Although radiotherapy can alleviate the suffering of patients, it also causes great side effects to patients at the same time. Radiationinduced brain injured has become an important factor that limits the clinical application of radiotherapy. In this research, we adopts γ-ray one-time exposure the head of SD rats(other parts of the body with two layers of lead brick) to simulate various periods of radiation-induced brain injured.So that we can set up a model of radiation-induced brain injured which has typical damage change and do not significantly affect the animals survival. And by observing the oxidative stress level and cytokine level in the blood,the oxidative stress level in brain tissue, the contents of cytokines and apoptosis factors to analyze the possible mechanism of brain injury.
brain injure; animal model; γ-rays
Q691.5
A
10.11966/j.issn.2095-994X.2015.01.03.12
2012-07-25;
2015-08-06
国家自然科学基金(31200636)
陈波,硕士研究生,研究方向为空间生物与医药工程,电子信箱:1032346387@qq.com;马宏(通信作者),副研究员,研究方向为空间生物与医药工程,电子信箱: 04656@bit.edu.cn
引用格式:陈波,唐博,邓玉林,等.放射性脑损伤模型的建立及其对神经组织的影响[J].世界复合医学,2015,1(3):252-258

