关于上海市公立医院生物样本库相关知情同意书的评价分析
蔡美玉,王剑萍,奚益群,杜天翼,杨红荣,翁佳莉,薛 迪*
(1复旦大学公共卫生学院/卫生部卫生技术评估重点实验室/健康风险预警治理协同创新中心,上海 200032,12211020047@fudan.edu.cn;2上海市卫生和计划生育委员会,上海 200125;3上海市儿童医院,上海 200040)
关于上海市公立医院生物样本库相关知情同意书的评价分析
蔡美玉1,王剑萍2,奚益群3,杜天翼1,杨红荣3,翁佳莉1,薛迪1*
(1复旦大学公共卫生学院/卫生部卫生技术评估重点实验室/健康风险预警治理协同创新中心,上海 200032,12211020047@fudan.edu.cn;2上海市卫生和计划生育委员会,上海 200125;3上海市儿童医院,上海 200040)
目的 评价上海市医院生物样本库生物样本采集知情同意书撰写的科学性。方法 按照课题组制定的“生物样本库知情同意书审核表”评价上海市8所医院内2012—2013年使用的54份生物样本采集知情同意书。结果 各医院使用的生物样本采集知情同意书中基础内容表述较明确,但生物样本库相关的特殊内容表述得分较低,知情同意书针对性弱。结论 卫生行政管理部门应出台生物样本库相关的伦理规范以指导生物样本知情同意书的撰写,公立医院应加强生物样本库相关的知情同意审核。
生物样本库;知情同意;医疗卫生机构;伦理要求
随着我国生命伦理学的发展,各医疗机构与研究人员对研究项目和临床医疗服务的知情同意重视程度不断提高,以充分保障患者权益。[1_4]本研究旨在分析上海市公立医院生物样本库相关知情同意书的撰写质量,为医疗卫生机构完善生物样本库相关的知情同意书提供借鉴。
1 研究内容与方法
课题组在上海市设有生物样本库的8所具有代表性的公立医院中,随机选择2012年和2013年已通过伦理审核的研究项目来源的生物样本捐献者的知情同意书样本(以下简称为“研究来源的知情同意书”)各10份(如当年不满10份则全部抽取)进行评价。此外,课题组还在上述医院中,选择2013年已通过伦理审核且已使用临床医疗服务来源的生物样本捐献者的知情同意书样本(以下简称为“临床来源的知情同意书”)进行了评价。在评价中,课题组成员根据拟定的《生物样本库相关的知情同意书审核表》进行评阅,且知情同意书审核的各项目评分值为0~5分,0分表示无相关内容的描述,1分表示内容描述完全不符合要求,5分表示内容描述完全符合要求。
知情同意审核表的制定参考了英国生物样本库伦理框架、爱沙尼亚《人类基因研究法》及我国台湾地区人体资料库等有关生物样本库管理规范中对知情同意书内容的要求。
2 研究结果
本研究对8所医院中的54份研究项目的知情同意书样本作了评价,其中10份为临床来源的知情同意书。
2.1 知情同意书的基本内容评价
研究显示,被评价的医院生物样本捐献者的知情同意书,在研究或临床医疗项目的名称、承担单位、项目目的、募集对象、自主参与、退出权利、个人受益、社会受益、可能风险与伤害、语言表述、签字、研究人员的联系方式告知方面的描述基本符合伦理要求,平均评分为3.47分~5.00分。然而,知情同意书在生物样本捐献者可选择的退出方式和退出程序、风险或伤害处理措施和赔偿、伦理委员会联系方式告知方面的描述存在较大的问题,平均得分为1.39分~2.20分(见表1)。
此外,临床来源的知情同意书对项目目的、个人和社会受益的告知比研究来源的知情同意书更符合伦理要求,但在招募对象、风险或伤害处理措施方面的告知较欠缺(见表1)。
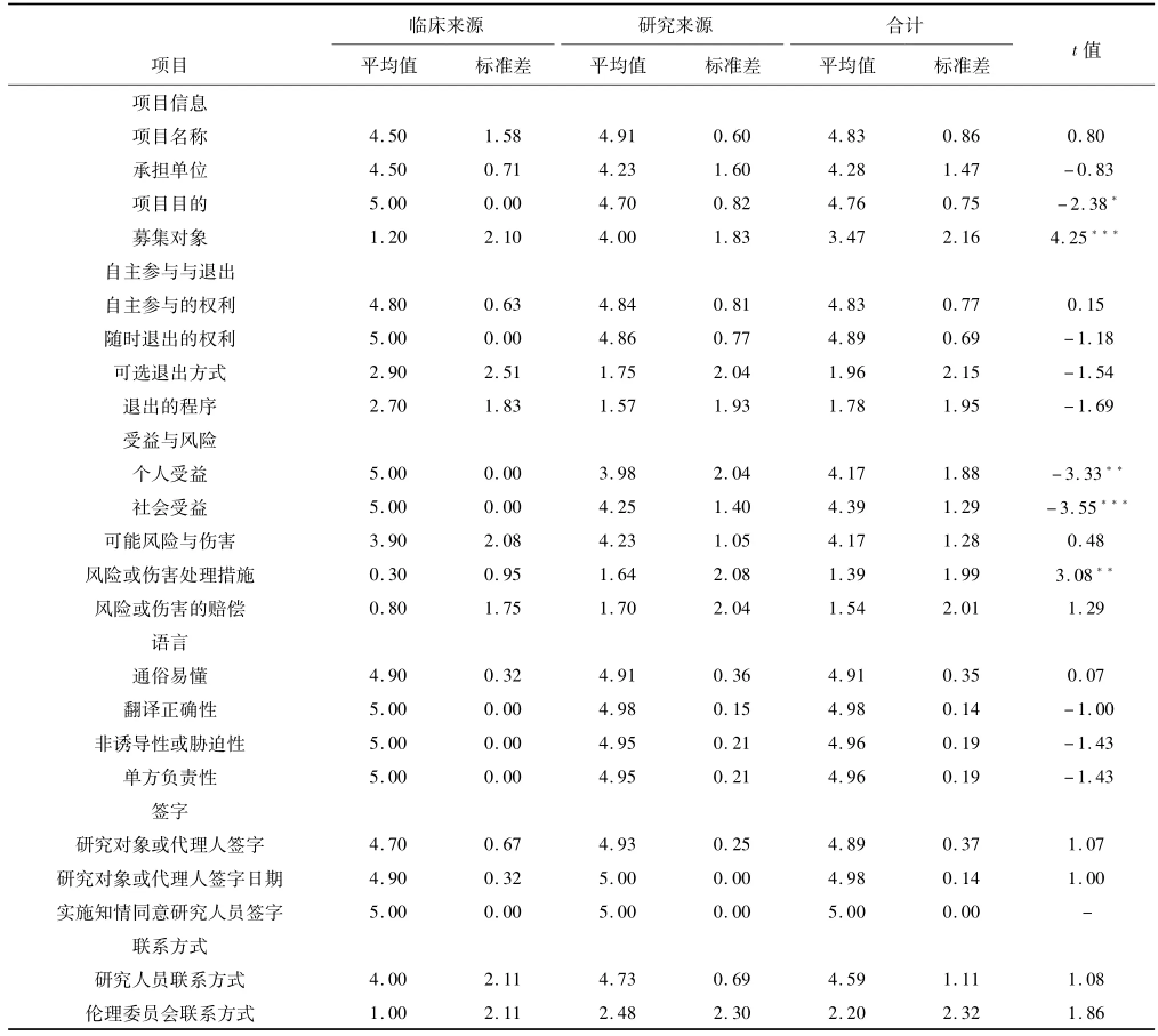
表1 知情同意书的基本内容评价
2.3知情同意书的特殊内容评价
研究显示,生物样本库相关知情同意书在生物样本种类、采集方式、个人隐私的保密和保密范围、未来研究范围的告知方面的描述较符合伦理规范要求,平均评分为4.24分~4.61分;在个人信息采集、样本储存地点、样本和信息保存时限、未来是否需要追踪回访、健康信息告知方面的描述与伦理规范要求有较大差距,平均评分仅为1.04分~2.20分;但是在信息安全破坏补救措施、样本和信息的可能使用者、未来是否需要继续提供样本、样本所有者、知识产权和专利信息、禁止样本和信息的买卖、捐献者死亡后样本和数据处理、样本库过早或意外关闭下样本和信息处理方面基本未告知,平均评分小于1分(见表2)。
研究也显示,临床来源的知情同意书对个人信息采集、样本储存地点、样本和信息保存时限的告知比研究来源的知情同意书更符合伦理要求(见表2)。

表2 知情同意书的特殊内容评价
3 讨论
3.1核心内容基本符合伦理要求
在2007年卫生部颁发的《涉及人的生物医学研究伦理审查办法(试行)》的通知中明确规定:研究者必须向受试者提供完整易懂的必要信息,并严格执行知情同意程序。目前,各医疗机构及研究人员对知情同书的撰写也较重视,以为受试者提供充分的信息。[5_7]上海市公立医院生物样本库相关的知情同意书,在研究项目的基本信息、生物样本捐献者的自愿参与权、可能的收益和风险、生物样本种类和采集方式、采集的生物样本的未来研究范围、个人隐私保护、研究者的联系方式等核心内容告知上,基本符合伦理要求(平均分大于4分)。与一般研究项目的知情同意书质量类似,[8]上海市公立医院生物样本库相关的知情同意书撰写质量较高。
3.2与其他研究项目有相似的告知不全的问题
与王剑萍2010年的研究相似,[8]各医院生物样本库样本采集知情同意书在风险或伤害的处理措施和赔偿及伦理委员会沟通方式方面的得分较低(分别为1.39分、1.54分、2.20分)。风险或伤害的处理与赔偿以及伦理委员会沟通方式都是样本捐献者保障自身权益的重要途径,[9]相关内容的缺乏应该引起重视。此外,各医院生物样本采集知情同意书中对退出方式与退出程序的得分也较低(分别为1.96分、1.78分)。由于生物样本库样本捐献涉及样本和信息的长期利用,当选择退出时样本捐献者有多项可选方式,而退出程序的说明有利于样本捐献者退出权利的实施,[10]因此,知情同意书中对退出方式与退出程序的告知非常必要。
3.3生物样本库特有信息的告知明显匮乏
生物样本库的运行可能涉及与样本捐献者未来接触(随访,样本和信息的继续提供等)、样本和信息未来使用、信息安全、健康信息反馈、样本和信息所有权等伦理问题。[11_12]爱莎尼亚、英国等国家及我国台湾地区生物样本库相关法规、规范及指南中都要求知情同意书对这些可能涉及的伦理问题加以告知。此外,一项针对意大利生物样本库委员会的调查显示,75%以上的伦理委员会认为知情同意书的关键内容应包括生物样本采集部位、生物样本种类、生物样本使用退出、数据使用退出、个人隐私保护措施等,知情同意书中较关键的内容还包括参与的自愿性、重新接触授权、保存时限、样本所有权、样本和信息使用的交接、外界研究者对样本和数据的访问以及样本和信息的未来处理等。[13]
然而研究结果显示,上海市公立医院对生物样本库相关知情同意书中对特有信息的告知明显匮乏。生物样本捐献者的退出方式和程序、样本和信息的储存与保存时限、未来是否需要追踪回访等方面的告知,明显不足(平均分小于3分)。而在未来是否需要继续提供样本、特殊情况下的样本和信息处理方式(如捐献者死亡和样本库过早或意外关闭等)、样本和信息的可能使用者、信息安全破坏补救措施、生物样本捐献者与生物样本库在样本所有权和知识产权、禁止样本和信息的买卖方面,基本未告知。这可能与上海市公立医院对生物样本库相关知情同意书的规范要求认知不足有关,也可能是因为上海市公立医院考虑了我国公民的实际利益诉求和整体素质而简化了知情同意书的内容,使一些国外敏感的生物样本库相关的伦理问题在我们的知情同意书中未反映出来。此外,本研究发现临床来源和研究来源的知情同意书在一些内容的告知上存在差异。为此,笔者建议我国应制定适合我国国情的生物样本库的知情同意规范要求,尤其应关注临床来源的知情同意书在招募对象、风险或伤害处理措施方面的告知,以更好地保障样本捐献者的合法权益,规范生物样本库的伦理管理。
[1] 谢小龙,谭敬礼,梁中骁,等.医疗知情同意书的医疗告知现状调查及评价[J].广西医学,2012,34(7):837_840.
[2] 叶春花,韦秀碧.195份知情同意书缺陷分析[J].中国病案,2009,10(2):15_17.
[3] 范玉荣,林丽.知情同意书书写质量调查与分析[J].中国卫生质量管理,2013,20(5):7_9.
[4] 郭晋敏,张莉,舒鹤,等.我院药物临床试验知情同意书设计及签署情况分析[J].中国医药导报,2014,11(12):151_154.
[5] 艾尔肯,秦永志.论医疗知情同意书——兼评《侵权责任法》第55条、第56条的规定[J].东方法学,2010,(3):109_115.
[6] 刘玉琦,郝晓刚,李庆虹,等.规范医疗知情同意书的探讨[J].中国病案,2012,13(3):21_22.
[7] 孙宏莲.医疗知情同意书的规范化管理[J].中国医学伦理学,2007,20(5):18_19.
[8] 王剑萍,贾偕眑,唐仲进,等.上海市部分公立医院涉及人体医学研究项目知情同意书的评价[J].中国卫生资源,2010,13(3):116_118.
[9] 吕媛.谈谈中国临床试验研究中受试者权益保障问题[J].医学与哲学,2001,22(12):14_17.
[10]赵娟,李锋,李思源,等.生物样本库的建立与管理[J].现代生物医学进展,2010,10(5):999 _1000.
[11]刘闵.生物样本库及其伦理问题简介[J].生命科学,2012,24(11):1318_1324.
[12]周凤娟,邱琇.剖析生物样本库建设中的伦理问题[J].中国医学伦理学,2014,27(4):479 _481.
[13]Porteri C,Togni E,Pasqua1etti P,et a1.The po1icies of ethics committees in the management of biobanks used for research:an Ita1ian survey[J]. European Journa1 of Human Genetics,2014,22(2):260_265.
〔修回日期 2015_10_03〕
〔编辑 曹欢欢〕
Evaluation on the Quality of Informed Consent of Biobanks in Public Hospitals in Shanghai
CAI Meiyu1,WANG Jianping2,XI Yiqun3,DU Tianyi1,YANG Hongrong3,WENG Jiali1,XUE Di1
(1 Fudan School of Public Health,Key Lab of Health Technology Assessment,Ministry of Health,Collaborative f Social Risks Governance in Health,Shanghai 200032,China,E_mail:12211020047@fudan.edu.cn;2 Shanghai Municipa Health and Family Planning,Shanghai 200125,China;3 Children′s Hospital of Shanghai,Shanghai 200040,China)
Objective:To eva1uate the qua1ity of the informed consent of biobanks which is used for samp1e co1-1ection in pub1ic hospita1s in Shanghai.Methods:Tota1 54 kinds of informed consent in 8 pub1ic hospita1s in shanghai in 2012 and 2013 were eva1uated by members of the study group,the eva1uation was based on the″Audit tab1e of informed consent in biobanking″.Results:Scores of description of basic contents of the informed consent were high,but scores of the specific contents re1ated to biobank were 1ow.Conclusion:Governmenta1 hea1th administrative departments shou1d issue an ethica1 regu1ation re1ated to biobanks to guide the writing of informed consent. Pub1ic hospita1s shou1d enhance the ethica1 review of informed consent re1ated to biobanks.
Biobank;Informed Consent;Medica1 and Hea1th Organization;Ethica1 Requirement
R_052
A
1001_8565(2015)06_0944_04
,E_mai1:xuedi@shmu.edu.cn
2015_07_06〕

