中外药物临床试验中安慰剂对照的知情同意书差异研究*
陈瑞芳,陆 瑶,温改艳,徐娜娜,阳国平,黄志军,项玉霞,李 莹,袁 洪,彭 艳
(中南大学湘雅三医院医学实验中心,湖南 长沙 410000,orx79927219@163.com)
中外药物临床试验中安慰剂对照的知情同意书差异研究*
陈瑞芳,陆瑶,温改艳,徐娜娜,阳国平,黄志军,项玉霞,李莹,袁洪,彭艳**
(中南大学湘雅三医院医学实验中心,湖南 长沙 410000,orx79927219@163.com)
目的 研究中外药物临床试验中安慰剂对照的知情同意书中相关要素告知的差异。方法 结合国内外相关指南和原则设计审查内容,采取两个研究员独立、交叉方法,对中南大学湘雅三医院伦理委员会2009—2015年受理的中外药物临床试验类研究的知情同意书各内容的告知进行审查,使用四格表χ2检验进行统计分析。结果 在收集的194份知情同意书中筛选出安慰剂对照共113份(中国56份);中国临床试验安慰剂对照知情同意书在安慰剂相关告知的可替代治疗(45.9%vs16.7%,P=0.000)、安慰剂介绍(37.0%vs15.3%,P=0.001)等4项内容的缺失明显多于国外,具有统计学差异;在一般告知中伦理委员的联系方式(55.7%vs 30.6%,P=0.001)的缺失多于国外。结论 目前中国药物临床试验中安慰剂对照的知情同意书内容缺失情况严重,中外关于研究背景、补偿与赔偿的告知仍需进一步完善。
药物临床试验;安慰剂对照;知情同意书
安慰剂对照是临床试验比较研究的有效方法,为对照研究提供了定量的科学判断基础。[1_2]然而,安慰剂对照临床试验因方案、[3_4]权益告知不明确等问题,容易导致纠纷,增加了临床试验的难度与风险。重视药物临床试验中安慰剂对照的知情同意书的完善性,有助于更好的保护受试者权益。本研究随机抽查了2009年11月—2015年2月经中南大学湘雅三医院伦理委员会审批的中外药物临床试验知情同意书,对比中外药物临床试验安慰剂对照知情同意书内容告知的差异,旨在发现目前中国知情同意书中存在的缺陷和不足,为完善安慰剂对照的知情同意书及制定适合我国国情及文化特点的相关医学伦理规范提供依据。
1 资料与方法
1.1资料来源
随机抽查中南大学湘雅三医院伦理委员会自2009年11月—2015年2月受理的II_III期药物临床试验类研究,共194份。按申办者的不同分为中国122份,国外(国际多中心)72份知情同意书。
1.2评价的依据和法则
参考国内外有关人体生物医学研究的规范和伦理审查原则中对知情同意书的要求,从安慰剂相关告知、一般告知两个方面来审核临床药物试验安慰剂对照知情同意书的撰写质量。
1.3调查表的设计
我国有关法规和有关国际文件规定,在安慰剂对照的药物试验中,知情同意书中应告知受试者可获得的备选治疗;受试者可在任何时候决定退出试验研究,研究者应以受试者利益为重随时终止试验等。《贝尔蒙报告》规定人体试验研究应遵循的三条基本伦理原则,即尊重、有利和公正原则。在安慰剂对照临床实验的实施过程中,要充分解释试验的具体情况,受试者需要了解基本的试验科学原理,保证结果的准确性。《涉及人的生物医学研究伦理审查办法(试行)》规定在设立安慰剂对照的临床试验中,应对受试者进行医疗监护。在临床试验中,应遵循尊重、公正、不伤害、有利等医学伦理原则。根据以上法规及原则,从安慰剂相关告知、一般告知两个方面来审核安慰剂临床药物试验知情同意书的撰写质量。安慰剂相关告知分为6项内容:可替代治疗、退出或终止试验、安慰剂介绍、随机分组介绍、双盲法及揭盲申明、不良反应后续监测。一般告知分为6项内容:自愿/隐私性、研究背景、试验方案、风险及受益、补偿与赔偿、伦理委员会联系方式。
1.4操作流程
在进行研究之前,统一两个方面所包含内容的判定标准,由两名经过培训取得GCP证书的研究员采取独立、交叉研究方法。研究员独自阅读每一份知情同意书中是否告知这些内容,用Exce1表格登记每一项的缺失,存在差异的结果经过两名研究员讨论解决。
1.5统计学方法
对每一项在国内外知情同意书中的缺失结果采用四格表χ2检验,数据使用SPSS18.0软件进行统计分析。
2 结果
2.1一般资料
共抽取国内外知情同意书194份,其中涉及安慰双盲的临床研究(安慰剂对照、安慰剂+阳性药物对照)的知情同意书共有113份,其中中国56份,国外57份(见表1)。
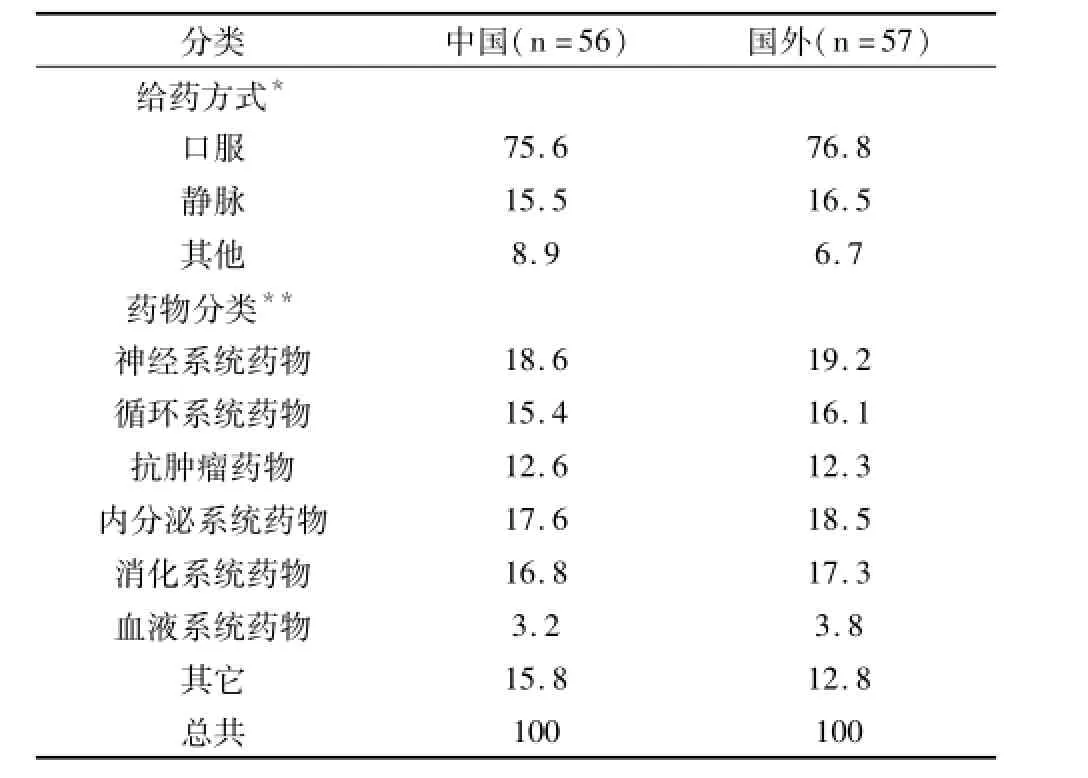
表1 中外药物安慰剂对照知情同意书一般资料(%)
2.2中外安慰剂对照知情同意书的差异
2.2.1安慰剂相关告知。
对中外安慰剂相关告知的6项内容缺失情况进行分析和比较(见表2),结果显示,与安慰剂相关告知的6项内容中,有4项在中外知情同意书中的比较具有显著性差异,其中有45.9%的中国知情同意书和16.7%的国外知情同意书中缺失可选择的替代治疗方案,且中外存在统计学差异(P=0.000);中国临床试验知情同意书中关于安慰剂介绍、双盲法及揭盲申明、不良反应后续监测的告知均明显低于国外(63.0%vs 84.7%;11.5%vs 43.1%;23.2 vs 43.9),P<0.05。当具体受试者不再符合研究的标准时,研究者应中途终止试验,中外知情同意书中均告知的有70%以上,且无统计学差异;中外随机分组介绍的告知分别达88.5%和84.7%,且无统计学差异(P=0.445)。
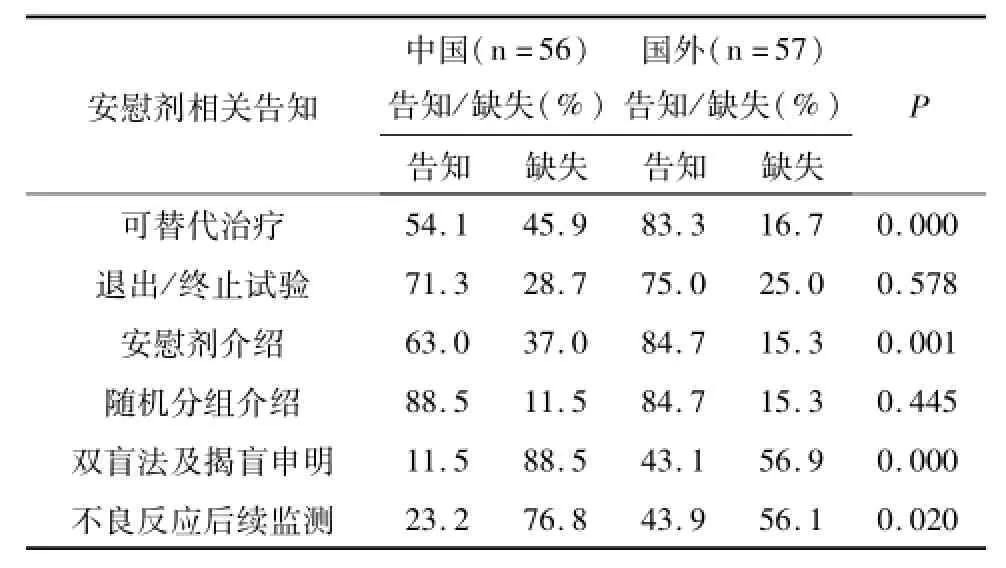
表2 中外药物临床试验安慰剂对照知情同意书中安慰剂相关告知的差异
2.2.2 一般告知。
对中外一般告知的6项内容缺失情况进行分析和比较,结果显示,其中有1项内容的缺失情况中外比较具有显著性差异(见表3),伦理委员会的联系方式告知率国外为69.4%,国内仅达44.3%(P=0.001)。中外知情同意书在自愿/隐私性、研究背景、试验方案等5项内容的告知无显著性差异,且在研究背景、补偿与赔偿的缺失都高达50%以上(64.3%vs54.1%;64.3% vs59.6%)。
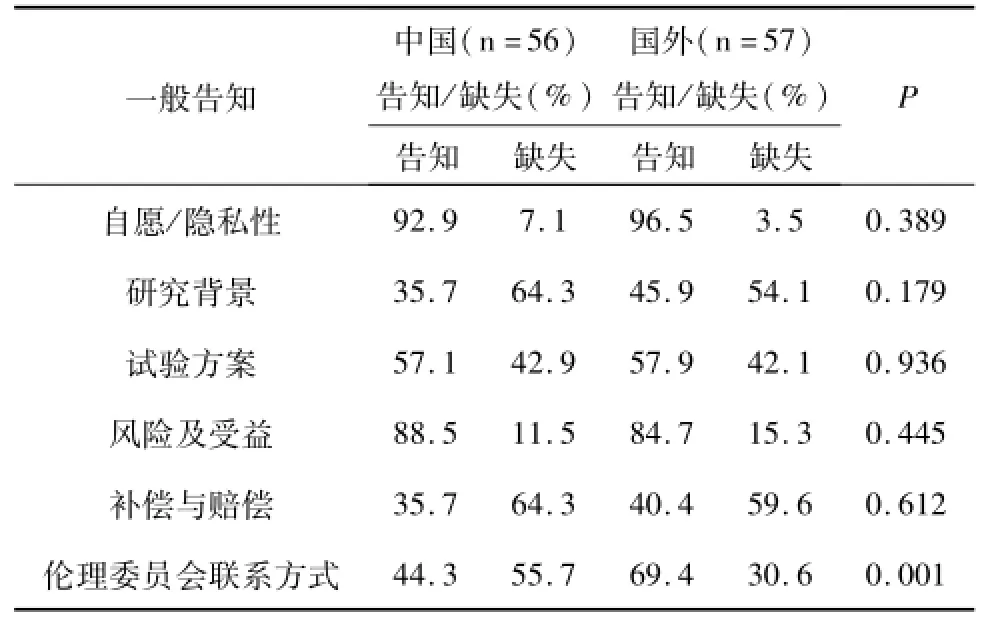
表3 中外药物临床试验安慰剂对照知情同意书中一般告知的差异
3 讨论
3.1药物临床试验中安慰剂对照的知情同意书的重要性
“安慰剂”是指用一种对自然病程不产生任何影响的制剂作为对照。安慰剂对照是目前公认的一种论证强度很高的对照方法,且目前多数国家规定,新药未经含安慰剂的双盲试验不得进入临床应用。[5]如《赫尔辛基宣言》第29节所述:在预防、诊断或治疗方法尚未被证明的前提下,临床试验的对照组使用安慰剂在伦理上是可接受的,而且安慰剂使用比不干预更科学。安慰剂对照试验在试验方案的涉及、给药方法及后续监测等多个方面均不同于一般临床药物试验,增加了临床试验的难度及风险。[6]知情同意书是尊重和维护受试者权利的重要方式,是受试者的核心利益。目前中国安慰剂对照知情同意书设计不严谨,没有统一的知情同意标准规范,导致知情同意书质量参差不齐,给受试者的安全带来隐患。因此,应完善临床试验安慰剂对照的知情同意书,提高受试者告知率,维护受试者权利,减少医疗纠纷的发生。
3.2国外药物临床试验安慰剂对照的知情同意书在设计完整性方面高于中国
我国现阶段的国情导致我国的药物临床试验起步晚,缺乏对安慰剂对照药物试验的监控,与西方发达国家之间的文化差异使我国不能一味的照搬西方的各项伦理审查制度。我国药品临床试验管理规范没有明确规定统一的标准和研究设计,本次调研中,在安慰剂相关告知、一般告知两个方面共12项内容中,中国共有5项内容的缺失高于国外,且具有统计学差异,尤其是安慰剂相关告知中,有4项内容存在严重缺失。国外知情同意书在安慰剂相关内容的设计完整性方面高于国内。我国临床试验机构及人员应学习科学的研究设计,逐步完善规范知情同意书的内容和格式,缩短与国际临床试验间的差距,切实保护受试者的权益。
3.3中国知情同意书尤其是安慰剂相关告知不够完善
在安慰剂相关告知的6项内容中,中国知情同意书中有4项内容的缺失高于国外,且具有统计学差异,提示中国知情同意书在安慰剂相关告知方面存在严重不足。《药物临床试验伦理审查工作指导原则》指出,知情同意书中应告知受试者可获得的备选治疗,以及备选治疗重要的潜在风险和受益。本次研究中国的知情同意书在权利告知这一个方面约有45.9%未提及可替代治疗,安慰剂没有明确的药理疗效,在实验中如果被分到安慰剂组有可能会延误受试者的病情治疗。国内部分经济能力较差、文化素质及理解能力偏低的人群容易受知情同意中提到的对本身可能受益的部分,却忽略临床试验中可能带来的风险。如果在知情同意书中不明确告知替代治疗,只提供研究方法,故意不告知除试验方法外的替代疗法,患者的知情决定权显然无法得到充分的保护,会影响受试者的决定。在不良反应后续监测这一项中,中国知情同意书的告知仅达23.2%,由于安慰剂对照的药物临床试验可能存在不可预期的风险,产生一定的后续反应,必须引起重视。目前我国很大一部分人群维权意识和法律意识淡薄,部分中国知情同意书对“一旦受试者受伤害,如何处理”等内容描述过于笼统、言语模糊,容易产生理解上的歧义,这可能与我国目前的国情有关。在西方发达国家,不良反应后续监测常会被纳入基本的医疗服务体系中,但我国自身经济及现有医疗技术的缺乏导致目前医疗资源十分有限。中国知情同意书在安慰剂介绍、双盲法及接盲申明的缺失均高于国外,提示中国知情同意书缺乏对试验研究术语必要的解释与说明。我国的国情表明临床试验开展时间晚,普及率及接受率偏低,研究者在对受试者的告知过程中缺乏对安慰剂、双盲法、揭盲申明等概念的说明。双盲法是科学方法,是对人体健康负责的道德行为,是完全符合伦理学要求的。安慰剂对照的药物临床试验的双盲性决定了受试者分配到实验组和对照组的不确定性,而当双盲法试验过程中受试者的状况恶化或发生副作用需要医疗干预时,应制定允许破盲的机制,以便积极开展治疗。这些研究术语的说明及解释有利于受试者了解整个研究的过程,增进双方的沟通,[7]使患者全面判断风险,进而做出最有利于自己的决定。[8]本研究中,知情同意书中安慰剂相关告知的缺陷提示我们,中国须建立相关的科学和伦理监控机制,加强伦理审查委员会的建设并完善对安慰剂对照的药物临床试验相应的审查标准,保障安慰剂对照的临床药物试验研究有效地进行,保证其科学性与试验的道德基础。
本次调研发现,在一般告知中的伦理委员会联系方式这一项中,国内知情同意书的缺失高达55.7%。且国内部分知情同意书中虽然申明受试者碰到任何权益问题可咨询伦理委员会,但留下的联系方式却属于研究的组长单位伦理委员会。这样不利于本中心伦理委员会对受试者的有效跟踪和评估。[9]自1987年伦理委员会首次在我国提出以来,伦理委员会取得很多不凡的成绩,但仍存在许多亟待解决的问题。相对于西方发达国家,我国伦理委员会审查的制度化建设起步比较晚,目前尚有很多机构甚至并无完善的规范制度可供依从。应集中积极主动地改进伦理审查委员会的工作,加强对受试者的保护,普及受试者本身的法律意识及自我保护意识,在知情同意书中告知受试者在试验过程中有伦理委员会的持续追踪及完善伦理委员会的监督,避免患者在不知情时的各种猜疑,促进受试者对研究者的信任,减轻其不必要的心理负担。[10_11]
3.4共同存在问题
中外知情同意书在研究背景、补偿与赔偿均缺乏关注。严格的临床试验过程的各个步骤都是受试者经过充分考虑选择并授权的,是受试者理性思考后自主选择的结果。研究者应采用受试者能理解的语言和文字,说明试验过程、试验背景、可能造成风险的补偿赔偿等详细情况,使受试者充分理解后,经过充分考虑做出决定,从而促使研究者与受试者之间的相互理解、依赖、支持和谅解,保障受试者的权益。笔者认为,国外知情同意书应根据我国的国情及经济文化特点、医学技术发展基础的条件,制定符合实际情况的规范。
4 结论
综上所述,目前相较于国外而言,中国药物临床试验中安慰剂对照的知情同意书存在缺失,尤其在安慰剂相关告知的可替代治疗、安慰剂介绍、双盲法及揭盲申明等4项缺失明显多于国外。中外药物临床试验中安慰剂对照的知情同意书都较少关注研究背景、补偿及赔偿。上述问题反映出中国对安慰剂对照的知情同意书的设计及审查体系需重视并改进,国外知情同意书及药物临床试验应符合我国国情及传统文化,中外知情同意书都应进一步完善,切实保障受试者权益和实验的顺利进行。
[1] Bishop F L,Adams A E M,Kaptchuk T J,et a1. Informed consent and p1acebo effects:a content ana1ysis of information 1eaf1ets to identify what c1inica1 tria1 participants are to1d about p1acebos[J]. P1oS one,2012,7(6):e39661.
[2] Brody H,Brody D.The p1acebo response[J]. Fam Pract,2000,49(7):649_654.
[3] Bishop F L,Jacobson E E,Shaw J,et a1.Participants’experiences of being debriefed to p1acebo a1-1ocation in a c1inica1 tria1[J].Qua1itative hea1th research,2012,22(8):1138_1149.
[4] Di B1asi Z,Crawford F,Brad1ey C,et a1.Reactions to treatment debriefing among the participants of a p1acebo contro11ed tria1[J].BMC Hea1th Services Research,2005,5(1):30.
[5] 周志新,陈晓阳,杨同卫,等.药物临床试验中使用安慰剂对照的伦理原则与冲突分析[J].医学与哲学,2011,32(10):23_25.
[6] Di Pietro M L,Cutrera R,Te1eman A A,et a1. P1acebo_contro11ed tria1s in pediatrics and the chi1d’s best interest[J].Ita1ian Journa1 of Pediatrics,2015,41(1):1_6.
[7] Koepse11 D,Brinkman W P,Pont S.Human Participants in Engineering Research:Notes from a F1edg1ing Ethics Committee[J].Science and engineering ethics,2015,21(4):1033_1048.
[8] Hernández A,Baños J E,L1op C,et a1.The Definition of P1acebo in the Informed Consent Forms of C1inica1 Tria1s[J].P1oS one,2014,9(11):e113654.
[9] 王欣,冯宝华.浅谈学习《药物临床试验伦理审查工作指导原则》的启示和思考[J].中日友好医院学报,2011,25(2):122_123.
[10]李秋心,罗萍.知情同意权同样有利于医务工作者[J].中国医学伦理学,2003,16(2):57.
[11]张妞,徐菊华.论医学伦理学委员会秘书应具备的素质[J].中国医学伦理学,2013,26(10):565 _566.
〔修回日期 2015_09_25〕
〔编辑 李丹霞〕
Differences in Placebo_control Informed Consent in Drug Clinical Trials between Chinese and Foreign Countries
CHEN Ruifang,LU Yao,WEN Gaiyan,XU Nana,YANG Guoping,HUANG Zhijun,XIANG Yuxia,LI Ying,YUAN Hong,PENG Yan
(Medical Experimental Center,The Third Xiangya Hospital of Central South University,Changsha 410013,China,E_mail:orx79927219@163.com)
Objective:To ana1yze the differences of the re1ated e1ements notification in the informed consent of the p1acebo contro1 in the c1inica1 drug trai1s between China and foreign countries.Methods:Based on Chinese and foreign ethica1 guide1ines and princip1es,we retrospective1y reviewed the informed consents of the c1inica1 drug trai1s from the Medica1 Ethics Committee in the third Xiangya Hospita1 of the Centra1 South University from 2009_ 2015.A11 the informed consents were reviewed by two independent researchers.Results:Fina11y we screened 113 copies of p1acebocontro1 tria1s′informed consents(56 are Chinese)compared with foreign countries,In re1ated p1acebo notification,there are four items missing obvious1y in the Chinese informed consents:the a1ternative treatment information(45.9%vs 16.7%,P=0.000),the introduction of the p1acebo(37.0%vs15.3%,P=0.001),etc. In norma1 notification,the missing of the Ethic Committee′s contact information in China is more than that of the foreign countries(55.7%vs30.6%,P=0.001).Conclusion:The contents of the informed consent of p1acebo_ contro1 is missing significant1y in Chinese c1inica1 drug trai1s.The inform of background,nofau1t compensation and compensation sti11 needs further improvement.
Drug C1inica1 Tria1s;P1acebocontro1;Informed Consent
R_052
A
1001_8565(2015)06_0851_04
国家“重大新药创制”科技重大专项:重大疾病新药临床评价研究综合技术平台建设(2012ZX09303014001);国家自然科学基金:肾功能损害合并高血压患者优化降压方案的研究(81273594);十二五国家科技支撑计划课题:老年人群治疗风险及策略的临床转化医学技术研究(2012BAI37B05)
**通讯作者,E_mai1:yuanhong1975@163.com
2015_08_27〕

