白桂木凝集素基因的5’RACE与3’RACE扩增及序列分析
刘小芹,罗育,曾麒燕(广西医科大学基础医学院,广西 南宁 530021)
白桂木凝集素基因的5’RACE与3’RACE扩增及序列分析
刘小芹,罗育,曾麒燕
(广西医科大学基础医学院,广西 南宁530021)
摘要:[目的]对白桂木凝集素基因进行扩增及序列分析。[方法]采用RT-PCR结合RACE技术,扩增得到白桂木凝集素(AHL)基因的保守区域、5’末端及3’末端。用Vector NTI软件将测序得到的AHL cDNA的保守区域、5’末端、3’末端进行校正、拼接得到完整AHL cDNA序列。[结果]全长含有933个核苷酸。其推导的氨基酸序列NCBI做BLAST比对,相似度高达70%~80%。[结论]对白桂木凝集素基因的cDNA序列进行研究,可为进一步从分子水平探明白桂木凝集素的作用机制提供科学依据。
关键词:白桂木凝集素;RACE技术;基因克隆;序列分析
白桂木(Artocarpus hypargyreus Hance)系桑科波罗蜜属常绿乔木,是一种经济价值很高的树种,主要分布于桂东南地区。其根可入药,味甘、淡,性温,具有祛风利湿、活血通络等功效[1],在民间应用较广泛。白桂木种子富含白桂木凝集素(Artocarpus hypargyreus Hance lectin,AHL),其药用价值已经引起医药学界的注意。本课题组前期研究发现,AHL能够促进小鼠骨髓来源树突状细胞(BmDC)的分化成熟,能够抑制人急性白血病T淋巴细胞(Jurkat T)及小鼠T淋巴瘤细胞(EL-4)的增殖[2];并对白桂木基因组DNA的提取方法进行了研究[3]。本实验首次报道AHL基因的cDNA序列,为今后进一步从分子水平探明AHL的作用机制及其在临床疾病防治等方面的开发应用奠定良好的理论基础。
1 实验方法
1.1材料新鲜的白桂木叶子于2013年7月采自广西药用植物园,选取其中嫩、大、薄的叶片经液氮速冻后保存于-80℃冰箱备用。Easypure Plant RNA Kit(北京全式金),RT-PCR反转录试剂盒(Fermentas),Taq DNA聚合酶,聚乙烯吡 咯 烷 酮 (Polyvinylpyrrolidone,PVP),pMD-18T载 体(Takara),SMARTTMRACE cDNA Amplification kit(BD Bioscience Clontech Company),DNA回收试剂盒(北京全式金),引物合成和测序分别由深圳华大基因科技有限公司和上海生工生物工程技术服务有限公司完成。
1.2白桂木叶片总RNA抽提参考北京全式金公司的Easypure Plant RNA Kit试剂盒说明书提取总RNA,采用1%琼脂糖凝胶电泳检测其完整性。
1.3AHL基因cDNA保守区域的获得根据NCBI网站上已公布的木菠萝凝集素家族的mRNA序列,利用Primer 5.0设计扩增AHL基因cDNA保守区域的特异性引物,见表1。以白桂木总RNA为模板,按照RT-PCR反转录试剂盒(Fermentas)的说明方法反转录获得白桂木cDNA。以获得的白桂木总cDNA为模板,以WBF、WBR为上、下游引物,扩增AHL保守区域cDNA片段。PCR反应程序为:94℃5 min;94℃30 s;42℃30 s;72℃1 min,共进行35个循环;72℃10 min。胶回收试剂盒纯化回收,将纯化后的白桂木PCR产物送至上海生工生物工程技术服务有限公司测序。
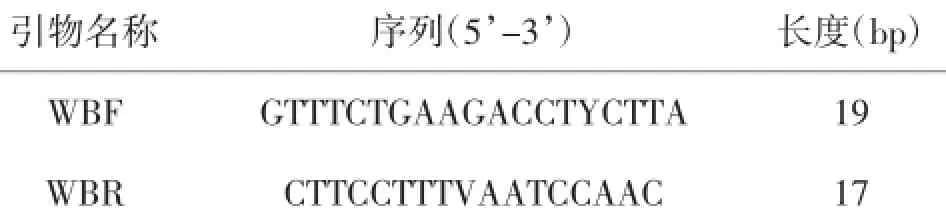
表1 用于扩增AHL基因cDNA保守区域的引物
1.4AHL基因的5’RACE以AHL基因的cDNA保守区域的序列为模板,用Primer 5.0设计了两条特异性引物W51、W52,见表2。按照SMARTTMRACE cDNA Amplification kit说明书操作,合成5’-ready cDNA,以5’-ready cDNA为模板,以W51和UPM(试剂盒中提供)为引物,进行第一轮PCR扩增。PCR反应程序为:94℃5 min;94℃30 s;68℃30 s;72℃3 min,共进行25个循环;72℃10 min。将PCR产物用TE缓冲液(试剂盒中提供)稀释50倍作为巢式PCR的模板,以W52和NUP(试剂盒中提供)为引物,进行巢式PCR扩增。巢式PCR反应程序为:94℃5 min;94℃30 s;68℃30 s;72℃3 min,共进行20个循环;72℃10 min。反应产物经1%琼脂糖凝胶电泳检测。

表2 AHL 5’RACE引物
1.5AHL基因的3’RACE以AHLcDNA保守区域的序列为模板,用Primer 5.0设计3’RACE的引物W31、W32,见表3。按照SMARTTMRACE cDNA Amplification kit说明书操作,合成3’-ready cDNA,以3’-ready cDNA为模板,以W31和UPM(试剂盒中提供)为引物进行第一轮PCR扩增。PCR反应程序为:94℃5 min;94℃30 s;68℃30 s;72℃3 min,共进行25个循环;72℃10 min。将PCR产物用TE缓冲液(试剂盒中提供)稀释50倍作为巢式PCR的模板,以W32和NUP(试剂盒中提供)为引物进行巢式PCR扩增。巢式PCR的反应程序为:94℃5 min;94℃30 s;68℃30 s;72℃3 min,共进行20个循环;72℃10 min。反应产物经1%琼脂糖凝胶电泳检测。

表3 AHL 3’RACE引物
1.6目的片段测序及序列分析5’RACE、3’RACE扩增条带切胶回收,连接于pMD-18T载体上,小量抽提质粒DNA,委托上海生工生物工程技术服务有限公司测序。采用Vector NTI对AHL基因的cDNA的保守区域、5’末端、3’末端进行校正、拼接得到完整AHL cDNA序列。将其推导的AHL氨基酸序列提交到NCBI数据库做BLAST比对。
2 结果与分析
2.1白桂木总RNA提取与检测利用试剂盒法抽提的白桂木叶片总RNA,经紫外分光光度计检测,A260/A280比值为1.82,表明所提取的RNA纯度很高。琼脂糖凝胶电泳检测表明,抽提的白桂木叶片总RNA没有受到基因组DNA和蛋白质的污染,28 s核糖体RNA和18 s核糖体RNA的带型清晰,没有拖尾现象,两条带的亮度比基本呈现2∶1的关系,说明RNA完整性比较好。如图1。

图1 白桂木叶片总RNA提取凝胶电泳图
2.2AHL基因的cDNA保守区域扩增AHL cDNA保守区域扩增产物经1%琼脂糖凝胶电泳检测可见一条500 bp左右的条带,如图2。经测序得保守区域含有478个核苷酸。

图2 AHL 基因cDNA 保守区域琼脂糖凝胶电泳
2.3AHL RACE扩增和序列分析AHL 5’RACE-PCR产物经1%琼脂糖凝胶电泳检测可见一条500 bp左右的条带,测序结果为403个核苷酸,3’RACE-PCR产物经1%琼脂糖凝胶电泳检测可见一条700bp左右的条带,测序结果为631个核苷酸。电泳结果如图3。经Vector NTI校正、拼接得到ALL cDNA全长为952个核苷酸,如图4。将推导的AHL氨基酸序列提交到NCBI数据库做BLAST比对,发现AHL与同为桑科的木菠萝凝集素Jacalin的四种同工凝集素(登陆号为: AAA32677.1,AAA32678.1,AAA32679.1,AAA32680.1)及黑桑凝集素MornigaG的两种同工凝集素(登陆号为:AAL09163.1,AAM90088.1)相似度最高。相似度为70%~80%。如图5。
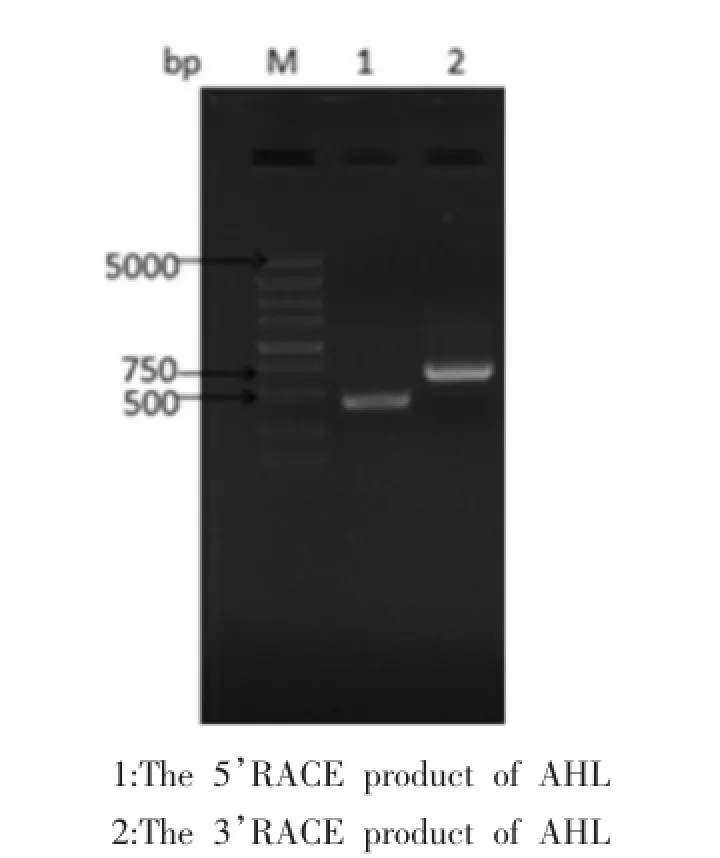
图3 RACE-PCR产物的电泳结果

图4 AHL的mRNA序列及推导的氨基酸序列

图5 AHL与木菠萝凝集素家族多序列对比
3 讨论
伴随着生物科学技术的迅猛发展,近年来产生了一系列克隆新基因的方法与技术:图谱克隆技术,转座子标签技术,mRNA差异显示技术,基因组减法技术以及cDNA文库筛选技术等[1]。SMARTTM3’RACE的原理为:以连接有SMART寡核苷酸序列的通用接头引物的Oligo(dT)30MN作为锁定引物,与mRNA3’末端的poly(A)尾结合,逆转录合成第一链cDNA。再以基因特异性引物GSP1作为上游引物,用含有部分接头序列的通用引物UPM作为下游引物,以获得的第一链cDNA为模板,进行PCR扩增,从而获得目的基因的3’末端cDNA序列。SMARTTM5’RACE的原理为:以Oligo(dT)30MN作为锁定引物在逆转录酶MMLV的作用下,与mRNA3’末端的poly(A)尾结合,逆转录合成cDNA第一链。此逆转录酶具有末端转移酶的活性,当逆转录到达cDNA第一链的5’末端时,会在其末端自动加上3~5个dC残基,退火后,dC和含有Oligo(dG)的SMART寡核苷酸序列的通用接头引物配对,转换为以SMART序列为模板继续延伸而连上通用接头。以SMART cDNA第一链作为模板,以含有部分接头序列的通用引物UPM和基因特异性引物GSP2为上、下游引物,进行PCR扩增,扩增目的基因5’末端序列。
根据邢桂春等[4]的研究发现,使用CLONTECH的SMARTTMRACE技术能够获得更长的片段。SMART RACE采用了自动热启动的技术,通过在Advantage 2 Ploymerase中加入其单克隆抗体,使得在温度上升到抗体失活之前,抗体可以阻碍聚合酶的活性,使实验取得了较好的结果[5]。特异性引物的设计是RACE反应能否成功的关键因素[6]。本实验通过设计26~28个碱基,GC含量大于50%,Tm值大于70℃的引物来提高反应的特异性。本实验进行首轮RACE-PCR扩增后,产物上样于1%琼脂糖凝胶,电泳检验无扩增条带,分析其原因可能因为模板浓度过低,退火温度过低,PCR循环次数过多等。针对上述可能原因,本实验通过同等条件下设置不同量的模板,进行梯度PCR摸索退火温度,减少循环次数等,均未获得特异性条带。徐烨等[6]研究发现,把巢式PCR和RACE技术相结合能够提高克隆的精准度。本实验将第一轮PCR扩增的产物稀释50倍后作为模板,以NUP和NGSP为引物,进行巢式PCR扩增,经电泳检测获得了理想的条带。巢式PCR(nested PCR)是由普通PCR技术衍生出的一种新的PCR技术,在分子生物学理论研究与医学检测方面的研究应用比较多[7-10]。其原理为设计外、内两对特异性PCR引物,进行两轮PCR扩增。使用外侧引物进行首轮PCR。以得到的扩增产物为模板,使用内侧引物进行第二轮PCR来扩增所需目的片段[11]。另外需要指出的是,使用RACE技术获得新基因的末端片段时,需要尽可能多地选择阳性重组体进行测序,获得新基因全长序列的几率会更高。
参考文献
[1]张秀实,吴征镒.中国植物志:第23卷[M].北京:科学出版社,1998:49.
[2]李璐.桂木凝集素对BmDC分化成熟及对EL-4、Jurkat T细胞增殖的影响[D].南宁:广西医科大学,2013.
[3]刘小芹,罗育,曾麒燕.两种提取白桂木基因组DNA方法的比较研究[J].广西中医药大学学报,2014,17(2):71-72.
[4]邢桂春,张成岗,魏汉东,等.采用RACE技术获得全长人新基因MAGE-D1[J].中国生物化学与分子生物学报,2001,17(2):203-208.
[5]沈元月.RACE技术研究进展与展望[J].生物技术通报,2008(增刊):132-135.
[6]徐烨,刘雅婷,代文琼,等.几种主要的RACE技术及应用[J].中国农业科技导报,2012,14(2):81-87.
[7]Ledwidge S A,Mallard B A,Gibson J P,et al.Multi-primer target PCR for rapid identification of bovine DRB3 alleles [J].Animal genetics,2001,32(4):219-221.
[8]Navaneetham D,Penn A S,Howard Jr J F,et al.TCR-Vβ usage in the thymus and blood of myasthenia gravis patients [J].Journal of autoimmunity,1998,11(6):621-633.
[9]Atzori C,Agostoni F,Angeli E,et al.Combined use of blood and oropharyngeal samples for noninvasive diagnosis of Pneumocystiscarinii pneumonia using the polymerase chain reaction[J].European Journal of Clinical Microbiology and Infectious Diseases,1998,17(4):241-246.
[10]Yang J,Luo K,Guo Y,et al.Classification of genotyping hepatitis B virus with multiplex PCR[J].Zhonghuaganzangbingzazhi,2002,10(1):55-57.
[11]Porter-Jordan K,Rosenberg E I,Keiser J F,et al.Nested polymerase chain reaction assay for the detection of cytomegalovirus overcomes false positives caused by contaminationwithfragmentedDNA[J].Journalofmedicalvirology,1990,30(2):85-91.
(编辑陈明伟)
中图分类号:Q78
文献标识码:A
文章编号:2095-4441(2015)02-0067-05
收稿日期:2015-03-27
基金项目:国家自然科学基金(编号:81160366);广西自然科学基金(编号:2011jjA40535)通信作者:曾麒燕,E-mail:2257994291@qq.com

