三个小麦防御素基因的克隆及序列分析
史灵敏+张斌+丁汉凤

摘要:本试验从济麦22幼叶中克隆得到三个小麦防御素基因TaPDF(Triticum aestivum defensin),分别命名为TaPDF32、TaPDF33和TaPDF34(GenBank登录号分别为BT009185、BT009167和BT009022)。序列分析发现,三个防御素基因各自含有一个长度为243、249 bp和225 bp的开放阅读框 (open reading frame, ORF),依次编码长度为80、82个和74个氨基酸的蛋白。成熟蛋白的分子量均约为5.5 kD,等电点均大于7,含有8个保守的Cys残基。保守结构域分析发现,TaPDF32含有一个γ-硫堇功能结构域,TaPDF33和TaPDF34均含有一个Knot1功能结构域,两者均是植物防御素的典型结构域,因此这三个TaPDF属于典型的植物防御素蛋白。SWISS-MODEL在线软件分析表明,三个TaPDF的三级结构均由三股反平行的β-折叠和一个α-螺旋组成。系统进化分析表明,TaPDF32、TaPDF33的氨基酸序列与玉米、粟米的防御素相似性较高,而TaPDF34与大豆的防御素相似性较高,但均与已经报道的小麦防御素相似性较低,表明TaPDF32、TaPDF33和TaPDF34是小麦三个新的防御素蛋白。荧光定量RT-PCR分析发现,TaPDF32、TaPDF33基因在小麦叶片中表达量最高,种子次之,根中最低;TaPDF34基因在叶、种子和根中的表达量基本相同。
关键词:小麦;植物防御素;基因克隆;序列分析;组织特异性表达
中图分类号:S512.101 文献标识号:A 文章编号:1001-4942(2016)11-0001-08
Abstract Three Triticum aestivum defensin (TaPDF) genes, TaPDF32, TaPDF33 and TaPDF34 (GenBank accession No. BT009185, BT009167 and BT009022), were cloned from the young leaves of Jimai 22 cultivar. Sequence analysis showed that each had an open reading frame of 243, 249 bp and 225 bp, which encoded the proteins with 80, 82 and 74 amino acids respectively. The mature proteins, with the estimated molecular masses of all about 5.5 kD and the isoelectric points all higher than 7, each contained eight conservative cysteine residues. Conserved domain analysis found that TaPDF32 contained a strictly conserved gamma-thionin domain, while TaPDF33 and TaPDF34 each had a Knot1 function domain. Both of the domains are the typical characteristics of plant defensin. Thus, the three TaPDFs all belong to typical plant defensin proteins. Study of the three dimensional structure using SWISS-MODEL showed that all of them contained a triple-stranded anti-parallel β-sheet and an α-helix stabilized by four disulfide bridges. Phylogenetic analysis showed that TaPDF32 and TaPDF33 were close to defensins of Zea mays and Setaria italica, while TaPDF34 was close to Clycine max defensin. But they all owned low similarities with the other reported wheat defensins, which indicated that TaPDF32, TaPDF33 and TaPDF34 were three new wheat defensins. Real-time PCR analysis revealed that TaPDF32 and TaPDF33 genes had the highest expression level in leaves, followed by seeds, and the lowest level in roots. Whereas TaPDF34 expressed basically consistent in all tissues.
Keywords Triticum aestivum; Plant defensin; Gene cloning; Sequence analysis; Tissue-specific expression
植物防御素是植物天然防御系统的重要成员[1,2]。与昆虫和动物的抗细菌特性不同,植物防御素具有抵御真菌(如尖孢镰刀菌、大丽轮枝菌、灰葡萄孢菌和白色念珠菌等)感染的特性[1,3,4]。此外,植物防御素还受环境胁迫的诱导,如干旱[5,6]、寒冷[7,8]和信号分子(茉莉酸甲酯、乙烯和水杨酸)[9,10]等均可诱导防御素基因表达。植物防御素分子量约为5 kD,由45~50个氨基酸组成[11],其典型的三级结构是由一个α-螺旋和三股反平行的β-折叠构成的CSαβ模体结构,以8个保守的半胱氨酸残基形成4个分子内二硫键来稳定其三级结构[12,13]。大部分植物防御素含有4个二硫键,但是矮牵牛的防御素PhD1和PhD2含有10个半胱氨酸残基,形成5对二硫键[14,15]。尽管不同植物防御素的氨基酸序列差异很大,但其三级结构高度保守[16]。通过对其三维结构进行修饰或替换某个氨基酸可以改善其生物功能或赋予新的生物活性[17]。
植物防御素以前体蛋白的形式表达,根据其前体蛋白的结构特点可以分为两类,第一类含N端信号肽序列和C端成熟防御素结构域,通过粗面内质网经折叠后进入分泌途径;第二类比第一类多了一个C末端结构域,该结构域参与了防御素蛋白的液泡定位并在分泌途径中起保护细胞的作用[14]。研究发现,第二类植物防御素存在于茄科植物和禾本科植物中[14,18,19]。Peter等对来自花烟草的两类防御素进行研究后发现,第二类防御素比第一类防御素抗禾谷锈病真菌的效果更好[20]。
植物防御素在植物的各个器官中都有表达,但其表达模式各不相同。大部分拟南芥防御素类似基因DEFL在花序中表达,只有少数在根中表达;而蒺藜苜蓿DEFL主要在固氮根瘤中表达[21,22]。在观赏植物花烟草和矮牵牛花中,花朵发育的早期阶段防御素含量很高,花烟草NaD1的转录产物主要积累在花瓣、萼片、花药和花柱的最外层细胞,这与抵抗病原体、保护生殖器官的作用是一致的[14]。绿豆防御素基因VrCRP定位在种皮的薄壁细胞中[23];甘蓝防御素基因tags118在花中特异表达[24];而甜椒防御素基因主要在果实中特异表达[25]。萝卜防御素基因Rs-AFP1和Rs-AFP2主要在种子萌发时特异表达,而Rs-AFP3和Rs-AFP4在叶片受到病原菌感染时特异表达[26]。 综上所述,植物防御素主要在种子、花朵、果实、叶片等器官中表达,在豆科植物中主要在其根瘤处表达,这些都是易受病原菌感染而又非常重要的器官。
植物防御素具有广谱抗菌性[1,3,4],在植物抗病虫害基因工程中有重要的应用价值[1]。冬小麦中冷诱导防御素基因TAD1在小麦中过度表达可增强小麦对雪霉病和赤霉病的抗性[7,8]。将油菜中的防御素基因和几丁质酶基因在加拿大油菜中过表达提高了其对菌核病的抗性[27]。在水稻中持续表达萝卜防御素基因Rs-AFP2能够抑制稻瘟病菌和立枯丝核菌的生长[28]。除了天然的防御素,化学合成的防御素类似物也能表现出同样的作用。BTD-S是基于狒狒θ-防御素(BTD)设计合成的非环状θ-防御素类似物,将其转化到拟南芥中,可使转基因株系表现出对大丽轮枝菌的抗性[29]。此外,植物防御素还具有抑制离子通道、抑制蛋白合成、抑制胰蛋白酶和α-淀粉酶活性以及耐重金属的作用[30,31],还能调节植物的生长发育[32]和抑制癌细胞生长[33],表明植物防御素具有广阔的应用前景。
防御素有一个很大的基因家族。在蒺藜苜蓿和拟南芥中分别发现了300多个DEFL基因[34,35],而在水稻中仅发现了90多个DEFL基因[36],目前在NCBI核酸数据库中分别能够检索到17条和43条玉米及小麦的防御素序列,其中31条小麦防御素序列为本实验室提交。本研究基于GenBank中登录的小麦防御素序列,从济麦22幼叶中克隆了3个小麦防御素基因,经PCR扩增和测序验证无误后,对其进行了生物信息学分析和Real-Time PCR 组织特异性表达分析,为进一步的功能验证奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 试验材料为济麦22,种植于山东省农业科学院科研示范区。
1.1.2 试剂 植物总RNA提取试剂盒、凝胶回收试剂盒和质粒DNA提取试剂盒购自TIANGEN公司,反转录试剂盒为Fermentas产品,DNA聚合酶和T4 DNA 连接酶为TaKaRa产品,其他常规化学试剂均为国产分析纯。
1.1.3 载体及菌株 pEASY-T3克隆载体、大肠杆菌(Escherichia coil) Trans1-T1 Phage Resistant 化学感受态细胞均购于全式金。
1.1.4 引物的合成 基于GenBank登录号为BT009185(TaPDF32)、BT009167(TaPDF33)和BT009022(TaPDF34)的序列,利用Primer Premier 5.0 软件设计目的基因和小麦内参基因 β-Actin的特异性引物(表 1)。引物合成和测序由上海生工生物工程股份有限公司完成。
1.2 试验方法
1.2.1 小麦总RNA的提取、纯化及反转录 取适量济麦22的根、幼嫩叶片及种子,用TIANGEN植物总RNA提取试剂盒提取总RNA。按照 Fermentas 公司的反转录试剂盒操作步骤进行反转录,得到完整的cDNA。所有 cDNA 样品均存于 -20℃ 冰箱中备用。
1.2.2 TaPDF基因克隆 以小麦幼叶cDNA为模板,利用表1中的上下游引物分别克隆TaPDF32、TaPDF33和TaPDF34基因。PCR 扩增反应程序为: 95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,30 个循环;72℃终延伸 10 min。PCR 产物用1.0%琼脂糖凝胶电泳检测。将与目的基因大小一致的 PCR 产物回收,回收的目的片段连入pEASY-T3克隆载体并测序。
1.2.3 TaPDF蛋白生物信息学分析 利用NCBI数据库ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi) 在线分析获得TaPDF基因的开放阅读框。利用ProtParam(http://web.expasy.org/protparam/)在线程序计算TaPDF蛋白的理化参数。通过网站http://www.cbs.dtu.dk/services/上的在线软件SignalP 4.1、TMHMM 2.0和TargetP 1.1对目的蛋白进行信号肽、跨膜区及亚细胞定位分析。利用在线网站http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi对目的蛋白的保守结构域进行分析。利用在线软件SWISS-MODEL(http://swissmodel.expasy.org/)完成对目的蛋白三级结构预测。利用NCBI (http://www.ncbi.nlm.nih.gov/) 的在线工具BLASTP对目的蛋白的同源性进行比对分析。用在线软件ESPript3.0 (http://espript.ibcp.fr/ESPript/ESPript/index.php) 进行氨基酸序列的比对,并通过MEGA5.0软件中邻近相连法 (neighbor-joining, NJ) 构建系统发育树(bootstrap重复1 000次)。
1.2.4 实时定量PCR分析 取等量小麦各组织cDNA模板,依次稀释6个梯度,每个梯度稀释5倍,利用小麦内参基因β-Actin 及TaPDF基因的特异性引物进行扩增,每个反应设置3个重复,根据Bio-Rad iQ5荧光定量PCR仪上得到的Ct值绘制标准曲线,得到斜率K和线性相关系数r,根据公式E=5-1/K-1,计算得出扩增效率。荧光定量的步骤按照SYBR Premix Ex TaqTM说明书进行操作,反应体系含cDNA 50 ng,2×SYBR Premix Ex TaqTM 12.5 μL,10 μmol/L上下游引物各1 μL,加ddH2O至总体积为20 μL。扩增程序为:95℃预变性1 min;95℃变性10 s,56℃退火30 s,72℃延伸30 s,42个循环。反应结束应用Bio-Rad iQ5 软件分析扩增曲线及熔解曲线。2-ΔΔCt法[37]计算TaPDF基因在不同组织中的相对表达量。
2 结果与分析
2.1 TaPDF基因克隆
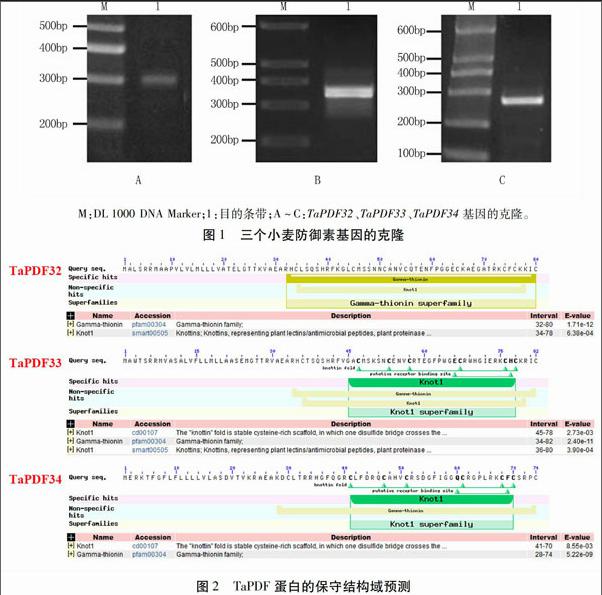
以济麦22幼叶cDNA为模板,用TaPDF基因特异性引物(表1)进行PCR扩增,得到三条扩增片段(图1)。经测序,扩增片段长度分别为313、335 bp和271 bp,与预期的扩增片段长度一致,分别命名为TaPDF32、TaPDF33和TaPDF34。三个基因各自含有一个长度为243、249 bp和225 bp的开放阅读框,其编码蛋白分别含有80、82和74个氨基酸。
2.2 TaPDF蛋白的信号肽与保守结构域分析
信号肽分析发现,TaPDF32、TaPDF33和TaPDF34蛋白N端均含有信号肽,长度分别为31、33个和27个氨基酸。通过预测三者的跨膜区发现,三者均不含跨膜区。TargetP 1.1软件分析发现,TaPDF32、TaPDF33、TaPDF34被定位到分泌途径,推测这三个TaPDF均为分泌型蛋白。
根据Smart软件预测TaPDF32、TaPDF33和TaPDF34蛋白的保守结构域,发现TaPDF32含有植物防御素特有的γ-硫堇蛋白结构域,属于γ-硫堇超蛋白家族;TaPDF33和TaPDF34具有Knot1结构域,属于Knot1超蛋白家族(图2),两者均是植物防御素的典型结构域,因此这三个TaPDF属于典型的植物防御素蛋白。
2.3 成熟TaPDF蛋白的基本特性分析
利用ProtParam软件对3个去除信号肽的成熟TaPDF蛋白序列进行基本特性分析,结果显示三者均是含有8个半胱氨酸的阳离子肽,分别由49、49个和47个氨基酸组成,分子量均约为5.5 kD,等电点分别为8.92、8.95和9.37,都是碱性、亲水的不稳定蛋白。
2.4 TaPDF蛋白的三级结构预测
利用软件SWISS-MODEL对3个小麦防御素进行蛋白三级结构预测,结果显示,三者均含有植物防御素所特有的1个α-螺旋和3股反向平行的β-折叠片层结构,与其它物种防御素蛋白的三级结构相似。
2.5 TaPDF蛋白序列比对
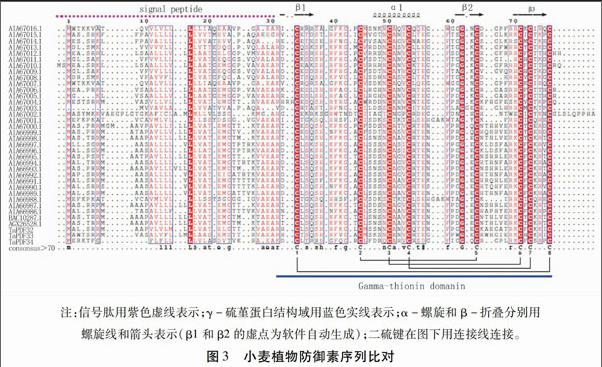
利用ESPript软件对本研究获得的3个小麦防御素蛋白序列与GenBank中本实验室提交的31条小麦防御素序列(登录号:AIA66986.1~AIA67016.1)和另外2条小麦防御素序列(登录号:BAC10287.1和AGX26528.1)进行序列比对。结果如图3所示,小麦防御素家族的蛋白序列差异很大,仅信号肽序列的亮氨酸、γ-硫堇蛋白结构域的8个半胱氨酸和1个甘氨酸是完全保守的,其他氨基酸均存在一定的差异。8个半胱氨酸形成的二硫键以Cys1-Cys8、Cys2-Cys5、Cys3-Cys6和Cys4-Cys7的方式连接,稳定其三级结构。
2.6 系统进化树分析
将3个TaPDF分别在NCBI上进行BLASTP,检索到序列相似性较高的植物防御素进行系统进化树分析。利用MEGA5.0软件邻近法构建系统进化树(图4)。本研究获得的三个TaPDF分别位于进化树的不同分支上,且与大部分的小麦防御素不在同一支上,仅TaPDF33与另一个小麦防御素及粟米等的防御素聚为一支;而TaPDF32和玉米、粟米等的防御素聚为一支;TaPDF34则与豆科和茄科等的防御素聚成一支。说明TaPDF32~34与已经提交的小麦防御素序列具有较低的相似性,为小麦防御素家族的新成员。
2.7 TaPDF基因的组织特异性表达分析
为研究三个TaPDF基因在小麦不同器官中的表达差异,以济麦22幼嫩叶片、种子和根的cDNA为模板,以小麦β-Actin为内参基因进行荧光定量RT-PCR分析。结果表明,内参基因β-Actin和TaPDF 基因引物的扩增效率在95.0%~105.0%之间,符合qRT-PCR对扩增效率要求;荧光定量的熔解曲线峰单一,判断无杂带。由图5可知,TaPDF32和TaPDF33在叶中的表达量最高,种子次之,根最少,但种子和根中差异不明显;TaPDF34在叶、种子和根中的表达量基本相同。
3 讨论与结论
第一个植物防御素基因是1990年从小麦[38]和大麦[39]的胚乳中分离出来的,最初被归类为γ-硫堇家族,后来随着新的植物γ-硫堇类似蛋白的鉴定,发现了γ-硫堇与传统硫堇蛋白之间在结构上存在差异[26,40],又因为其与哺乳动物和昆虫的防御素蛋白结构与功能类似,所以将其重新命名为“植物防御素”[26]。2005年,Egorov等利用三步高效液相层析法在六倍体小麦 (T. kiharae) 种子中发现了24个新的小麦抗菌肽,其中11个属于植物防御素,并根据N端序列的同源性分成三个亚组,6个Tk-AMP-D肽属于第一组(D组),Tk-AMP-γ1、Tk-AMP-γ2和Tk-AMP-γ3属于第二组,Tk-AMP-ω2和Tk-AMP-ω3属于第三组[41]。2007年,Odintsova等[42]通过组合色谱的方法又在T. kiharae种子中发现了两个属于D组的防御素,因与D1和D6共洗脱下来,将其分别命名为D1.1和D1.6,两次试验共鉴定出8个D组防御素基因。同时,他们发现普通小麦也含有全部的D组防御素基因。氨基酸序列比较分析发现,D组防御素具有很高的序列同源性(尤其是N端),但是C端保守结构域的Cys6和Cys7之间的部分氨基酸的突变和插入缺失引起了氨基酸序列及长度的多态性。本试验通过对获得的3个TaPDF蛋白与NCBI数据库中已知的33条TaPDF序列比对发现,在保守结构域的Cys6和Cys7之间也存在氨基酸的插入缺失现象,其中3条TaPDF在保守结构域的Cys1与Cys2以及Cys4与Cys5之间也出现个别氨基酸的插入。
基因的多样性可以由古老基因的点突变和插入缺失引起[43],Wu等对几种禾本科植物的防御素类似基因的进化进行了分析,结果发现,玉米、水稻、高粱和二穗短柄草中片段重复和串联重复推动了防御素类似基因进化过程,然而,4个物种的7个防御素类似基因在进化过程中是高度保守的[44]。TaPDF在进化过程中可能也会发生基因重排、串联重复、插入和缺失等情况从而导致TaPDF多样性[41,42]。本试验得到的三个TaPDF蛋白与已知的TaPDF序列差异较大,仅信号肽序列的亮氨酸、γ-硫堇蛋白结构域的8个半胱氨酸和1个甘氨酸是完全保守的。对小麦及其他物种的防御素蛋白构建进化树,发现部分TaPDF聚为一支,而TaPDF32~34则位于另外的三个不同分支上,表明其与其它TaPDF具有不同之处。
植物防御素主要在种子、花朵、果实、叶片等器官中表达,而这些都是易受病原菌感染而又非常重要的器官。绿豆VrCRP、甜椒PDF和萝卜Rs-AFP1和Rs-AFP2主要在果实和种子中表达[23, 25, 26],花烟草NaD1、矮牵牛花PhD1和甘蓝tags118则主要在花中表达[14,24]。通过荧光定量RT-PCR对TaPDF32~34进行组织特异性分析,发现TaPDF32和TaPDF33均在叶片中表达量高,在种子和根中表达量比较低;而TaPDF34在叶片、种子和根中的表达量基本一致。
参 考 文 献:
[1] Lay F T, Anderson M A. Defensins-components of the innate immune system in plants[J]. Current Protein & Peptide Science, 2005, 6(1):85-101.
[2] Benko-Iseppon A M, Galdino S L, Calsa T Jr, et al. Overview on plant antimicrobial peptides[J]. Current Protein & Peptide Science, 2010, 11(3):181-188.
[3] Wong J H, Xia L, Ng T B. A review of defensins of diverse origins[J]. Current Protein & Peptide Science, 2007, 8(5):446-459.
[4] Osborn R W, Samblanx G W D, Thevissen K, et al. Isolation and characterisation of plant defensins from seeds of Asteraceae, Fabaceae, Hippocastanaceae and Saxifragaceae[J]. FEBS Letters, 1995, 368(2):257-262.
[5] Maitra N, Cushman J C. Isolation and characterization of a drought-induced soybean cDNA encoding a D95 family late-embryogenesis-abundant protein[J]. Plant Physiology, 1994, 106(2):805-806.
[6] Maitra N, Cushman J C. Characterization of a drought-induced soybean cDNA encoding a plant defensin[J]. Plant Physiol., 1998, 118:1536.
[7] Gaudet D A, Laroche A, Frick M, et al. Cold induced expression of plant defensin and lipid transfer protein transcripts in winter wheat[J]. Physiologia Plantarum, 2003, 117(2):195-205.
[8] Sasaki K, Kuwabara C, Umeki N, et al. The cold-induced defensin TAD1 confers resistance against snow mold and Fusarium head blight in transgenic wheat[J]. Journal of Biotechnology, 2016, 228:3-7.
[9] Manners J M, Penninckx I A M A, Vermaere K, et al. The promoter of the plant defensin gene PDF1.2 from Arabidopsis is systemically activated by fungal pathogens and responds to methyl jasmonate but not to salicylic acid[J]. Journal of the American College of Cardiology, 1998, 38(6):1071-1080.
[10]Hanks J N, Snyder A K, Graham M A, et al. Defensin gene family in Medicago truncatula: structure, expression and induction by signal molecules[J]. Plant Molecular Biology, 2005, 58(3):385-399.
[11]Vriens K, Cammue B P, Thevissen K. Antifungal plant defensins: mechanisms of action and production[J]. Molecules, 2014, 19(8):12280-12303.
[12]Fant F, Vranken W, Broekaert W, et al. Determination of the three-dimensional solution structure of Raphanus sativus antifungal protein 1 by H-1 NMR[J]. Journal of Molecular Biology, 1998, 279(1):257-270.
[13]Bruix M, Santoro J S F, Rocher A, et al. H-1-nmr studies on the structure of a new thionin from barley endosperm[J]. Biopolymers, 1995, 36(6):751-763.
[14]Lay F T, Brugliera F, Anderson M A. Isolation and properties of floral defensins from ornamental tobacco and petunia[J]. Plant Physiol., 2003, 131(3):1283-1293.
[15]Janssen B J, Schirra H J, Lay F T, et al. Structure of Petunia hybrida defensin 1, a novel plant defensin with five disulfide bonds[J]. Biochemistry, 2003, 42(27):8214-8222.
[16]Pelegrini P B, Franco O L. Plant γ-thionins: novel insights on the mechanism of action of a multi-functional class of defense proteins[J]. International Journal of Biochemistry & Cell Biology, 2005, 37(11):2239-2253.
[17]Carvalho A O, Gomes V M. Plant defensins and defensin-like peptides-biological activities and biotechnological applications[J]. Current Pharmaceutical Design, 2011, 17(38):4270-4293.
[18]Bohlmann H. The role of thionins in plant protection[J]. Critical Reviews in Plant Sciences, 1994, 13(1):1-16.
[19]Romero A, Alamillo J M, García-Olmedo F. Processing of thionin precursors in barley leaves by a vacuolar proteinase[J]. European Journal of Biochemistry, 1997, 243(1-2):202-208.
[20]Dracatos P M, Weerden N L V D, Carroll K T, et al. Inhibition of cereal rust fungi by both class Ⅰ and Ⅱ defensins derived from the flowers of Nicotiana alata[J]. Molecular Plant Pathology, 2014, 15(1):67-79.
[21]Nallu S, Silverstein K A, Samac D A, et al. Regulatory patterns of a large family of defensin-like genes expressed in nodules of Medicago truncatula[J]. PLoS ONE, 2013, 8(4):e60355.
[22]Tesfaye M, Silverstein K A, Nallu S, et al. Spatio-temporal expression patterns of Arabidopsis thaliana and Medicago truncatula defensin-like genes[J]. PLoS ONE, 2013, 8(3):e58992.
[23]Chen K C, Lin C Y, Chung M C, et al. Cloning and characterization of a cDNA encoding an antimicrobial protein from mung bean seeds[J]. Botanical Bulletin of Academia Sinica, 2002, 43(4):251-259.
[24]Jung B G, Choi Y O, Lee K O, et al. Molecular cloning and characterization of a flower-specific thionin in Chinese cabbage[J]. Bmb. Reports, 2001, 34(3):201-205.
[25]Meyer B, Houlné G, Pozueta-Romero J, et al. Fruit-specific expression of a defensin-type gene family in bell pepper. Upregulation during ripening and upon wounding[J]. Plant Physiology, 1996, 112(2):615-622.
[26]Terras F R, Eggermont K, Kovaleva V, et al. Small cysteine-rich antifungal proteins from radish—their role in host defense[J]. Plant Cell, 1995, 7(5):573-588.
[27]Zarinpanjeh N, Motallebi M, Zamani M R, et al. Enhanced resistance to Sclerotinia sclerotiorum in Brassica napus by co-expression of defensin and chimeric chitinase genes[J]. Journal of Applied Genetics, 2016:57(4):417-425.
[28]Jha S, Chattoo B B. Expression of a plant defensin in rice confers resistance to fungal phytopathogens[J]. Transgenic Research, 2010, 19(3):373-384.
[29]Li F, Shen H, Wang M, et al. A synthetic antimicrobial peptide BTD-S expressed in Arabidopsis thaliana confers enhanced resistance to Verticillium dahliae[J]. Molecular Genetics and Genomics, 2016, 291(4):1647-1661.
[30]Zhang N, Jones B L, Tao H P. Purification and characterization of a new class of insect alpha-amylase inhibitors from barley[J]. Journal of Comparative Neurology, 1997, 74(2):119-122.
[31]Mirouze M, Sels J, Richard O, et al. A putative novel role for plant defensins: a defensin from the zinc hyper-accumulating plant, Arabidopsis halleri, confers zinc tolerance[J]. Plant Journal, 2006, 47(3):329-342.
[32]Allen A, Snyder A K, Preuss M, et al. Plant defensins and virally encoded fungal toxin KP4 inhibit plant root growth[J]. Planta, 2008, 227(2):331-339.
[33]Aerts A M, Franois I E J A, Meert E M K, et al. The antifungal activity of RsAFP2, a plant defensin from Raphanus sativus, involves the induction of reactive oxygen species in Candida albicans[J]. Journal of Molecular Microbiology & Biotechnology, 2007, 13(4):243-247.
[34]Michelle A G, Kevin A T S, Steven B C, et al. Computational identification and characterization of novel genes from Legumes[J]. Plant Physiology, 2004, 135(3):1179-1197.
[35]Silverstein K A, Graham M A, Paape T D, et al. Genome organization of more than 300 defensin-like genes in Arabidopsis[J]. Plant Physiol., 2005, 138(2):600-610.
[36]Silverstein K A T, Moskal W A, Wu H C, et al. Small cysteine-rich peptides resembling antimicrobial peptides have been under-predicted in plants[J]. Plant Journal for Cell & Molecular Biology, 2007, 51(2):262-280.
[37]Yu M, Clark M, Kim S H, et al. Pre-clinical validation of a novel, highly sensitive assay to detect PML-RARx mRNA using real-time reverse-transcription polymerase chain reaction[J]. Journal of Molecular Diagnostics, 2001, 3(4):141-149
[38]Colilla F J, Rocher A, Mendez E. γ-Purothionins: amino acid sequence of two polypeptides of a new family of thionins from wheat endosperm[J]. FEBS Letters, 1990, 270(1/2):191-194.
[39]Persson P, Ehmke H, Kirchheim H. Primary structure and inhibition of protein synthesis in eukaryotic cell-free system of a novel thionin, γ-hordothionin, from barley endosperm[J]. European Journal of Biochemistry, 1990, 194(2):533-539.
[40]Bruix M, Jiménez M A, Santoro J, et al. Solution structure of gamma 1-H and gamma 1-P thionins from barley and wheat endosperm determined by 1H-NMR: a structural motif common to toxic arthropod proteins[J]. Biochemistry, 1993, 32(2):715-724.
[41]Egorov T A, Odintsova T I, Pukhalsky V A, et al. Diversity of wheat anti-microbial peptides[J]. Peptides, 2005, 26(11):2064-2073.
[42]Odintsova T I, Egorov T A, Musolyamov A K, et al. Seed defensins from T. kiharae, and related species: genome localization of defensin-encoding genes[J]. Biochimie, 2007, 89(5):605-612.
[43]Bowers J E, Chapman B A, Rong J, et al. Unravelling angiosperm genome evolution by phylogenetic analysis of chromosomal duplication events[J]. Nature, 2003, 422(6930):433-438.
[44]Wu J, Jin X, Zhao Y, et al. Evolution of the defensin-like gene family in grass genomes[J]. Journal of Genetics, 2016, 95(1):1-10.

