体外定向诱导小鼠胰腺干细胞分化形成胰岛样结构
吴丽情,寇亚丽,赵文婧,吴 卓,徐亦辰,陈维平*
(1.广西医科大学 组织胚胎学教研室, 广西 南宁 530021;2.广西卫生职业技术学院人体形态学教研室, 广西 南宁 530023)
研究论文
体外定向诱导小鼠胰腺干细胞分化形成胰岛样结构
吴丽情1,寇亚丽2,赵文婧1,吴 卓1,徐亦辰1,陈维平1*
(1.广西医科大学 组织胚胎学教研室, 广西 南宁 530021;2.广西卫生职业技术学院人体形态学教研室, 广西 南宁 530023)
目的体外探讨胰腺干细胞形成胰岛样结构并对其进行相关检测,探寻胰腺干细胞分化为胰岛样结构可行性及初步鉴定的技术方法。方法从新生小鼠胰腺组织中通过原位传代扩增培养获得富足数量PSC,以尼克酰胺定向诱导PSC,观察细胞的形态变化、形成的细胞团双硫腙染色、免疫荧光组织化学染色及Mallory染色鉴定。结果PSC集落分布,细胞为单个大核、胞质折光透亮,巢蛋白(nestin)及碱性磷酸酶(AKP)染色阳性;诱导后聚集成团,最终形成具被膜包裹的细胞团;双硫腙染色阳性,胰岛素免疫荧光染色可见胞质被激发出绿色荧光的胰岛素阳性细胞;细胞团中央β样细胞及周围α样细胞,形成类似正常胰岛细胞组成的胰岛样结构。结论胰腺干细胞在适宜条件下可定向分化,形成胰岛样结构。
胰腺干细胞;体外培养;定向诱导;胰岛样结构
目前,体外诱导干细胞形成胰岛素分泌细胞是细胞组织工程中在糖尿病方向的研究热点,主要途径有:1)转录胰岛发育的关键基因(如PDX、Ngn3和Mafa等);2)或者加入化学试剂(小分子、生长因子),模拟胰腺发育的营养因子微环境,诱导多能干细胞分化为胰岛细胞团[1- 2]。胰腺干细胞(pancreas stem cell, PSC)是从胰腺组织中获取的一类具有多向分化潜能的干细胞,可产生表现型和基因型与自身相同的子细胞,是体外诱导分化形成胰岛细胞的良好种子干细胞。本实验以原位传代扩增培养的方法获得富足数量的胰腺干细胞;以含有尼克酰胺的高糖诱导液定向诱导PSC,最终形成包含α样与β样两种胰岛样细胞组成并且有完整被膜包裹的胰岛样结构。
1 材料与方法
1.1 实验动物
SPF级新生昆明小鼠,雌雄不限,体质量5~10 g(广西医科大学实验动物中心,实验动物合格证号:scxk桂2009- 0002)。
1.2 主要试剂
高糖DMEM 培养基、胎牛血清(Hycolne公司);即用型 SP 超敏试剂盒(鼠)、即用型鼠抗人Nestin单克隆抗体、碱性磷酸酶试剂盒(福州迈新公司);尼克酰胺(北京 Solarbio公司);双硫腙(天津科密欧化学试剂公司); 焰红(上海晶纯试剂有限公司);4%多聚甲醛、乙醇、甲酰胺为国产分析纯试剂。
1.3 诱导液配制
取12.213 g尼克酰胺溶于100 mL三蒸水,配成1 mol/L的浓度。高糖DMEM诱导培养液内包括体积分数10%胎牛血清(fetal bovine serum, FBS)、100 U/mL青霉素、0.1 g/L链霉素、10 mmol/L尼克酰胺。
1.4 PSC细胞系的建立
1.4.1 PSC分离培养:给小鼠腹腔注射2%戊巴比妥钠水溶液麻醉,无菌条件下分离胰腺,置于D-hanks’缓冲液中弯剪剪碎,Ⅳ型胶原酶37℃水浴消化15 min,终止消化后轻柔吹打静置5 min,吸取上层细胞悬液1 000 r/min离心5 min,以体积分数10%胎牛血清的高糖DMEM液重悬细胞,调整细胞105个/mL,37 ℃、5% CO2培养箱内培养;24 h后全量换液,培养3 d后换为无血清高糖DMEM液培养。原代培养3~4 d,成纤维细胞中出现一类形态均一、折光透亮的球形细胞,加入0.02% EDTA消化部分成纤维细胞,待少许细胞漂浮,终止消化后继续高糖DMEM液培养;球形细胞缓慢增殖后可重复上述操作。
1.4.2 PSC鉴定:1)PSC-nestin鉴定:弃去培养液,PBS洗3次,4%多聚甲醛固定20 min;加入过氧化酶阻断剂孵育10 min;0.3% TritonX- 100孵育20 min,对抗原进行修复; PBS漂洗后加非免疫血清(羊)孵育10 min,封闭电荷基团、排除非特异性着色(勿洗),加入即用型鼠抗人Nestin抗体孵育2 h,羊抗鼠IgG二抗孵育30 min,漂洗后加入链霉素抗生物素蛋白-过氧化酶溶液,漂洗后加入酶反应底物(DAB),5 min后观察PSC着色情况。2)PSC-AKP鉴定:吸去培养液,PBS洗3次,固定液固定3 min,加入2 mL配制的底物应用液,37 ℃避光孵育15 min,PBS洗涤数次后苏木精复染3 min,蒸馏水漂洗后镜下观察细胞。
1.5 PSC的定向诱导
1.5.1 诱导方法:将胰腺干细胞种植于预先涂布多聚耐氨酸的孔板中。诱导组:将培养液更换为预先配制好的诱导液(含体积分数10% FBS、10 mmol/L尼克酰胺、25 mmol/L高糖浓度H-DMEM培养液);对照组:继续予高糖DMEM培养液(含体积分数10% FBS、25 mmol/L高糖浓度H-DMEM培养液)培养;连续培养4周。
1.5.2 胰岛样结构鉴定:1)双硫腙染色:吸去培养液,PBS漂洗3次,每次2 min;加入4%多聚甲醛固定20 min;吸除固定液后加入PBS漂洗去残留固定液;加入已配置的双硫腙染液(10 mg DTZ加入1 mL DMSO溶解配成储备液,取0.1 mL存储液溶于10 mL PBS配成工作液,现配现用),染色15 min;PBS漂洗后倒置显微镜观察并拍照。 2)胰岛素免疫荧光化学染色:培养瓶中形成完整被膜包裹的细胞团后,加入胰蛋白酶消化,悬液转移至离心管1 000 r/min, 离心5 min;将收集的细胞团侵入10%中性甲醛固定过夜;乙醇溶液各浓度(75%、85%、95%、100%)梯度脱水各30 min,二甲苯Ⅰ、Ⅱ各透明30 min;再进行浸蜡、包埋、切片。制成的石蜡切片经二甲苯I、II脱蜡,乙醇溶液顺次复水5 min中,蒸馏水漂洗去除表面残余乙醇。滴加过氧化物酶阻断剂室温孵育10 min,封闭内源性过氧化;PBS洗涤3次;加入0.3% Triton- 100抗原修复,于37 ℃孵育20 min;PBS漂洗后加入非免疫血清(羊)封闭非特异性着色,37 ℃孵育10 min(勿洗);滴加1∶100鼠抗人胰岛素抗体37 ℃孵育2 h;漂洗后滴加1∶100 FTTC标记羊抗鼠IgG二抗抗体,37 ℃避光孵育1 h;PBS漂洗后滴加甘油后覆盖玻片,倒置显微镜下观察。 3)Mallory染色:弃去瓶内培养液,PBS漂洗后加4%多聚甲醛37 ℃固定20 min;弃去固定液后PBS洗涤3次;加入2 mL焰红-甲苯胺蓝-橘黄G混合液(焰红4.0 g、甲)苯胺蓝2.5 g、橘黄G 2.5 g、磷钼酸2.5 g、蒸馏水100 mL),染色10 min;PBS漂洗后显微镜下观察细胞团染色情况。
2 结果
2.1 PSC扩增培养及鉴定
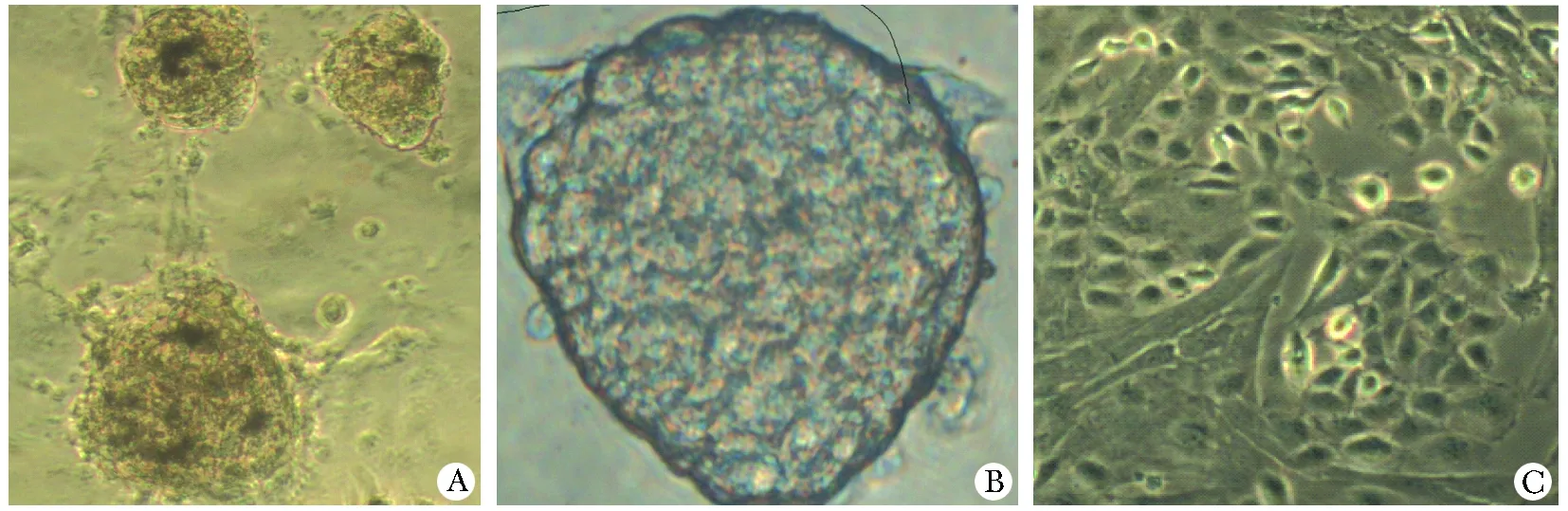
原代培养24 h,瓶内可见贴壁的成纤维细胞。培养3~4 d,成纤维细胞汇合度达到瓶底面积70%~80%,在其周围出现一类单个大核、折光性强、贴壁增殖的球形细胞。加入EDTA消化部分成纤维细胞,显微镜下观察见成纤维细胞连接松脱、断裂、缩短后漂起,许多球形细胞仍贴壁牢固。原瓶继续培养48 h,可见球形细胞 “串样”“对称”扩增分裂象(图1A);通过消减成纤维细胞的比例及数量,球形细胞表现出活跃的增殖能力,与成纤维细胞呈现共生现象。对扩增后细胞进行nestin检测,可见细胞胞质棕黄色阳性染色(图1B);AKP染色可见细胞染为蓝黑色,核单个、大、圆,具有低分化特性(图1C)。
2.2 胰岛样结构特点
2.2.1 诱导后PSC形态变化规律:诱导组:PSC逐渐聚拢,诱导7 d,胰腺干细胞汇聚成团;随着诱导时间的增加,细胞团数量增多、体积增大,诱导21 d,镜下可观察到有完整被膜包裹的细胞团(图2A,B)。对照组:胰腺干细胞数量随着时间的延长逐渐减少,形态上由原来立体感强的球形,逐渐变为扁平、折光性降低(图2C)。
2.2.2 双硫腙染色:诱导组诱导后形成的细胞团可见DTZ染色成红色;而周围细胞染色阴性,未见着色(图3A)。
2.2.3 胰岛素免疫荧光细胞化学染色: 诱导组中形成的细胞团制成石蜡切片,行胰岛素免疫荧光化学染色,以FITC标记的IgG为二抗,波长520~530 nm紫外光线的激发下,切片中可见散在的、发出绿色荧光的胰岛素阳性细胞(图3B)。
2.2.4 Mallory染色:β样细胞呈淡黄色, 聚集于细胞团中央;α样细胞染红色,位于细胞团周围(图3C)。与正常胰岛Mallory染色相近(β细胞聚集位于胰岛中部,体积较小,胞质着橘黄色;α细胞体积较大,多分布于胰岛外周,胞质着鲜红色)。

A.the amplificated pancreatic stem cells after reducing the proportion and quantity of fibroblast-cell(×20); B.nestin expressions of pancreatic stem cells(×10), black arrows indicate nestin positive cells; C.alkaline phosphatase staining of pancreatic stem cells(×40)
图1 PSC扩增培养及鉴定
Fig 1 Characteristics of amplificated pancreatic stem cells and nestin and alkaline phosphatase staining
A.pancreatic stem cells formed into multiple cell mass(×10); B.islet-like clusters packed with intact membrane in the induction group(×20); C.pancreatic stem cells did not from into islet-like clusters in the control group(×20)
图2 胰腺干细胞在诱导组与对照组内的细胞形态特征
Fig 2 Characteristics of pancreatic stem cells in the induction group and control group
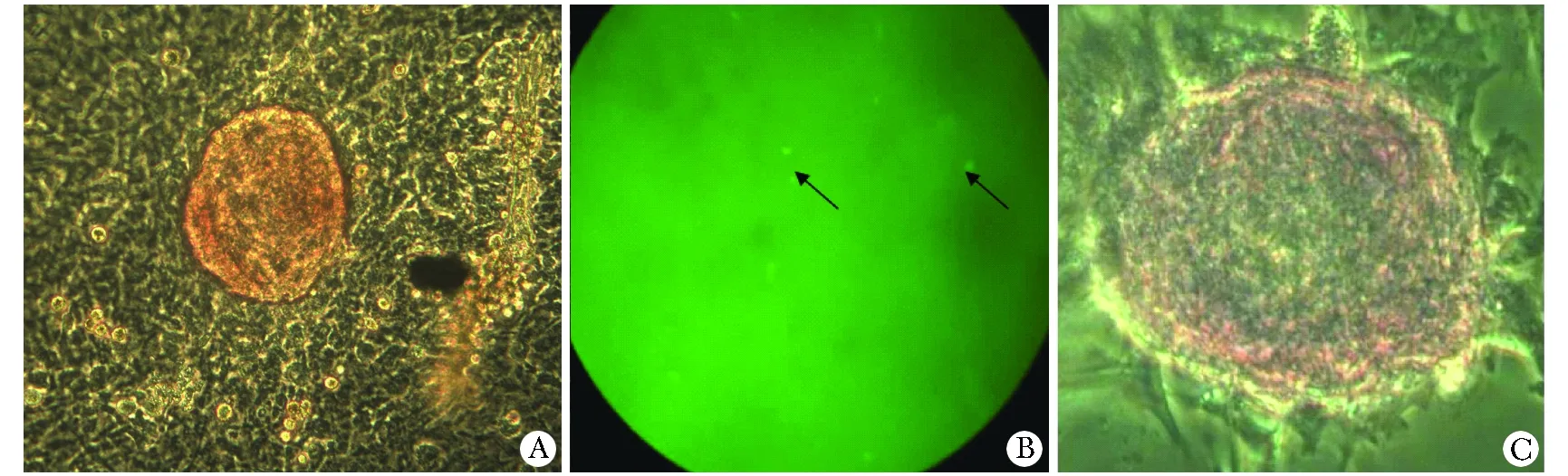
A.islet-like cell clusters present positve with dithizone staining (×20); B.insulin-producing cells of green fluorescence(×10), black arrows indicate insulin positive cells; C.Mallory staining of islet-like clusters (×20)
图3 胰岛样结构初步鉴定
Fig 3 Preliminary identification of islet-like structures with dithizone dyeing, immunohistochemistry staining and Mallory dyeing
3 讨论
随着对干细胞的深入研究,已开展体外诱导形成具功能的胰岛用于临床,但形成的胰岛样细胞团释放胰岛素水平低、葡萄糖刺激敏感性差等一直是困扰移植治疗的症结所在。构建胰岛样结构可能是体内移植突破的关键因素[3],胰岛样结构由β及非β内分泌细胞组成,细胞团表面有被膜包裹[4],多数学者体外途径获得的胰岛样细胞团已具备了分泌胰岛素的功能[5- 6],而在探讨形成胰岛样细胞团的组成结构上却少有报道。
PSC是胰腺组织来源于的多能干细胞,具有自我更新及多向分化潜能的特性,相比较其他成体干细胞诱导为胰岛更直接,可自体移植、避免排斥反应等优势。尼克酰胺是ADP-核糖合成酶抑制剂,促进胰岛细胞增殖及成熟[7],抑制去乙酰化酶活性,具有抗氧化及阻止β细胞糖脂毒性[8],是诱导干细胞向胰岛方向分化的常用化学试剂。高糖环境改变细胞膜离子的通道的状态启动干细胞向胰岛方向分化,血糖浓度在20~30 mmol/L刺激β细胞增殖,促进胰岛素的分泌、储存及释放[9]。诱导液中25 mmol/L葡萄糖环境启动胰腺干细胞的分化、促进细胞团的成熟;尼克酰胺维持了细胞的葡萄糖敏感性,也作为促分化剂促进细胞成团。
诱导后PSC逐渐聚拢成团,随着诱导时间的推移,细胞团增大,诱导21 d形成有完整被膜包裹的细胞团。双硫腙为螯合指示剂,与胰岛细胞胞质颗粒内锌离子螯合显色呈猩红色,是鉴定胰岛的筛选指标。细胞团DTZ染色呈红色,与正常胰岛DTZ相比染色浅,表明细胞胞质锌离子不及正常胰岛丰富。以胰岛素免疫荧光细胞化学染色了解细胞团内β样细胞的情况,见细胞团内散在分布发出绿色荧光的胰岛素阳性细胞,提示诱导形成的细胞团内存在胰岛样细胞,而细胞数量少,荧光细胞分布散在;分泌锌离子是各类胰岛细胞的代谢特点,细胞团双硫腙染色后大部分着色,并不是胰岛素分泌细胞的特性,考虑细胞团内存在其他胰岛细胞。运用Mallory三色法可区分胰岛内α、β、D不同胰岛细胞[10],胰岛样细胞团经Mallory染色后可见淡黄色的β样细胞位于细胞团的中央位置,红色α样细胞分布于细胞团周围,表面有结缔组织的被膜包裹。但实验诱导形成的胰岛样结构内,β样细胞、α样细胞数量较少。
本实验通过一种简单的定向诱导方法证实胰腺干细胞可分化形成初步的胰岛样结构。据报道,胰岛样结构对β细胞分泌胰岛素有积极的作用,α细胞通过分泌胰高血糖素肽GLP- 1促进胰岛素基因的转录,从而增加胰岛素的分泌,还可以保护胰岛β细胞内分泌功能[11- 12];体内移植实验也发现,缺乏α细胞的胰岛移植的胰岛素释放水平比完整的胰岛移植低,生存时间也显著降低[13]。
综上所述,以尼克酰胺定向诱导PSC,可形成具被膜包裹的胰岛样结构,其内部可见β样、α样细胞;在细胞构成比例及分泌功能上,胰岛样结构与正常胰岛结构存在差距,推测与微环境和(或)功能发育的促进有关。
[1] Kim HS, Hong SH, Oh SH,etal. Activin A, exendin- 4, and glucose stimulate differentiation of human pancreatic ductal cells [J]. Endocrinol,2013, 217:241- 252.
[2] Kunisada Y, Tsubooka-Yamazoe N, Shoji M,etal. Small molecules induce efficient differentiation into insulin-producing cells from human induced pluripotent stem cells[J].Stem Cell Res,2012,8:274- 284.
[3] Lumelsky N, Blondel O, Laeng P,etal. Differentiation of embryonic stem cells to insulin-secreting structures similar to pancreatic islets[J].Science,2001,292:1389- 1394.
[4] Bonner-Weir S, Taneja M, Weir GC,etal.Invitrocultivation of human islets from expanded ductal tissue[J].Proc Natl Acad Sci U S A, 2000,97:7999- 8004.
[5] Schiesser JV, Wells JM. Generation of beta cells from human pluripotent stem cells: are we there yet?[J]. Ann N Y Acad Sci,2014,1311:124- 137.
[6] Kadam S, Muthyala S, Nair P,etal. Human placenta-derived mesenchymal stem cells and islet-like cell clusters generated from these cells as a novel source for stem cell therapy in diabetes[J].Rev Diabet Stud,2010,7:168- 182.
[7] Lee SJ, Choi SE, Jung IR,etal. Protective effect of nicotinamide on high glucose/palmitate-induced glucolipotoxicity to INS- 1 beta cells is attributed to its inhibitory activity to sirtuins[J].Arch Biochem Biophys,2013,535:187- 196.
[8] Yang SJ, Choi JM, Kim L,etal. Nicotinamide improves glucose metabolism and affects the hepatic NAD-sirtuin pathway in a rodent model of obesity and type 2 diabetes[J]. Nutr Biochem,2014, 25:66- 72.
[9] Cao LZ, Tang DQ, Horb ME,etal. High glucose is necessary for complete maturation of Pdx1-VP16-expressing hepatic cells into functional insulin-producing cells[J].Diabetes,2004,53:3168- 3178.
[10] 柳洁, 张雪梅, 李莉.Mallory氏胰岛细胞染色法的改良[J].现代生物医学进展,2007,7:1888- 1889.
[11] Fukami A, Seino Y, Ozaki N,etal. Ectopic expression of GIP in pancreatic beta-cells maintains enhanced insulin secretion in mice with complete absence of proglucagon-derived peptides[J].Diabetes,2013,62:510- 518.
[12] Marchetti P, Lupi R, Bugliani M,etal. A local glucagon-like peptide 1 (GLP- 1) system in human pancreatic islets[J].Diabetologia,2012,55:3262- 3272.
[13] Wang H Zhang W, Cai H,etal. alpha-cell loss from islet impairs its insulin secretioninvitroandinvivo[J].Islets,2011,3:58- 65.
Directional induction of mouse pancreatic stem cells into islet-like structuresinvitro
WU Li-qing1, KOU Ya-li2, ZHAO Wen-jing1, WU Zhuo1, XU Yi-chen1, CHEN Wei-ping1*
(1.Dept. of Histology and Embryology, Guangxi Medical University, Nanning 530021; 2.Dept. of Human Morphology, Guangxi Medical College,Nanning 530023, China)
Objective To explore the method of induction of pancreatic stem cells into islet-like structures. Methods To collect and observe the morphological changes of pancreas stem cells after nicotinamide induction. The cell clusters were preformed with morphological observation, dithizone dyeing, Mallory dyeing and immunohistochemistry staining. Results The pancreas stem cells showed in colony distribution, with single big nuclear, refraction shining brilliantly, morphology was stable, nestin and AKP were both positive. After induction, the pancreatic stem cells gathered together and formed cell clusters, packed with intact membrane. The cells in the structures were positive for DTZ staining. With FITC tagging the insulin antibodies, the cells towards the center of the structures were insulin-producing cells of green fluorescence. While after Mallory staining, the structures were dressed into two different colours, in the centre of the cell cluster was faint yellow, periphery of cell cluster was red, the staining of the cell cluster was similar to the natural islets after Mallory staining. Conclusions Pancreatic stem cells could be induced into islet-like structuresinvitrounder appropriate conditions.
pancreatic stem cells; cultivationinvitro; directional induction; islet-like structures
2015- 06- 01
2015- 09- 29
广西自然科学基金(2012GXNSFAA053126);广西科技厅项目(桂科自0832157,桂科攻0592007- 1G,桂科青0229009)
1001-6325(2015)12-1612-05
Q813.1
A
*通信作者(corresponding author):chwp8852@126.com

