DADS通过miR- 222抑制人胃癌细胞系的增殖与侵袭
黄宁江,刘乐江*,盘 箐,张志伟,唐海林
(1.永州职业技术学院 药学系, 湖南 永州 425000; 2.南华大学 肿瘤研究所, 湖南 衡阳 421001)
研究论文
DADS通过miR- 222抑制人胃癌细胞系的增殖与侵袭
黄宁江1,刘乐江1*,盘 箐1,张志伟2,唐海林2
(1.永州职业技术学院 药学系, 湖南 永州 425000; 2.南华大学 肿瘤研究所, 湖南 衡阳 421001)
目的通过miRNA途径研究二烯丙基二硫(DADS)的抑瘤机制,以进一步阐明DADS抑制胃癌细胞增殖与转移的分子机制。方法将胃癌细胞系MGC- 803细胞分为DADS处理组、miR- 222模拟物组、miR- 222抑制物组和阴性对照组;分别采用0、 25、 50、100、 200和400μmol/L DADS处理MGC- 803细胞;分别将miR- 222模拟物、miR- 222抑制物和scramble转染MGC- 803细胞。qRT-PCR检测MGC- 803细胞中miR- 222表达;MTT法和Transwell侵袭实验检测MGC- 803细胞增殖与侵袭能力;蛋白质印迹试验检测MGC- 803细胞中TIMP3蛋白表达。结果DADS可呈剂量依赖性下调MGC- 803细胞中miR- 222表达(P<0.05);DADS能抑制MGC- 803细胞的增殖与侵袭,外源高表达miR- 222能促进MGC- 803细胞的增殖与侵袭,而miR- 222抑制物与DADS共同处理,MGC- 803细胞的增殖与侵袭抑制作用最为显著(P<0.05);DADS可下调MGC- 803细胞中TIMP3蛋白的表达,外源高表达miR- 222能上调MGC- 803细胞中TIMP3蛋白的表达,而miR- 222抑制物与DADS共同处理,MGC- 803细胞中TIMP3蛋白的表达下调最为显著(P<0.05)。结论DADS通过下调miR- 222的表达,靶向TIMP3抑制胃癌细胞的增殖与侵袭。
胃癌; miR- 222; 二烯丙基二硫; 增殖与侵袭
二烯丙基二硫(diallyl disulfide,DADS)是大蒜中提取的天然有机硫化物。近年来,大量的研究显示,DADS对多种肿瘤具有抑制作用,包括鼻咽癌、乳腺癌、结肠癌、肺癌、胃癌以及白血病等[1- 6]。其具体抑癌机制与激活解毒致癌物的代谢酶、抑制DNA加合物与活性氧的形成、阻滞细胞周期与诱导肿瘤细胞凋亡等有关[7]。
miRNA是一类长度约为22nt的单链,非编码RNA分子,通过与其靶基因3′非编码区(UTR)完全或不完全结合,导致翻译抑制和靶mRNA的降解,从而在转录后水平对靶基因的表达进行负调控[8]。miRNA 调控细胞增殖、分裂、分化以及凋亡等重要生物学过程,并且参与多条信号通路在肿瘤的发生、发展中发挥重要作用,起着癌基因或抑癌基因样作用。前期研究发现,DADS可呈时间和剂量依赖性抑制胃癌细胞的增殖与侵袭,并且还通过miRNA芯片技术,筛选DADS处理人胃癌细胞的差异miRNA表达,发现经DADS处理后胃癌细胞中miR- 222的表达与 DMSO 对照组相比下调2倍以上[5]。研究显示,miR- 222在胃癌组织中表达增高,并且与胃癌的临床分期、侵袭深度以及淋巴结转移相关[9]。因此,推测miR- 222在DADS的抗癌作用中可能发挥重要作用。本次研究旨在从miRNA这一层面进一步揭示DADS抑制胃癌生长与转移的分子机制。
1 材料与方法
1.1 主要材料
人胃癌MGC- 803细胞(由南华大学肿瘤研究所惠赠);Lipofectamine 2000(Invitrogen公司);MTT(Sigma公司);Transwell小室(BD公司);miR- 222模拟物、对照组和miR- 222抑制剂(由Exiqon公司设计合成);RNA抽提试物盒(Applied Biosystems公司);TIMP3和β-actin抗体(Santa Cruz公司);DADS(Fluka公司):Mr146.28,d420=1.0,纯度80%,含10%~20% DAS。
1.2 方法
1.2.1 分组:将胃癌细胞系MGC- 803细胞分为DADS处理组、miR- 222 模拟物组、miR- 222抑制物组和阴性对照组;分别采用0、 25、 50、100、 200和 400 μmol/L DADS处理MGC- 803细胞48 h;分别将miR- 222模拟物、miR- 222抑制物和对照组转染MGC- 803细胞。
1.2.2 qRT-PCR:用RNA抽提试剂盒抽提每组胃癌细胞中总RNA,并反转录合成cDNA于-80 ℃保存备用。miR- 222-(正向引物)5′-CGCAGCTACA TCTGGCTACTG-3′,(反向引物)5′-GTGCAGGGTCC GAGGT-3′; U6-(正向引物)5′-GCGCGTCGTGAA GCGTTC-3′,(反向引物)5′-GTGCAGGGTCCGAGGT-3′。PCR扩增反应体系为20 μL,其中包括Taq DNA聚合酶(5 U/μL)0.2 μL,miR- PCR引物(5 μmol/L)0.4 μL,2×SYBR Mix 10 μL,miRNA RT产物2.0 μL,灭菌蒸馏水7.4 μL。循环体系为: 95 ℃ 3 min,95 ℃ 12 s,62 ℃ 35 s,72 ℃ 30 s,一共35个循环。以U6为内参,所测定的miR- 222的相对表达量采用2-ΔΔCT法分析。
1.2.3 MTT法:将转染细胞接种于96孔板中,每组设5个复孔,培养至90%汇合度,每孔加灭菌MTT液(5 g/L)20 μL,孵育4 h后取出,每孔中加入DMSO 150 μL,低速振荡10 min, 酶标仪测定570 nm各孔吸光度值,记录结果,实验重复3次。
1.2.4 Transwell侵袭实验:在Transwell小室中铺加适量基质胶稀释液,过夜以成膜。取100 μL即含1×105个细胞/mL的细胞稀释液接种至Transwell小室的上腔,下腔加500 μL含10%胎牛血清的RPMI-1640培养液,置于37 ℃、5% CO2的细胞培养箱中培养36 h,取出,用棉签擦弃小室上层细胞,PBS液轻洗,4%多聚甲醛固定,结晶祡染色,PBS液洗,倒置,晾干。光学显微镜下观察并摄相,随机选取4个高倍视野进行细胞计数,取平均值,实验重复3次。
1.2.5 Western blot:抽提每组转染48后的胃癌细胞总蛋白,每组取等量样本进行SDS-PAGE,电泳后转膜,封闭1 h,加入TIMP3抗体或β-actin抗体,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X线曝光、显影和定影。
1.3 统计学分析

2 结果
2.1 DADS对MGC803细胞miR- 222表达的影响
随着DADS剂量增加,与对照组相比,胃癌细胞中miR- 222表达量逐渐下调, (P<0.05)(图1)。
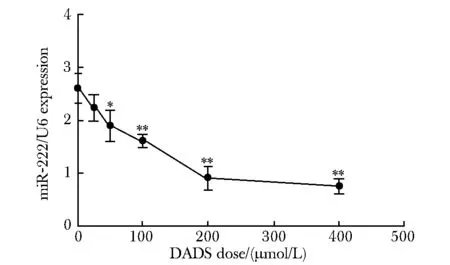
*P<0.05,**P<0.01 compared with control图1 qRT-PCR检测DADS对MGC- 803细胞miR- 222表达的影响Fig 1 The expression of miR- 222 regulated by DADS
2.2 DADS通过下调miR- 222抑制MGC- 803细胞增殖
转染miR- 222模拟物组48 h后,细胞的增殖能力明显增强(P<0.05),经200 μmol/L DADS处理MGC- 803细胞后,细胞的增殖能力明显降低(P<0.05),而miR- 222抑制物与DADS共同处理MGC- 803细胞,细胞的增殖能力降低最为显著(P<0.01)(图2)。
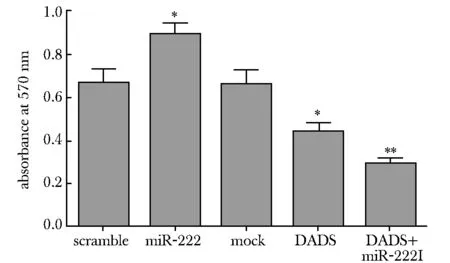
*P<0.05,**P<0.01 compared with control图2 MTT法检测DADS与miR- 222对MGC- 803细胞增殖能力的影响Fig 2 The proliferation ability of MGC- 803 cells regulated by miR- 222 and DADS were
2.3 DADS通过下调miR- 222抑制MGC- 803细胞侵袭
转染miR- 222模拟物组48 h后,穿膜细胞数明显增加(P<0.01),经200 μmol/L DADS处理MGC- 803细胞后,穿膜细胞数明显减少(P<0.01),而miR- 222抑制物与DADS共同处理MGC- 803细胞,穿膜细胞数减少最为显著(P<0.001)(图3)。
2.4 DADS对TIMP3蛋白表达的影响
转染miR- 222模拟物组TIMP3蛋白表达水平较对照组明显降低(P<0.05)。200 μmol/L DADS处理组TIMP3蛋白表达水平较对照组明显增高(P<0.05)。而miR- 222抑制物与DADS共同处理组TIMP3蛋白表达水平较对照组增高最为显著(P<0.01)(图4)。
3 讨论
胃癌是全球最常见的恶性肿瘤之一,其病死率居第二位[10]。将近一半的胃癌患者发生在中国,且大多患者就诊时已发生侵袭与转移,传统治疗疗效差,患者5年生存率在20%左右[5]。因此,开发高效、低毒的抗癌药物成为当务之急。
大量的研究显示,DADS对多种肿瘤细胞具有抑制作用,包括鼻咽癌、乳腺癌、结肠癌、肺癌、胃癌以及白血病[1- 6]。本文研究miR- 222对DADS的抑瘤机制。本结果显示, 随着DADS剂量增加, miR- 222表达量呈梯度明显下调,说明DADS可下调MGC803细胞中miR- 222的表达,且呈剂量依赖关系。miR- 222在胃癌患者血清中的表达明显高于慢性胃癌患者与健康人群,并且与胃癌患者的临床分期与淋巴结转移相关[11]。研究显示,miR- 222在胃癌中表达上调,通过直接调控PTEN的表达,从而促进胃癌细胞的增殖与侵袭[12]。miR- 222在HP相关胃癌细胞中表达上调,并且通过靶向RECK的表达促进胃癌细胞的增殖[13]。上述研究说明,miR- 222在胃癌中可能作为早期检测标志物与治疗靶点。

A.original magnification(×100); B.*P<0.01,**P<0.001 compared with control

*P<0.05,**P<0.01 compared with control图4 Western blot检测miR- 222与DADS对TIMP3蛋白的影响Fig 4 The expression of TIMP3 protein regulated by miR- 222 and DADS was tested by Western blot
TIMP3对组织中基质金属蛋白酶(MMPs)具有特异性的抑制作用,对维持细胞外基质的降解与合成之间的平衡起重要作用。研究显示,TIMP3在乳腺癌、结肠癌、子宫内膜癌表达下调,并且与肿瘤的增殖与侵袭相关[14- 16]。外源沉默结肠癌和子宫内膜癌细胞中miR- 191的表达通过上调TIMP3的表达,均可抑制结肠癌和子宫内膜癌细胞的侵袭与增殖能力。据报道,TIMP3是miR- 222直接调控的靶基因[14]。本研究显示,在胃癌细胞中外源高表达miR- 222能下调TIMP3蛋白表达水平,DADS能上调TIMP3蛋白表达,而miR- 222抑制剂与DADS共同作用,胃癌细胞TIMP3蛋白表达上调尤为明显,表明在胃癌细胞中沉默miR- 222或增加DADS处理可上调细胞中TIMP3的表达。实验显示,在胃癌细胞中外源高表达miR- 222能促进胃癌细胞的增殖与侵袭,DADS能抑制胃癌细胞的增殖与侵袭,而miR- 222抑制物与DADS共同作用,其抑制作用更为明显。
综上所述,DADS能抑制胃癌细胞的增殖与侵袭,其作用可能与下调miR- 222有关。另外,TIMP3是miR- 222的重要靶点,DADS可能通过下调miR- 222的表达,从而靶向TIMP3抑制胃癌细胞的增殖与侵袭。这些结果均提示miR- 222可作为一个潜在的治疗靶点,在DADS抑瘤作用中发挥重要作用。
[1] Zhang YW, Wen J, Xiao JB,etal. Induction of apoptosis and transient increase of phosphorylated MAPKs by diallyl disulfide treatment in human nasopharyngeal carcinoma CNE2 cells[J]. Arch Pharm Res, 2006, 29:1125- 1131.
[2] Xiao X, Chen B, Liu X,etal. Diallyl disulfide suppresses SRC/Ras/ERK signaling-mediated proliferation and metastasis in human breast cancer by up-regulating miR- 34a[J]. PLoS One, 2014, 9:e112720. doi: 10.1371/journal.pone.0112720.
[3] Zhou Y, Su J, Shi L,etal. DADS downregulates the Rac1-ROCK1/PAK1-LIMK 1-ADF/cofilin signaling pathway, inhibiting cell migration and invasion[J]. Oncol Rep, 2013, 29:605- 612.
[4] Nagaraj NS, Anilakumar KR, Singh OV. Diallyl disulfide causes caspase-depend-ent apoptosis in human cancer cells through a Bax-triggered mitochondrial pathway[J]. J Nutr Biochem, 2010, 21:405- 412.
[5] Tang H, Kong Y, Guo J,etal. Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt- 1 signaling pathway by up-regulation of miR- 200b and miR- 22 [J]. Cancer Lett, 2013, 340:72- 81.
[6] Luo N, Zhao LC, Shi QQ,etal. Induction of Apoptosis in human leukemic cell lines by diallyl disulfide via modulation of EGFR/ERK/PKM2 signaling pathways[J]. Asian Pac J Cancer Prev, 2015, 16:3509- 3515.
[7] Yi L, Su Q. Molecular mechanisms for the anti-cancer effects of diallyl disulfide[J]. Food Chem Toxicol, 2013, 57:362- 370.
[8] Tang H, Deng M, Tang Y,etal. miR- 200b and miR- 200c as prognostic factors and mediators of gastric cancer cell progression [J]. Clin Cancer Res, 2013, 19: 5602- 5612.
[9] 唐海林, 苏坚, 邓敏, 等. 胃癌组织中miR- 222 与TIMP3 的表达及临床意义[J]. 中国肿瘤临床, 2012, 39:194- 196.
[10] Guggenheim DE, Shah MA. Gastric cancer epidemiology and risk factors[J]. J Surg Oncol, 2013, 107:230- 236.
[11] Fu Z, Qian F, Yang X,etal. Circulating miR- 222 in plasma and its potential diagnostic and prognostic value in gastric cancer[J]. Med Oncol, 2014, 31:164. doi: 10.1007/s12032- 014- 0164- 8.
[12] Zhang C, Han L, Zhang A,etal. MicroRNA- 221 and microRNA- 222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J]. BMC Cancer, 2010, 10:367. doi: 10.1186/1471- 2407- 10- 367.
[13] Li N, Tang B, Zhu ED,etal. Increased miR- 222 in H. pylori-associated gastric cancer correlated with tumor progression by promoting cancer cell proliferation and targeting RECK[J]. FEBS Lett, 2012, 586:722- 728.
[14] Gan R, Yang Y, Yang X,etal. Downregulation of miR- 221/222 enhances sensitivity of breast cancer cells to tamoxifen through upregulation of TIMP3[J]. Cancer Gene Ther, 2014, 21:290- 296.
[15] Qin S, Zhu Y, Ai F,etal. MicroRNA- 191 correlates with poor prognosis of colorectal carcinoma and plays multiple roles by targeting tissue inhibitor of metalloprotease 3[J]. Neoplasma, 2014, 61:27- 34.
[16] Dong M, Yang P, Hua F. miR- 191 modulates malignant transformation of endometriosis through regulating TIMP3[J]. Med Sci Monit, 2015, 21:915- 920.
Diallyl disulfide suppresses the proliferation and invasion of human gastric cancer cell line MGC- 803 by down-regulating miR- 222
HUANG Ning-jiang1, LIU Le-jiang1*, PAN Qing1, ZHANG Zhi-wei2, TANG Hai-lin2
(1.Dept. of Parmacology, Yongzhou Vocational Technical College, Yongzhou 425000; 2.Cancer Research Institute, University of South China, Hengyang 421001, China)
Objective To identify the mechanism related to miRNA pathway which plays a role in the anti-tumor effects of Diallyl disulfide. Methods Gastric cancer cell line MGC- 803 was divided into DADS treatment group, miR- 222 mimics groups, miR- 222 inhibitors group and negative control group; MGC- 803 cells were treated with 0, 25, 50, 100, 200, 400 μmol/L DADS respectively; miR- 222 mimics, miR- 222 inhibitors and scramble sequence were transfected in MGC- 803 cells respectively. A qRT-PCR was employed for detecting the expression of miR- 222 in MGC- 803 cells. Western blotting was conducted to detect the expressions of TIMP3 protein in MGC- 803 cells. The proliferation and invasion ability of MGC- 803 cellsinvitrowere evaluated by MTT and Transwell invasion assays. Results miR- 222 expression was down-regulated by increasing doses of DADS(P<0.05); DADS could significantly inhibit MGC- 803 cell proliferation and invasion capacity, ectopic expression of miR- 222 could significantly promote MGC- 803 cell proliferation and invasion capacity. Furthermore, gastric cancer cells treated with combination of DADS and miR- 222 inhibitors showed significant inhibition to cell proliferation and invasion (P<0.05); The expression of TIMP3 protein was inhibited by treatment with DADS in MGC- 803 cells, overexpression of miR- 222 resulted in increased TIMP3 protein levels. Furthermore, the expression of TIMP3 protein was inhibited as treated with combination of DADS and miR- 222 inhibitors(P<0.05). Conclusions DADS suppresses proliferation and invasion of human gastric cancer cells through targeting at TIMP3 by down-regulation of miR- 222.
gastric cancer; miR- 222; diallyl disulfide; proliferation and invasion
2015- 04- 02
2015- 07- 03
国家自然科学基金(31100935);永州市科技计划项目[(2012)17号- 22]
1001-6325(2015)12-1596-05
R735.2
A
*通信作者(corresponding author):176024235@qq.com

