小麦戊聚糖对2型糖尿病小鼠肠道菌群和血糖的影响
沈丽娟,王倩Δ,胡源
(1.南京中医药大学无锡附属医院 重症监护科,江苏 无锡 214071;2.南京中医药大学无锡附属医院内分泌科,江苏 无锡 214071)
小麦戊聚糖对2型糖尿病小鼠肠道菌群和血糖的影响
沈丽娟1,王倩1Δ,胡源2
(1.南京中医药大学无锡附属医院 重症监护科,江苏 无锡 214071;2.南京中医药大学无锡附属医院内分泌科,江苏 无锡 214071)
目的 研究小麦戊聚糖对2 型糖尿病小鼠肠道菌群和血糖的影响。方法 昆明种小鼠30只,随机分为3组,正常对照组,模型组,治疗组,每组10只。以腹腔注射链佐霉素构建糖尿病小鼠模型,治疗组在普通饮食基础上加用小麦戊聚糖制剂灌胃[6.7g/(kg·bw)]。观察造模后3周采用葡萄糖氧化酶法测各组空腹血糖的变化,采用16S rRNA 实时荧光定量 PCR检测小鼠肠道主要的菌群,比较各组菌群的差异。结果 链佐霉素诱导2型糖尿病后小鼠空腹血糖升高(P<0.05),双歧杆菌、乳酸杆菌数量下降(P<0.05),且肠道双歧杆菌及乳酸杆菌的数量与空腹血糖呈负相关 (P=0.001,r=-0.918;P=0.019,r=-0.718)。灌胃小麦戊聚糖制剂后,小鼠空腹血糖逐渐降低(P<0.05),肠道双歧杆菌及乳酸杆菌的数量有所恢复。结论 2型糖尿病小鼠肠道菌群发生紊乱,小麦戊聚糖制剂能调节2型糖尿病小鼠肠道菌群紊乱,降低血糖水平。
小麦提取物;戊聚糖;2型糖尿病;肠道菌群;血糖
随着生活水平的提高,饮食结构的改变,肥胖、糖尿病等疾病患病率呈上升趋势,已成为全球突出的社会问题之一[1]。研究发现,肠道菌群与肥胖、糖尿病发病密切相关[2],肥胖及糖尿病患者肠道菌群紊乱,益生菌数量下降[3]。研究发现,谷物膳食纤维对肥胖、2型糖尿病有治疗作用[4]。戊聚糖又名阿拉伯木聚糖,是谷物膳食纤维的主要成分。本研究通过链脲佐菌素(streptozocin, STZ)诱导2型糖尿病小鼠模型[5],灌胃小麦提取物戊聚糖制剂后观察其空腹血糖、肠道菌群等变化,研究小麦戊聚糖对2型糖尿病是否具有治疗效果,并探讨其作用机制。
1 材料与方法
1.1 实验动物 雄性昆明种小鼠30只,体质量(25±3) g,由上海市西普尔-必凯实验动物有限公司提供,合格证号为:SYXK(沪)2008-0016,合格证号:2008001624801。小鼠饲养和实验均在南京医科大学动物中心实验室内进行。小鼠接收后放入实验环境中分笼饲养,保持环境温度20 ℃~25 ℃,湿度40%~70%,12h光照。饲以实验动物用配合饲料,自由进食饮水,本实验遵循《实验动物保护条例》。
1.2 仪器及试剂 耐高温a-淀粉酶由无锡杰能科生物工程有限公司提供。Dcode变性梯度凝胶电泳系统、凝胶成像Gel DocTM XR 系统(Bio-Rad,USA),PCR 仪(ABI,USA)。QIAamp粪便DNA 提取试剂盒(Cat .NO.51504)、乙二胺四乙酸(EDTA)、无水乙醇、三羟甲基氨基甲烷(Tris)均购自陕西众美生物科技有限公司;十二烷基硫酸钠(SDS)、蛋白酶 K、溶菌酶均购自上海生工生物公司;DNA分子标准Marker及TaqDNA多聚酶(Qiagen公司)。
1.3 小麦戊聚糖的制备 按郑学玲等[6]方法提取:实验原料小麦麸皮(上海马来西亚面粉有限公司提供)用粉碎机粉碎后过筛,筛下物按W(麸皮):V(体积分数为80的乙醇溶液)=1 g:5 mL的比例,离心分离出上清液;不溶物按质量比1:10加入蒸馏水,并加入一定量的戊聚糖酶,60 ℃提取2 h;离心分离上清夜,将上清液加热到95 ℃,加入适量的耐高温ɑ-淀粉酶,保温90 min,并不断振荡,然后冷却到60 ℃,加入适量糖化酶,保温1 h;然后用中性蛋白酶处理,以分解其中含有的蛋白质,加热到100 ℃,并保温20 min进行灭酶处理;离心分离上清夜,浓缩上清液至一定体积,然后加入4倍体积的乙醇,在4 ℃静止,过夜;离心收集沉淀,沉淀部分加一定量水溶解,浓缩去除残余的乙醇,得到水溶性戊聚糖。随后放入 85 ℃的烘箱里烘干得到成品,成品为黄白色粉末,提取率为60%,即1000 g小麦麸皮得出600g戊聚糖成品。将600 mL蒸馏水直接加入600 g粉末中混匀后微孔筛过滤配成1 g/mL浓度溶液供实验用。
1.4 造模及分组 取小鼠30只,分为正常对照组(10只),糖尿病模型组(20只) 。糖尿病模型采用0.1 mol/L柠檬酸缓冲液(pH 4.4)稀释STZ,按200 mg/kg体重腹腔注射,3d后尾静脉采血测血糖(葡萄糖氧化酶法),血糖>11.1 mmol/L确定为糖尿病模型小鼠,造模失败者剔除。正常对照组小鼠腹腔注射等体积生理盐水。造模成功后随机分为2组:模型组及治疗组。模型组除饲以实验动物用配合饲料,自由进食饮水外,不进行特殊处理。治疗组给予灌胃6.7 g/(kg·bw)小麦戊聚糖溶液,每天1次,其余时间饲以实验动物用配合饲料,自由进食饮水,共治疗观察3周。
1.5 血糖测定 每组小鼠治疗前及开始治疗后每周周一空腹状态采用葡萄糖氧化酶法测定空腹血糖值,直至3周后实验结束。
1.6 肠道细菌测定 粪便标本采集及DNA提取:以无菌方法取小鼠的新鲜粪便,置于无菌试管内,快速保存于-280 ℃低温冰箱内。称取0.2 g粪便标本,使用QIAamp粪便DNA提取试剂盒,根据试剂盒说明提取粪便细菌总DNA。
设计引物及PCR扩增:根据长双歧杆菌、乳酸杆菌16S rDNA基因序列,应用引物设计软件PrimerPremier设计相应菌属PCR引物。双歧杆菌属(350 bp)F:5’-ACCCTGGTAGTCC-ACGCCGTAA-3’;R:5’-GGCACAATCCGCTGGCAACA-3’。乳酸杆菌属(165 bp)F:5’-ACGGGAGGCAGCAGTAGGGA-3’;R:5’-AGCCGTGACTTTCTGGTTGATT-3’;制作标准曲线:以各标准菌株PCR产物经处理后所得的DNA片段作为荧光定量PCR的标准品。以PCR反应过程中出现荧光信号的初始循环数(C)为纵坐标,以各模板不同拷贝数的对数值为横坐标,做出标准曲线,得到截距(b),斜率(k)及相关性,最后利用回归方程式:log Co=(Cn-b)/k,将所得各标本的初始循环数代入公式,即得到对应的DNA模板数;
粪便细菌16S rDNA定量分析:将粪便样品中提取的DNA分别进行2种细菌16S rDNA荧光定量PCR反应,反应体系和反应条件与标准曲线制备时相同。每次实验同时设标准品校正和ddH2O代替DNA模板的阴性对照,每个样品均同时做3个平行复孔。反应完毕后根据融解曲线分析PCR产物的特异性。
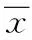
2 结果
2.1 小鼠空腹血糖的变化 造模成功后,糖尿病模型组造模后小鼠空腹血糖与正常对照组相比显著升高,差异有统计学意义(P<0.05);治疗组每周空腹血糖逐渐下降,第2周及第3周空腹血糖水平与造模后相比差异有统计学意义(P<0.05);第3周空腹血糖水平与正常对照组比较差异无统计学意义,见表1。
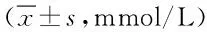
表1 小鼠空腹血糖变化情况Tab.1 Changes of fasting blood glucose in ±s,mmol/L)
*P<0.05,与正常对照组比较,compared with control group;#P<0.05,与造模后比较,compared with after modeling
2.2 肠道菌群的变化 造模成功后,糖尿病模型组小鼠肠道双歧杆菌及乳酸杆菌数量下降,与造模前相比差异有统计学意义(P<0.05);治疗组每周肠道双歧杆菌及乳酸杆菌数量逐渐升高;至第3周肠道双歧杆菌及乳酸杆菌数量逐渐恢复,双歧杆菌与造模后相比差异有统计学意义(P<0.05),乳酸杆菌数量与造模前、后相比差异无统计学意义,见表2。
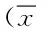
表2 小鼠肠道菌群的变化情况±s)Tab.2 Changes of intestinal flora status in mice ±s)
*P<0.05,与造模前比较,compared with before modeling;#P<0.05,与造模后比较,compared with after modeling
扩增曲线见图1,标准曲线见图2,融解曲线见图3。
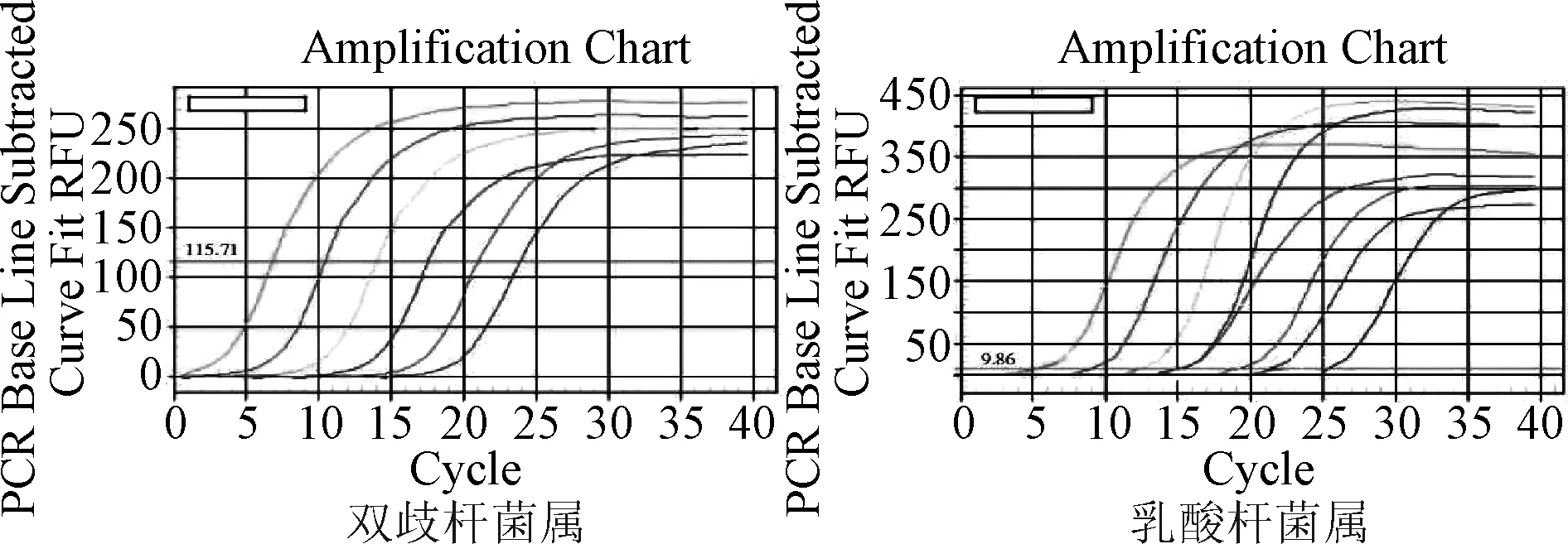
图1 2种菌属的扩增曲线Fig.1 Amplification curve of 2 genus bacteria
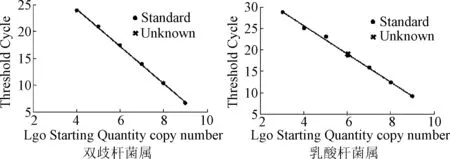
图2 2种菌属的标准曲线Fig.2 Standard curve of 2 genus bacteria
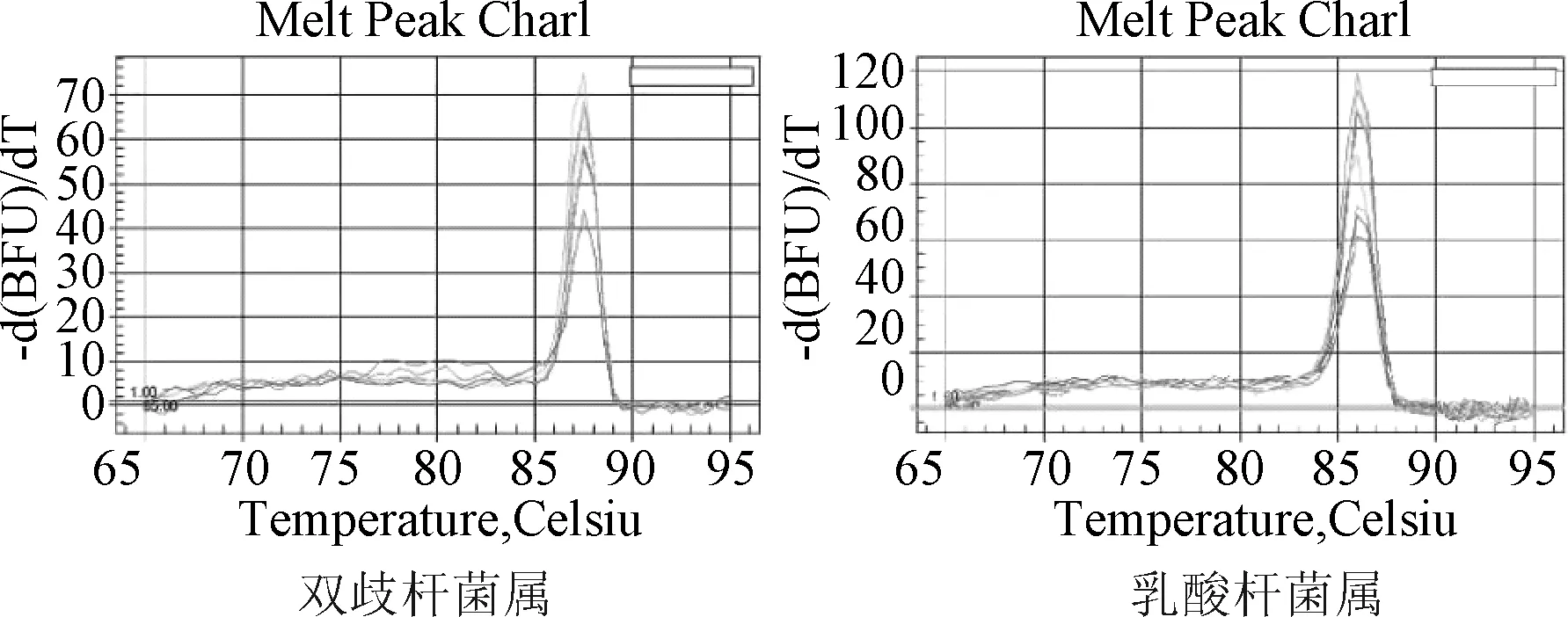
图3 2种菌属的融解曲线Fig.3 Melting curve of 2 genus bacteria
2.3 肠道菌群与空腹血糖的关系 造模成功后双歧杆菌与空腹血糖呈负相关 (P=0.001,r=-0.918),乳酸杆菌的数量与空腹血糖呈负相关(P=0.019,r=-0.718),见图4。

图4 双歧杆菌、乳酸杆菌与空腹血糖相关性分析Fig.4 Correlation analysis of bifidobacterium, lactobacillus and fasting glucose
3 讨论
随着生活水平的提高,饮食结构的改变,肥胖、糖尿病等疾病患病率呈上升趋势,已成为全球突出的社会问题之一[1]。糖尿病是一组病因和发病机制尚未完全阐明的内分泌代谢性疾病。近期大量研究发现,肠道菌群紊乱参与了糖尿病的发生与发展[2],糖尿病患者肠道菌群紊乱,益生菌数量下降,肠杆菌及肠球菌数量上升[3-7]。大量的动物实验及临床研究证实了上述理论结果。白永亮等[8]发现,糖尿病SD大鼠双歧杆菌数量显著低于正常大鼠,且乳酸杆菌数量也已经显著低于正常大鼠。也有研究者发现[9],糖尿病小鼠肠道内大肠杆菌和链球菌数量显著升高,而乳酸杆菌和双歧杆菌的数量明显下降。刘海霞等[10]利用16S RNA定量PCR方法发现,2型糖尿病患者的双歧杆菌数目显著低于非糖尿病个体,肠粪球菌数目高于非糖尿病个体。
本研究通过STZ构建2型糖尿病模型,采用16SrDNA荧光定量PCR检测,发现肠道双歧杆菌及乳酸杆菌数量下降,并与血糖呈负相关关系,与既往研究结果一致[11-12]。肠道菌群紊乱引起糖尿病发生发展的机制主要是:增加食物中能量、引起慢性低度炎症、影响脂肪酸的代谢、分泌肠衍生肽等[13]。肠道菌群能调节能量守恒,从饮食中获取能量,以甘油三酯储存,通过脂肪酸氧化进行能量消耗,从而调节饮食诱导的肥胖、胰岛素抵抗和糖尿病[11]。肠道菌群紊乱导致革兰氏阴性杆菌相对增多,肠道菌群紊乱,肠黏膜通透性增加,细菌移位,此时肠道产生和吸收较多的脂多糖(lipopolysaccharide,LPS),LPS和固有免疫细胞表面的CD14-Toll 样受体(toll like receptors,TLR4)形成复合物结合激活炎性反应,从而产生胰岛素抵抗、损伤β细胞分泌功能,引起或促进2型糖尿病的发生发展[3]。
目前研究发现,谷物膳食纤维对肥胖、2型糖尿病有治疗作用[4]。研究表明,增加谷物膳食纤维的摄入能够调节肠道菌群紊乱、改善肠粘膜屏障功能,对糖尿病、肥胖具有预防作用[14]。戊聚糖又名阿拉伯木聚糖,是谷物膳食纤维的主要成分。戊聚糖在结肠部位能被特定的细菌所降解,对双歧杆菌和乳酸杆菌等有增殖作用。研究表明[15],从人结肠组织分离的乳酸杆菌能够利用燕麦戊聚糖及其酶解产物而增殖。本研究给予2型糖尿病小鼠小麦戊聚糖灌胃,发现治疗后小鼠空腹血糖水平下降,肠道双歧杆菌、乳酸杆菌数量较治疗前恢复,与文献报道一致。膳食纤维不能被人体胃肠道消化,但在结肠会成为肠道微生物的作用底物而被选择性地分解和发酵,产生短链脂肪酸,这些短链脂肪酸既能被宿主肠壁快速吸收利用,又能被肠道双歧杆菌和乳酸杆菌等有益菌利用,从而促进有益菌增殖,同时通过降低肠道pH值,抑制大肠杆菌和沙门氏菌等病原菌的生长,减少有毒产物的形成,从而改善肠道微环境,保护肠粘膜屏障功能[16]。
2型糖尿病肠道菌群发生紊乱,双歧杆菌及乳酸杆菌数量下降,可能参与了2型糖尿病的发生与发展。小麦戊聚糖制剂能调节2型糖尿病小鼠肠道菌群紊乱,降低血糖水平。可以作为糖尿病患者的碳水化合物的主要来源。但本研究仅限于动物实验,观察肠道菌群也仅限于双歧杆菌及乳酸杆菌。在进一步研究中,临床实验将扩大样本量,观察更多的肠道菌群,以期为小麦戊聚糖制剂应用于临床提供更多的理论依据。
[1] 郭霄,张勇,郭建林,等.Ⅱ型糖尿病与肠道菌群及益生菌的相关性研究进展[J].中国乳品工业,2013,41(8):48-51.
[2] 胡星云,李焱.肠道菌群与2型糖尿病[J].药品评价,2013,10(21):8-10.
[3] Bondarenko VM,Maleev VV, Likhoded VG.Intestinal microflora,obesity and type 2 diabetes[J].ZhMikrobiol Epidemiol Immunobiol,2014, (3):42-49.
[4] 孙元琳,陕方,赵立平.谷物膳食纤维—戊聚糖与肠道菌群调节研究进展[J].食品科学, 2012,33(9):326-330.
[5] 别明江,刘详,潘素华,等.糖尿病模型小鼠的肠道菌群与血糖关系的探讨[J].现代预防医学,2005,32(11):1441-1443.
[6] 郑学玲,李利民,姚惠源.小麦麸皮水溶性戊聚糖的分离及分级纯化[J].无锡轻工大学学报,2004,23(2):1-4.
[7] 薛平燕,徐玉善,吴斌,等.肠道菌群与肥胖和 2 型糖尿病的关系[J].医学综述,2013,19(11):2042-2044.
[8] 白永亮,彭真福,陈庆发,等.香蕉粉干预对糖尿病大鼠肠道菌群调节作用研究[J].现代食品科技,2013,29(9):2110-2114.
[9] 王令仪,王硕,王源,等.麦冬多糖MDG-1对糖尿病小鼠糖耐量及肠道菌群的影响[J].世界华人消化杂志,2011,19(1):2058-2062.
[10] 刘海霞,李晶,刘奔,等.阿卡波糖对2型糖尿病患者粪便中双歧杆菌数量的影响[J].中华内分泌代谢杂志,2011,27(11):928-931.
[11] Shillitoe E,Weinstock R,Kim T,et al.The oral microflora in obesity and type-2 diabetes[J].J Oral Microbiol,2012,4:19013-19021.
[12] 王红漫,王文丽,付朝晖,等.老年糖尿病患者肠道菌群的变化以及抗菌素和微生态制剂对其的影响[J].重庆医科大学学报,2009,34(8):1101-1105.
[13] Musso G,Gambino R,Cassader M,et al.Obesity,Diabetes,and Gut Microbiota[J].Diabetes Care,2010, 33(10): 2277-2284.
[14] Lim CC,Erguson LR,Tannock GW.Dietary fiber as “prebiotics”: implications for colorectal cancer[J].Mol Nutr Food Res,2005,49(6): 609-619.
[15] Kontula P,Von Wright A,Mattila-Sandholm T.Oat branβ -gluco-and xylo-oligosaccharides as fermentative substrates for lacticacid bacteria[J].Int J Food Microbiol,1998,45(2):163-169.
[16] Laparra JM,SanzY.Interactions of gut microbiota with functionalfood components and nutraceuticals[J].Pharmacol Res,2010,61(3):219-225.
(编校:王冬梅)
Effect of wheat pentosans on intestinal flora and plasma glucose in diabetic mice
SHEN Li-juan1,WANG Qian1Δ,HU Yuan2
(1.Department of ICU, Wuxi Hospital Affiliated to Nanjing University of Chinese Medicine, Wuxi 214071, China; 2.Department of Endocrinology, Wuxi Hospital Affiliated to Nanjing University of Chinese Medicine, Wuxi 214071, China)
ObjectiveTo investigate the effect of wheat pentosans on intestinal flora and plasma glucose in type 2 diabetic mice.Methods30 Kunming mice were randomly divided into normal control group, model group, treatment group, 10 mice in each group.The animal model was established by intraperitoneal injection of streptozocin (STZ).The treatment group was orally administrated by gavaged with wheat pentosans[6.7 g/(kg·bw)].The levels of plasma glucose were measured by glucose oxidase method 3 week later.Total DNA was extracted from collected stool samples and submitted to real-time quantitative PCR (qPCR) with region of the 16S rRNA gene.ResultsThe plasma glucose levels in model group increased (P<0.05).The bifidobacteriumand lactobacilli counts decreased significantly(P<0.05).The bifidobacterium and lactobacilli counts were significantly negatively correlated with plasma glucose concentration (P=0.001,r=-0.918;P=0.019,r=-0.718). After given wheat pentosans to mice, the mice’s plasma glucose decreased(P<0.05).The counts of bifidobacterium and lactobacilli were several returned. ConclusionThere exists intestinal flora disorder in type 2 diabetes mice, the wheat pentosans can reduce the levels of plasma glucose in type 2 diabetic mice and modulate the mice intestinal flora.
wheat extract; pentosans;type 2 diabetes;intestinal flora; plasma glucose
沈丽娟,女,硕士,博士在读,研究方向:重症医学研究.E-mail:panda55@163.com;王倩,通讯作者,女,学士,副主任医师,研究方向:重症医学研究工作,E-mail:zhangwangqian72@sina.com。
R587.1
A
1005-1678(2015)02-0028-04

