5个不同厂家卡马西平溶出度分析
王翼,李珊珊,詹长娟,王华,徐伟
(南京理工大学泰州科技学院化工学院,泰州 225300)
5个不同厂家卡马西平溶出度分析
王翼,李珊珊,詹长娟,王华,徐伟
(南京理工大学泰州科技学院化工学院,泰州 225300)
目的 对国内5个厂家(A、B、C、D、E)生产卡马西平片的体外溶出度进行分析。方法 采用紫外分光光度法测定,分别根据《中华人民共和国药典》和日本《医疗用药品品质情报集》橙皮书对溶出度实验的要求,以稀盐酸24 mL加水定容至1 000 mL(介质Ⅰ)及水、pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液900 mL为介质,进行体外溶出实验。并采用相似因子f2法与参比制剂(F厂家)进行溶出曲线的相似性比较。结果 5厂家产品在介质Ⅰ中,60 min时溶出度均>70%,满足《中华人民共和国药典》要求;在其余4种介质中,5 min时溶出度均低于55%,但在30 min时A、B、C厂家产品不超过70%,且5厂家产品与参比制剂的溶出曲线相似因子f2均<50,所以5厂家产品均不满足日本橙皮书要求。结论 卡马西平片的仿制产品质量有待提高,有必要对市售产品进行整体内在品质再评价。
卡马西平;溶出度;分光光度法,紫外
1 仪器与试剂
1.1 仪器 ZRS-8L智能溶出实验仪(天津市天大天发科技有限公司),UV2450紫外分光光度计(日本岛津公司),MS105 分析天平[梅特勒-托利多仪器(上海)有限公司,感量:0.01 mg]。
1.2 试剂 卡马西平片(A、B、C、D、E 5个厂家,规格:0.1 g,批号:1301191,1304271,130401,120701,20130407;参比制剂厂家F,规格:0.2 g,批号:X0606),卡马西平对照品(武汉大华伟业医药化工有限公司,含量:99.71%,批号:DH131210);盐酸(无锡市佳妮化工有限公司,分析纯,批号:20120215),无水乙醇(无锡市佳妮化工有限公司,分析纯,批号:20121210),氯化钠(无锡市佳妮化工有限公司,分析纯,批号:20091108)、磷酸氢二钠(国药集团化学试剂有限公司,分析纯,批号:F20081104)、磷酸二氢钾(江苏强盛功能化学股份有限公司,分析纯,批号:20120910)、无水醋酸钠(江苏强盛功能化学股份有限公司,分析纯,批号:20130301)、冰醋酸(无锡市佳妮化工有限公司,分析纯,批号:20100702)。
2 方法与结果
2.1 紫外分光光度法的建立与评价
2.1.1 溶出介质的选择 根据我国现行卡马西平片的溶出度标准[11],配制介质Ⅰ;根据日本《医疗用药品品质情报集》推荐的卡马西平片溶出度标准配制介质Ⅱ、Ⅲ、Ⅳ、Ⅴ。具体配制方法如下。介质Ⅰ:以稀盐酸(取盐酸234 mL,加水稀释至1 000 mL,即得)24 mL加水定容至1 000 mL。介质Ⅱ:水。介质Ⅲ(pH=1.2盐酸溶液):取氯化钠2.0 g,加水适量使溶解,加盐酸7 mL,再加水稀释至1 000 mL,即得。介质Ⅳ(pH=4.0醋酸盐缓冲液):称取冰醋酸2.46 g、三水合醋酸钠1.23 g加水稀释至1 000 mL(16.4:3.6)摇匀,即得。介质Ⅴ(pH=6.8磷酸盐缓冲液):取磷酸二氢钾1.7 g和无水磷酸氢二钠1.78 g,加水适量使溶解后,定容至1 000 mL。
2.1.2 测定波长的选择 卡马西平对照品贮备液的配制:准确称取卡马西平对照品20.7 mg,置100 mL量瓶中,加无水乙醇40 mL,溶解,加无水乙醇稀释至刻度,摇匀,即得浓度为207 μg·mL-1的贮备液。准确移取0.5 mL贮备液于10 mL量瓶中,分别用上述5种介质稀释至刻度,进行紫外扫描,结果显示,在285 nm处均有最大吸收,故确定285 nm为测定波长。
2.1.3 标准曲线的绘制 分别准确移取卡马西平贮备液0.1,0.2,0.3,0.4,0.5,0.6 mL置10 mL量瓶中,用溶出介质稀释至刻度,在285 nm下测定吸光度,以吸光度对浓度进行线性回归,得卡马西平在上述5种介质中的标准曲线方程分别为:A=0.050 7C+0.033 2(r=0.999 8)、A=0.050 9C+0.031 6(r=0.999 9)、A=0.050 4C+0.037 3(r=0.999 8)、A=0.050 7C+0.030 4(r=0.999 8)、A=0.050 5C+0.039 3(r=0.999 7)。显示卡马西平在浓度2.07~12.42 μg·mL-1范围内,线性关系良好。
2.1.4 含量测定 卡马西平供试品溶液的配制:取卡马西平片20片,精密称定,研细。精密称取适量(相当于卡马西平10 mg),置50 mL量瓶中,加甲醇振摇,并稀释至刻度,滤过,得供试品溶液。准确移取供试品溶液1 mL,用水稀释至50 mL量瓶中,在285 nm处测得吸光度,依据标准曲线方程,计算各厂家的标示量的百分含量分别为:A厂家(99.7±0.73)%; B厂家(99.2±1.08)%;C厂家(99.6±0.96)%;D厂家(99.9±1.36)%;E厂家(100.4±1.28)%;F厂家(99.9±0.68)%(n=3)。
2.1.5 回收率实验 准确移取已知含量的供试品溶液1 mL置100 mL量瓶中,按含量的80%,100%,120%加入卡马西平贮备液,用溶出介质稀释至刻度,在285 nm波长处测定吸光度,根据标准曲线方程计算相应的平均回收率(n=9)。结果显示,卡马西平在上述5种介质中的平均回收率分别为(98.1±1.1)%,(99.0±1.2)%,(99.2±1.4)%,(99.2±1.5)%,(98.4±1.3)%。RSD分别为1.09%,1.17%,1.39%,1.47%,1.30%。
2.1.6 稳定性实验 准确移取卡马西平贮备液5.0 mL置100 mL量瓶中,分别用溶出介质稀释至刻度,37 ℃水浴保存,每2 h测定吸收度,结果显示8 h内,卡马西平在上述5种介质中的吸收度的RSD分别为0.59%,0.29%,0.23%,1.01%,1.15%。
2.2 溶出度实验 取本品,照溶出度测定法(《中华人民共和国药典》二部附录ⅩC第二法),分别按2010版《中华人民共和国药典》第一增补版标准,即以1 000 mL介质Ⅰ为溶出介质,转速为75 r·min-1(规格为0.1 g)或150 r·min-1(规格为0.2 g);及日本《医疗用药品品质情报集》的溶出度标准,即介质为Ⅱ、Ⅲ、Ⅳ、Ⅴ,体积均为900 mL,转速为75 r·min-1。依法操作,在5,10,15,20,30,45,60,80 min时,分别取10 mL(同时补充等量等温介质),经孔径0.45 μm微孔滤膜滤过,再精密移取续滤液1 mL,至10 mL量瓶中,用溶出介质稀释至刻度,在285 nm波长处测定吸光度,根据标准曲线方程计算各溶出度,绘制溶出曲线,结果见图1。
卡马西平片的现行溶出度标准为“1 000 mL介质Ⅰ为溶出介质,60 min时溶出度不低于70%”,根据这一标准,所有厂家均符合要求;而日本《医疗用药品品质情报集》溶出度标准为“分别以900 mL的溶液Ⅱ、Ⅲ、Ⅳ、Ⅴ为溶出介质,采用两点法对溶出限度进行控制,5 min时溶出度不得超过55%,30 min时(100 mg规格)或45 min时(200 mg规格)为70%以上”。根据这一标准,A厂家产品在介质Ⅱ、Ⅲ中,溶出度不合格(30 min时的溶出度分别为59.5%和65.6%);B厂家产品在介质Ⅱ中,溶出度不合格(30 min时溶出度为65.8%);C厂家产品在介质Ⅱ、Ⅴ中,溶出度不合格(30 min时的溶出度分别为65.3%和60.9%);D、E、F厂家产品均合格。
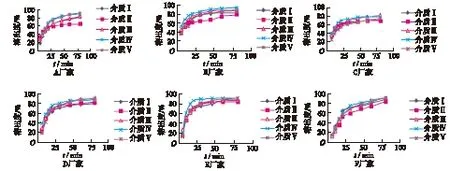
图1 不同厂家卡马西平片在5种介质中的溶出曲线
2.3 溶出曲线相似性评价 根据日本《医疗用药品品质情报集》中卡马西平片溶出度药品再评价标准,不仅要求在4种介质中的溶出限度符合要求,且4条溶出曲线应与参比制剂相似。溶出曲线的相似性评价,采用相似因子f2法,其具体计算方法为:
式中Rt和Tt分别代表受试制剂和参比制剂溶出曲线上不同取样时间点的溶出度,n表示取样次数。
根据日本“含量不同的口服固体制剂生物等效性实验指导原则(2012年版)”,设参比制剂F平均溶出率达85%的时间点为Ta,则溶出曲线相似性比较的时间点为Ta/4、2Ta/4、3Ta/4和Ta4个时间点;当f2>50,“在最终比较时间点,受试制剂的溶出度实验单位个体中,超出平均溶出率±15%范围的不多于1个,同时不存在超出平均溶出率±25%的个体”,同时满足以上两个条件,则两条溶出曲线相似。A、B、C、D、E 5个厂家产品与参比制剂F(原研制剂)的溶出曲线相似性比较,结果显示,所考察的5个厂家产品在所要求的4种介质中的溶出曲线均不能与参比制剂完全相似,所以,均为不合格产品。A厂家有1条曲线不相似,B、D厂家有2条不相似,C厂家有3条不相似,E厂家4条曲线均不相似。见表1。
3 讨论
卡马西平片溶出度的标准差异:我国现行标准与日本“药品品质再评价”标准相比,二者除均采用桨法之外,在转速、介质体积、介质种类的选择、溶出限度、溶出曲线要求方面均有较大差异。从模拟人体胃肠道pH环境方面来讲,同时采用4种不同pH介质评价药物的体外溶出比采用单一介质更能保证药品在体内的良好吸收。另一方面,卡马西平药物本身治疗窗狭窄(4~10 mg·L-1)[3],既要防止药物在早期“突释”引起不良反应,又要保证药物在后期的较好疗效,溶出限度上采用两点法控制更为合理。
我国目前溶出度标准中,对溶出曲线的“形状”没有要求,只要在规定时间点溶出限度符合要求即为合格。显然这一标准存在缺陷,它忽略了药物前期的释放行为对疗效的影响,特别对于治疗窗狭窄的药物,这也很可能导致患者用不同厂家产品疗效存在差异,尽管其检验合格。
表1 5个厂家产品与参比制剂溶出曲线相似性比较

生产厂家溶出介质f2结果A介质Ⅱ46.00 不相似介质Ⅲ59.00 相似介质Ⅳ70.00 相似介质Ⅴ69.00 相似B介质Ⅱ64.00 相似介质Ⅲ43.00 不相似介质Ⅳ39.00 不相似介质Ⅴ64.00 相似C介质Ⅱ51.00 不相似[最终时间取样点时溶 出度超出(85±15)%范围]介质Ⅲ55.00 相似介质Ⅳ48.00 不相似介质Ⅴ47.00 不相似D介质Ⅱ53.00 相似介质Ⅲ47.00 不相似介质Ⅳ48.00 不相似介质Ⅴ55.00 相似E介质Ⅱ45.00 不相似介质Ⅲ48.00 不相似介质Ⅳ36.00 不相似介质Ⅴ47.00 不相似
根据药品品质再评价的原理,对仿制产品的溶出度标准提出更高要求,不仅在溶出限度上要符合要求,溶出曲线也应与参比制剂保持相似,这样能更好地保持药品质量的一致性。如D、E两厂家产品,溶出限度符合要求,但溶出曲线与参比制剂有较大差异,也是不合格产品,主要原因是其前期(前30 min内)释放的太早且太快。所以,普通口服仿制固体制剂,不能简单地认为“释放的越快越好,释放的越早越好”,而应该“仿”得与原研制剂一致。
对于参比制剂的选择,笔者选取F厂家产品为参比,其为卡马西平片的原研制剂(1968年上市)。笔者认为,参比制剂的选择至关重要,不能随意选择,否则会出现“A厂与B厂相似,B厂与C厂相似,C厂与D厂相似,随着误差的传递,很有可能A厂与D厂产品间质量出现较大差异”的现象。所以,国家应尽快建立参比制剂目录,提供溶出曲线一致性评价方法,便于生产厂家参考,以保证不同厂家产品质量的一致性,减少患者“选药”的困扰。
笔者所考察的A、B、C、D、E 5个厂家产品,在溶出度和(或)与参比制剂溶出曲线的相似性上均存在差异,究其原因,可能与卡马西平的晶型(卡马西平至少有4种晶形,不同晶形溶解度也有所不同)、辅料及制剂工艺有较大关系,建议厂家从这几方面着手,改善产品的体外溶出行为,提高产品质量。
[1] 陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社,2011:215.
[2] 谢沐风,张启明,陈洁,等.国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J].中国药事,2008,22(3):257-261.
[3] 杨宝峰.药理学[M].7版.北京:人民卫生出版社,2008:136.
[4] 肖克来提,郭英芳,阿丽艳.不同厂家卡马西平片溶出度考察[J].中国医院药学杂志,2000,20(3):151-152.
[5] 李万玉,徐富培,黄萍,等.国内不同药厂生产的卡马西平片溶出速率研究[J].重庆医科大学学报,2003,28(6):748-750.
[6] 王萍,张全英,潘杰.4家药厂卡马西平片溶出度和生物利用度考察[J].江苏药学与临床研究,2004,12(5):1-3.
[7] 张梅君,王志强,吴继禹.不同厂家卡马西平片溶出度比较[J].中国药业,2007,16(22):30-31.
[8] 崔虓,张慧,曾大利,等.不同厂家卡马西平片溶出度考察[J].海峡药学,2009,21(3):19-20.
[9] 高志强,潘杰,张全英.不同厂家卡马西平片质量对比考察[J].苏州大学学报(医学版),2004,24(3):428-429.
[10] 谢沐风.改善溶出度评价方法,提高固体药物制剂水平[J].中国医药工业杂志,2005,36(7):447-451.
[11] 国家药典委员会.中华人民共和国药典(第一增补版)[M].北京:中国医药科技出版社,2010:325.
DOI 10.3870/yydb.2015.08.028
2014-04-25
2014-07-30
王翼(1980-),男,山西临汾人,讲师,硕士,研究方向:药物新剂型的开发。电话:0523-86150675,E-mail:lywy226@163.com。
R971.6; R927.1
B
1004-0781(2015)08-1090-04

