高效液相色谱法测定复方丹参片与滴丸中7种活性成分含量*
张爱兵,张珺,程月发,张春雨,郭兰,刘颖硕
(1.河北省唐山市食品药品检验中心化学室,唐山 063000;2.河北联合大学冀唐学院,唐山 063300)
·药物制剂与药品质量控制·
高效液相色谱法测定复方丹参片与滴丸中7种活性成分含量*
张爱兵1,张珺2,程月发2,张春雨1,郭兰2,刘颖硕2
(1.河北省唐山市食品药品检验中心化学室,唐山 063000;2.河北联合大学冀唐学院,唐山 063300)
目的 建立高效液相色谱(HPLC)法同时测定复方丹参片和复方丹参滴丸中7种活性成分的含量。方法 采用Zorbax XDB-C18色谱柱,以乙腈-0.1%磷酸溶液为流动相,梯度洗脱,柱温30 ℃,流速1 mL·min-1,检测波长为203,270和281 nm。结果 7种成分峰面积与浓度的线性关系良好;加样回收率在95.1%~100.4%;滴丸样品中丹参酮ⅡA未能检出。结论 建立了同时测定两类复方丹参制剂中丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸B、人参皂苷Rb1和丹参酮ⅡA含量的方法,精密度高,重复性好,可用于两类复方丹参制剂的质量控制;复方丹参片中丹参酮ⅡA含量明显高于滴丸。
丹参片,复方;丹参滴丸,复方;活性成分;色谱法,高效液相
以丹参、三七和冰片组方的复方丹参片和复方丹参滴丸是目前我国心血管病临床应用最为广泛的丹参制剂。复方丹参片最早由上海中药制药二厂于1975年研制并在1976年9月完成产品鉴定,有关该药的质量标准研究1984年得以公开[1]。复方丹参滴丸则是根据《中华人民共和国药典》1990年版复方丹参片的处方,用滴丸工艺研制而成的中药制剂[2]。虽然两制剂所用原料药材完全相同,但由于工艺和所含的主要有效成分的不同,所采用的质量标准也完全不同[3]。目前有关两产品的争议较多,主要集中在两个方面:不同剂型药物的质量标准究竟应该采用何种办法和指标[4-5];两种药物在药效学研究方面是否存在差异[6-7]。就质量标准研究而言,有关研究已经很多,但到目前为止,尚欠缺同时比较两药多种主要活性成分的报道。笔者试图通过建立高效液相色谱(HPLC)法,对复方丹参片和滴丸中7种主要活性成分进行含量测定,以丰富质量标准研究的方法和内容。
1 仪器与试剂
1.1 仪器 Agilent 1100型系列高效液相色谱仪(美国Agilent公司),包括G1311A四元梯度泵、G1313A自动进样器、G1316A柱温箱、G1315B二级管阵列检测器;Chem StationRev A 10.02色谱工作站;BP211D电子天平(德国Sartorius公司,感量:0.01 mg);SB2200超声波清洗机(上海Branson公司,频率50 Hz)。
1.2 试剂 复方丹参片(广州白云山和记黄埔中药有限公司,批号:K1A004,I2A020和I2A040)和复方丹参滴丸(天津天士力制药有限公司,批号:120104,120613和120908)均购自本地药店。对照品:原儿茶醛(批号:110810-201007),三七皂苷R1(批号:110745-200415),人参皂苷Rg1(批号:110703-200726),人参皂苷Rb1(批号:110704-200420)和丹参酮 ⅡA(批号:110766-200416)均购自中国食品药品检定研究院,均供含量测定用;对照品丹参素(批号:22681-72-7)和丹酚酸 B(批号:115939-25-8)均购自贵州迪大生物有限公司,含量>98%。乙腈为色谱纯,其他试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件 色谱柱为Zorbax XDB-C18(250 mm×4.6 mm,5 μm);流动相A为乙腈;B为0.1%磷酸水溶液;梯度洗脱(表1);柱温:30 ℃;流速:1 mL·min-1;检测波长为203,270和281 nm,进样量:10 μL。
表1 梯度洗脱中流动相的比例
Tab.1 Proportion of mobile phase in gradient elution

t/min乙腈(A)/%0.1%磷酸水溶液(B)/%01981121981302575363367506535706535
2.2 混合对照品溶液的制备 精密称取丹参酮ⅡA对照品1.77 mg,置5 mL棕色量瓶中,加甲醇溶解并稀释至刻度,配成浓度为354 μg·mL-1的贮备液,备用。精密称取对照品丹参素3.38 mg、原儿茶醛3.47 mg、三七皂苷R17.22 mg、人参皂苷Rg15.72 mg、丹酚酸B 2.26 mg和人参皂苷Rb14.58 mg,分置5 mL棕色量瓶中,加20%甲醇溶解并定容,配成浓度分别为676,694,1 444,1 144,452和916 μg·mL-1的储备液,备用。分别精密吸取上述丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮ⅡA贮备液各1 mL,置10 mL棕色量瓶中,用70%甲醇稀释至刻度,摇匀,配成混合对照品溶液。
2.3 样品溶液的制备 取复方丹参片20片,精密称定,研磨成粉末,精密称取0.30 g,置具塞锥形瓶中,精密加入70%甲醇20 mL,称定质量,超声提取30 min,放冷,再称定总量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,溶液过孔径0.45 μm滤膜,即得。取复方丹参滴丸50粒,精密称定,研磨成粉末,精密称取0.30 g置具塞锥形瓶中,精密加入70%甲醇20 mL,称定质量,超声提取30 min,放冷,再称定总量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,溶液过0.45 μm滤膜,即得。
2.4 阴性对照溶液的制备 分别按复方丹参片和复方丹参滴丸的生产工艺制备缺丹参和三七的阴性制剂,并按照样品溶液的制备方法制备阴性对照溶液。
2.5 流动相的选择 本实验的检测波长在203 nm处,甲醇在短波长处有紫外吸收,会干扰皂苷类物质色谱峰的测定,因此不能选用甲醇作为流动相。样品里含有酚酸类物质,故在流动相里加入酸溶液以防酚酸类物质水解,而甲酸或乙酸在低波长处有紫外吸收,故本实验选择的流动相为乙腈-0.1%磷酸进行梯度洗脱。
2.6 检测波长的选择 通过对丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮 ⅡA的紫外检测,三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1在203 nm低波长处出峰;丹参素,原儿茶醛和丹酚酸 B在281 nm处有最大吸收;丹参酮 ⅡA在270 nm处有最大吸收,因此采用二极管阵列检测器,检测波长为203,270和281 nm。结果见图1。
2.7 阴性对照实验 分别取混合对照品溶液、样品溶液和阴性对照溶液按本实验色谱条件进行测定。实验结果发现,在样品溶液HPLC图中,分别有与对照品溶液色谱峰保留时间一致的色谱峰,三七阴性对照溶液的HPLC图中在与对照品溶液相同保留时间的位置上,没有出现丹参素、原儿茶醛、丹酚酸 B和丹参酮ⅡA的色谱峰。丹参阴性对照溶液的HPLC图中在与对照品溶液相同保留时间的位置上,没有出现三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的色谱峰。表明阴性样品溶液对测定无干扰。结果见图1。
2.8 线性关系考察 吸取混合对照品溶液过孔径0.45 μm滤膜后,在本实验色谱条件下分别进样1,2,5,10,20和40 μL,记录色谱峰面积。以浓度(X,μg)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,对其进行线性回归,得回归方程。结果见表2。
2.9 方法学考察
2.9.1 重复性实验 取复方丹参片(批号:K1A004)和复方丹参滴丸(批号:120104),按样品溶液的制备方法分别平行制备6份样品溶液,按实验色谱条件测丹参素、原儿茶醛,、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮ⅡA的平均含量。结果复方丹参片(批号:K1A004)各成分含量依次为6.316,0.251,27.540,5.209,36.538,8.646和1.339 mg·g-1,RSD分别为0.74%,1.23%,0.92%,1.37%,0.66%,1.12%和0.76%;复方丹参滴丸(批号:120104)各成分含量依次为12.423,1.663,28.860,5.065,0.228,4.979和0 mg·g-1,RSD分别为0.88%,1.06%,1.13%,1.21%,0.87%,1.42%。表明本方法重复性良好,精密度较高。
2.9.2 稳定性实验 取复方丹参片(批号:K1A004)和复方丹参滴丸(批号:120104)样品溶液,按本实验色谱条件,分别于0,2,4,6,8 h进行测定、记录色谱图,分别计算丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮ⅡA峰面积的RSD。结果复方丹参片(批号:K1A004)各成分含量依次为0.34%,0.72%,0.32%,0.65%,0.93%,0.87%和0.95%;复方丹参滴丸(批号:120104)各成分含量依次为0.45%,1.02%,0.92%,0.82%,0.73%,0.65%,其中丹参酮ⅡA含量检测不到。说明两样品溶液在避光密闭容器中保存,在8 h内含量变化不大,比较稳定。
2.9.3 加样回收率实验 取复方丹参片和复方丹参滴丸的样品(已知复方丹参片中丹参素,原儿茶醛,三七皂苷R1,人参皂苷Rg1,丹酚酸 B,人参皂苷Rb1和丹参酮ⅡA的含量分别为6.316,0.251,27.540,5.209,36.538,8.646和1.339 mg·g-1;复方丹参滴丸中丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮ⅡA的含量分别为12.423,1.663,28.860,5.065,0.228,4.979和0 mg·g-1),分别加入一定量的对照品溶液后,测定含量,计算回收率。见表3。
2.10 样品含量测定 取3个批号复方丹参片及3个批号的复方丹参滴丸,分别按“2.2”项下方法制备供试品溶液各3份,按相应的色谱条件对样品溶液中丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮ⅡA的含量进行测定,用外标法计算。结果见表4和图1。
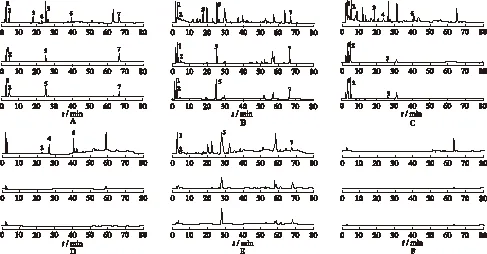
A.对照品;B.复方丹参片;C.复方丹参滴丸;D.三七阴性对照液;E.丹参阴性对照液;F.阴性对照液;1.丹参素;2.原儿茶醛;3.三七皂苷R1;4.人参皂苷Rg1;5.丹酚酸B;6.人参皂苷Rb1;7.丹参酮ⅡA
图1 对照品及复方丹参制剂的HPLC色谱图
A.reference; B.FufangDanshentablet; C.FufangDanshendropping pill; D.negative solution without Panax notoginseng; E.negative withoutRadixSalviaeMiltiorrhizae; F.negative withoutPanaxnotoginsengandRadixSalviaeMiltiorrhizae;1.propanoid acid; 2.protocatechuic aldehyde; 3.notoginsenoside R1; 4.ginsenoside Rg1; 5.salvianolic acid B; 6.ginsenoside Rb1; 7.tanshinone ⅡA
Fig.1 HPLC chromatograms of references andFufangDanshenpreparations
表2 7种成分线性关系实验结果
Tab.2 Results of linear relation test on seven active components
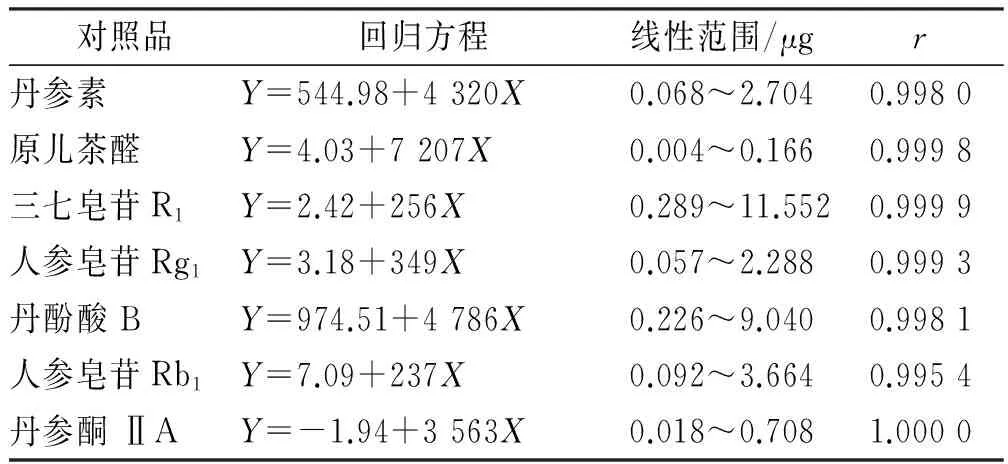
对照品回归方程线性范围/μgr丹参素Y=544.98+4320X0.068~2.7040.9980原儿茶醛Y=4.03+7207X0.004~0.1660.9998三七皂苷R1Y=2.42+256X0.289~11.5520.9999人参皂苷Rg1Y=3.18+349X0.057~2.2880.9993丹酚酸BY=974.51+4786X0.226~9.0400.9981人参皂苷Rb1Y=7.09+237X0.092~3.6640.9954丹参酮ⅡAY=-1.94+3563X0.018~0.7081.0000
表3 两种样品中7种成分回收率实验结果
Tab.3 Results of recovery tests on seven active components in two kinds of samples %,n=9

“-”未检出
“-” not check out
3 讨论
3.1 关于复方丹参制剂质量标准研究活性成分的选择 复方丹参制剂究竟采用何种活性成分作为质量标准的定性与定量指标,一直存在争议,其主要原因在于中药制剂的原料提取方法和制造工艺不同。在2010年版《中华人民共和国药典》一部中,对复方丹参片和复方丹参颗粒均要求进行丹参酮ⅡA、三七皂苷R1、人参皂苷Rb1、人参皂苷Rg1的薄层层析鉴别,含量测定只规定了丹参酮ⅡA和丹酚酸 B项目;而对复方丹参滴丸,薄层层析鉴别除了三七皂苷R1、人参皂苷Rb1、人参皂苷Rg1外,增加了人参皂苷Re和冰片项目,减除了丹参酮ⅡA,含量测定方面以丹参素作为唯一的定量指标,另有指纹图谱标准[3]。韦英杰等[8]在国内较早采用高效液相二极管阵列检测法同时测定去糖衣丹七片、复方丹参片和复方丹参滴丸中的原儿茶醛、丹酚酸B、隐丹参酮、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的含量,但该实验存在一个不足,即没有对丹参素进行测定,而丹参素恰恰是复方丹参滴丸药典标准规定的HPLC含量测定的唯一成分。因此,如果排除这个最主要的活性成分来建立质量标准的研究方法或者比较制剂的质量,无疑会降低其实际应用价值。其他的有关研究,多是对单一产品的多个活性成分的测定[9-11]或者是侧重于复方丹参制剂中多个代表性脂溶性和/或水溶性成分的测定[12-15],而对复方丹参制剂中的丹参和三七的多个活性成分测定较少。本研究依据《中华人民共和国药典》规定的丹参和三七药材质量标准含量测定要求,参考有关研究的技术和方法,选择丹参素、原儿茶醛、三七皂苷R1、人参皂苷Rg1、丹酚酸 B、人参皂苷Rb1和丹参酮ⅡA作为测定指标,同时兼顾了复方丹参片和滴丸的主要成分,建立的方法具有实际应用价值。
3.2 复方丹参滴丸中丹参酮ⅡA含量测定的差异 中药的药效不是源于一个或几个活性成分,而是作为一个整体起作用。因此,质量控制应尽量把握全面指标。但复方丹参制剂即使原料药材完全相同,因为工艺的差别会导致制剂活性成分存在差异[12],最为明显的是丹参酮ⅡA。李楚源等[13]采用HPLC-DAD法对复方丹参制剂中的活性成分进行定量比较分析,发现复方丹参片的丹参酮ⅡA含量较高,而某些复方丹参制剂中的丹参酮ⅡA定量检测不出;韦英杰等[8]对复方丹参片进行测定时,也未能检测出隐丹参酮和丹参酮ⅡA。李玉珍等[14]采用HPLC方法测定丹酚酸B和丹参酮ⅡA在复方丹参片和滴丸中的含量,在滴丸中含量极低,定量测定未能检出。有些实验虽然检测到滴丸中的丹参酮ⅡA,但含量相对偏低[10,15-16]。本研究也未能定量检测出复方丹参滴丸中丹参酮ⅡA,进一步说明了两种剂型中丹参脂溶性成分特别是丹参酮ⅡA含量差异较为明显。章弘扬等[9]采用飞行时间质谱结合离子阱多级质谱的分析方法,从复方丹参滴丸中共鉴定出8种丹参酚酸类和5种三萜皂苷类活性成分,分别归属于丹参和三七两种药材,也未发现丹参酮类化合物,从不同的方法学和技术手段层面间接证实滴丸中丹参酮ⅡA含量较低的判定。
表4 样品含量测定结果
Tab.4 Results of content determination of samples mg·g-1,n=3

“-”未检出
“-” not check out
对两类广泛应用的复方丹参制剂中多组分活性成分进行含量测定,是对质量控制方法的拓展和补充。由于两类制剂的化学成分含量有一定的差异,其功能主治、用法用量等在药效学研究,临床研究后确定是否应有所区别[14]。
[1] 钱百炎,吴恩来,金嘉良.复方丹参片内在质量研究与控制[J].中成药研究,1984,7(5):9-10.
[2] 吴迺峰,阎希军.复方丹参滴丸的质量研究[J].中国药房,1992,3(6):3-4.
[3] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:904-906.
[4] 李贻奎,李连达.从复方丹参制剂的混乱看中药标准化的迫切性与必要性[J].中国中药杂志,2008,33(4):349-352.
[5] 罗晓健,毕开顺,周书余,等.复方丹参片的研究概况[J].中成药,2001,23(5):371-374.
[6] 吴乃峰,闫希军,朱永宏.复方丹参滴丸与复方丹参片的药理作用比较[J].中成药,1993,15(8):24-25,49.
[7] 束云,李贻奎,李连达.复方丹参制剂药理作用的比较研究[J].中药药理与临床,2012,28(1):132-134.
[8] 韦英杰,李萍,李松林.高效液相二极管阵列检测法同时测定复方丹参制剂中7个成分的含量[J].分析化学,2006,34(12):1702-1706.
[9] 章弘扬,胡坪,梁琼麟,等.结合两种LC/MS方法用于复方丹参滴丸中多成分的鉴定[J].中成药,2009,31(1):60-64.
[10] 姚琳,程维明.采用高效液相色谱法同时测定复方丹参滴丸中的多成分含量[J].上海医药,2011,32(8):413-415.
[11] 施法,吴怡,王洋.HPLC法同时测定复方丹参滴丸中7个活性成分的含量[J].中国药师,2013,16(3):339-341.
[12] LI YG,SONG L,LIU M,et al.Advancement in analysis ofSalviaemiltiorrhizaeRadix et Rhizoma (Danshen)[J].J Chromatography A,2009,1216(11):1941-1953.
[13] 李楚源,曾令杰,陈松光.复方丹参制剂中主要活性成分定量比较[J].现代中药研究与实践,2004,18(1):45-47.
[14] 李玉珍,陈日来,陈晓凯,等.高效液相色谱法测定复方丹参片和滴丸中丹酚酸B和丹参酮IIA的含量[J].中国医院药学杂志,2005,25(6):523-525.
[15] 张亮,彭朋,张新峰,等.高效液相法测定9种丹参制剂中隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA[J].中成药,2012,34(6):1072-1076.
[16] 陈向明.高效液相色谱法测定复方丹参滴丸中的丹参酮ⅡA[J].光谱实验室,2013,30(2):795-797.
DOI 10.3870/yydb.2015.08.021
Determination of Seven Active Components Compared withFufangDanshenTablets and Dripping Pills by HPLC
ZHANG Aibing1,ZHANG Jun2, CHENG Yuefa2, ZHANG Chunyu1,GUO Lan2, LIU Yingshuo2
(1.TangshanInstituteforDrugControl,HebeiProvince,Tangshan063000,China;2.JitangCollegeofHebeiUnitedUniversity,Tangshan063300,China)
Objective To establish a HPLC method for simultaneous determination of seven active components inFufangDanshentablets andFufangDanshendripping pills. Methods These seven compounds were analyzed simultaneously with a Zorbax C18column by gradient elution using acetonitrile-0.1% phosphoric acid solution as mobile phase, the flow rate was 1 mL·min-1and the detection wavelength was set at 203, 270 and 281 nm, respectively. Results All the seven components showed good linear relation between peak area and concentration of the test, and the average recoveries were between 95.1%-100.4%.Tanshinone ⅡA was not detected in samples of dropping pills. Conclusion The HPLC method to determine the components including tanshinone ⅡA, salvianolic acid B, propanoid acid, protocatechuic aldehyde, notoginsenoside R1, ginsenoside Rg1and ginsenoside Rb1of the two differentDanshenpreparations has been established, and it has the advantages of simplicity, high precision, good repeatability, and can be used for the quality control of two kinds ofFufangDanshenpreparations.The content of tanshinone Ⅱ A inFufangDanshentablet was distinctly higher than that of dropping pills.
FufangDanshentablets;FufangDanshendripping pills;Active components;Chromatography,high performance liquid
2014-04-23
2014-07-29
*唐山市2013年科学技术研究与发展计划基金资助项目(13130298z);2012年河北联合大学科学研究基金资助项目(z201242)
张爱兵(1972-),男,河北唐山人,主管药师,学士,从事药物分析和药品检验。电话:0315-2034098,E-mail:zhangaibing2013@163.com。
程月发(1967-),男,安徽桐城人,副教授,博士,从事天然产物药理学研究。电话:0315-8114108,E-mail:arthurcyf@163.com。
R286;R927.2
B
1004-0781(2015)08-1067-05

