小鼠RSP3基因序列分析及其亚细胞定位
成欣然,颜润川,胡新德,宋玲珍,张 伟,张亚妹,陈树林,赵善廷
(西北农林科技大学动物医学院,陕西杨凌712100)
RSP3(radial spoke protein 3)是一个与鞭毛微管组装相关的基因,于1989年首次在衣藻中被克隆出来,衣藻pf14突变体由于缺少RSP3而发生鞭毛组装缺陷[1]。衣藻鞭毛外周微管与中心微管之间以放射辐相连,衣藻pf14突变体由于缺少RSP3蛋白而导致整个放射辐不能组装,因此推测RSP3可能直接与微管相结合,起到锚定整个放射辐的作用[2]。衣藻鞭毛放射辐起着从中心微管向外周微管传递信号的作用,放射辐缺陷突变体对外界环境更为敏感,如Ca2+浓度和cAMP 浓度等[3]。人们以衣藻为材料,通过RⅡblot overlays试验证明RSP3是一个A 型 激 酶 锚 定 蛋 白(A-kinase anchoring protein,AKAP),进一步分析发现RSP3 就是AKAP97[4]。AKAPs是功能上相关的调节蛋白家族,具有结合PKA 的保守区和引导AKAP-PKA 复合体到亚细胞位点的靶向区,AKAP不仅与PKA 相互作用,也与其他信号分子作用。
衣藻RSP3在小鼠中的同源基因于2004 年首次被克隆出来,其在小鼠基因组中的总跨度为230kb,由8个外显子和7个内含子组成,通过原位杂交技术研究发现,小鼠RSP3大量表达于神经系统中,然而其在细胞内的分布特点和功能尚不清楚[5]。酵 母 双 杂 交 试 验 表 明,RSP3 作 为 一 个AKAP,能 与ERK1/2 结 合,从 而 有 可 能 整 合ERK1/2与PKA 信号通路[6]。AKAP-PKA 复合体可汇集和整合来自各种通路的信号,该复合体不仅可局部增强cAMP 和其他信号,还可以通过降低PKA 的基础活性,发挥远程效应。
哺乳动物的纤毛和真核生物的鞭毛在结构上是一致的,哺乳动物纤毛结构缺陷可导致多种疾病,如生殖能力降低,视觉、嗅觉、听觉的减退,呼吸系统易感染,肝肾的多囊性增生等[7-8]。RSP3作为纤毛结构的重要组成部分,对维持纤毛结构的完整性至关重要,提示RSP3可能参与多种信号通路,与多种疾病密切相关。然而,目前有关哺乳动物中RSP3的研究甚少。本研究通过对多个物种RSP3蛋白氨基酸序列进行比对分析,并对其功能域进行预测,初步推测其功能及定位。为了进一步研究其可能的功能,构建了小鼠RSP3 的GFP 融合表达载体,转染CHO 细胞,对RSP3与微管进行共定位研究。同时将RSP3-GFP 转 染CHO 细 胞 后 用 KEDL 和GM130分别标记内质网和高尔基体。我们发现RSP3-GFP并不定位于内质网或高尔基体,而是聚集于胞质中。以上结果表明在哺乳动物细胞中RSP3并不能直接与微管结合,也不分布于内质网或高尔基体等细胞器,而是聚集在细胞核周围的胞质中,这为进一步深入研究RSP3在哺乳动物中的功能奠定了一定的基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 C57BL/6J小鼠购自西安交通大学,饲养于西北农林科技大学超净鼠房,3月龄开始交配,以可见阴道栓开始记为E0.5(embryo day 0.5),到E18.5时取胚胎脑组织用于提取RNA。中国 仓 鼠 卵 巢 细 胞 系 (Chinese hamster ovary,CHO)、pCAG-MCS-GFP空载体(由pCAG-MCS载体经BglⅡ单酶切后加入GFP 编码序列改造而成)和Escherichia coli DH5α菌种由西北农林科技大学神经生物学实验室保存。
1.1.2 主要试剂 限制性内切酶BamH Ⅰ、HindⅢ、BglⅡ及T4DNA 连接酶、pGEM-T Easy载体、质粒提取试剂盒、DNA 回收试剂盒为Promega公司产品;反转录试剂盒为Fermentas公司产品;X-tremeGENE HP 转 染 试 剂 为Roche 公 司 产品;TRIzol及总RNA 提取相关试剂、胎牛血清、F-12K Nutrient Mixture、DMEM、Opti-MEM、胰蛋白酶、HEPES、青霉素、链霉素为Life Technology 公司产 品;mouse anti-GM130、mouse anti-GAPDH、donkey anti-mouse-HRP为Sigma公司产品;mouse anti-KDEL 为Santa cruz公 司 产 品;DAPI、mouse anti-α-tubulin、donkey anti-mouse-568 为Millipore公司产品;引物合成及DNA 测序由南京金斯瑞生物技术有限公司完成。
1.2 方法
1.2.1 RNA 提取与反转录 按照Life Technology公司RNA 提取试剂盒上的说明书操作步骤提取组织样品总RNA,经超微量分光光度计测定RNA浓度后,保存于-80 ℃冰箱备用。取总RNA 各2.5μg进行反转录,反转录体系为:总RNA 2.5μg,5×Reaction buffer 4 μL,Oligo(dT)2 μL,10mmol/L dNTPs 1 μL,RNase Inhibitor 1 μL,RT-Enzmye 1μL,用DEPC水补足20μL。42 ℃反应1h,70 ℃5min灭活,保存于-20 ℃备用。
1.2.2 小鼠RSP3 基因克隆 根据NCBI公布的RSP3 基 因 序 列 号(GenBank Accession Number NM 025789.5)及pCAG-MCS表达载体酶切图谱设计RSP3特异性引物,在上、下游分别加入BamHⅠ和HindⅢ两个酶切位点,并加入保护性碱基(下划线部分),在上游引物中加入GCCACC 基序。上游引 物 RSP3-F:5′-GGATCCGCCACCATGGCCGCCACCAACATTTG-3′;下游引物RSP3-R:5′-AAGCTTGGCTCTGCCATAAGGTGTCCC-3′。以E18.5小鼠脑组织提取的RNA 反转录得到的cDNA 为模板进行PCR,得到RSP3基因片段。
1.2.3 RSP3 真核表达载体构建 PCR 产物经电泳后用DNA 凝胶回收试剂盒回收纯化,将回收产物与pGEM-T Easy载体连接,并转化大肠埃希菌DH5α,取100μL 转化产物均匀涂布于预先涂有5-溴-4-氯-3-吲哚-β-D 半乳糖苷(5-bromo-4-chloro-3-indolylβ-D-galactopyranoside,X-gal)和 异 丙 基-β-D-硫代吡喃半乳糖苷(isopropylβ-D-1-thiogalactopyranoside,IPTG)的含有100 mg/L 氨苄青霉素的LB 琼脂平板上,37 ℃培养过夜,挑取单个菌落,180r/min,37 ℃摇床上振荡培养过夜进行扩增,菌液PCR 和酶切鉴定后挑选阳性克隆送南京金斯瑞生物技术有限公司测序。将测序结果与NCBI上公布的序列比对分析,将完全正确的克隆命名为pGEM-T-RSP3。将pGEM-T-RSP3 菌种扩大培养后 提 取 质 粒,对pGEM-T-RSP3 和pCAG-MCSGFP质粒用BamHⅠ和HindⅢ进行双酶切,回收产物在T4DNA 连接酶作用下于16 ℃连接过夜。连接产物转化入E.coli DH5α感受态细菌,转化的菌液涂布于含100 mg/L 卡那霉素的LB 平板上培养,次日挑取单克隆,菌液PCR 和酶切鉴定后挑选阳性克隆送至金斯瑞生物技术有限公司进行测序,将获得的正确克隆命名为pCAG-RSP3-GFP。
1.2.4 RSP3序列分析与蛋白结构预测 根据NCBI上发布的多物种RSP3核苷酸和氨基酸序列(表1),通过DNA Man软件分析RSP3 核苷酸和氨基酸序列,分析RSP3在进化中的保守序列,同时通过Smart软件预测RSP3可能存在的结构域。

表1 GenBank中不同物种RSP3核酸和蛋白序列号Table 1 Nucleotide and protein numbers of RSP3in different organisms from GenBank
1.2.5 CHO 细胞培养及转染 在细胞培养皿中加入适量的F12-K 细胞培养液并接种CHO 细胞,混匀后置于37 ℃、体积分数为5%CO2的条件下培养,转染前将CHO 细胞传代至提前放有细胞爬片的24孔细胞培养板中,待其汇合度达70%左右用X-tremeGENE HP转染试剂进行转染,操作按照XtremeGENE HP转染试剂说明书进行。
1.2.6 细胞免疫荧光染色 将转染后24h的细胞取出,用40mL/L的多聚甲醛溶液固定30 min,经1mL/L Triton X-100 透化、10 mL/L 的羊血清 封闭后,用0.1mol/L PB 洗涤3次,每次10min。在不同样品中分别加入mouse anti-α-tubulin、mouse anti-KDEL、mouse anti-GM130,4 ℃过 夜 孵 育,0.1mol/L PB冲洗3次,每次15min,然后加入Alexa Fluor 568donkey anti-mouse IgG 荧 光 标 记 二抗,室温孵育3h。加入1μg/mL DAPI对胞核进行染色,室温下孵育3min,0.1 mol/L PB 冲洗3 次,每次15min,染色结束后用抗荧光淬灭剂(Dako)封片,置于蔡氏倒置荧光显微镜下拍照观察分析。
2 结果
2.1 RSP3 基 因 扩 增 及pCAG-RSP3-GFP 表 达 载体构建
以小鼠胚胎18.5d(E18.5)脑组织提取RNA,经反转录得到cDNA 模板,PCR 扩增RSP3基因,产物经10g/L琼脂糖凝胶电泳,在约1 500bp处出现特异性扩增条带,阴性对照组(以水为模板)未见扩增条带(图1)。将目的片段回收后连接pGEM-T Easy载体,转化大肠埃希菌中扩增,提取pGEM-TRSP3质粒用BamHⅠ和HindⅢ进行双酶切,得到预期的2个条带,3 100bp左右的为pGEM-T Easy载体片段,1 500bp 左右的为RSP3 基因片段(图2),回收RSP3 基因片段与同样双酶切的pCAGMCS-GFP载体连接。重组质粒载体pCAG-RSP3-GFP经BamHⅠ和HindⅢ双酶切,电泳检测得到2个条带,5 800bp左右的条带为pCAG-MCS-GFP载体,1 500bp左右的条带为RSP3基因片段(图3)。
2.2 RSP3序列分析及蛋白结构预测
用DNA Man软件将小鼠的RSP3氨基酸序列与NCBI上公布的其他物种的RSP3氨基酸序列进行比对,结果表明小鼠RSP3氨基酸序列与大鼠、猕猴、人类、斑马鱼和非洲爪蟾的RSP3氨基酸序列同源性 分 别 为86.9%、76.1%、66.1%、61.7%和61.1%(图4A)。这些物种的RSP3氨基酸序列比对发现有一段进化过程中高度保守序列,这段序列有可能与RSP3的功能密切相关(图4B)。用SMART软件对小鼠的RSP3蛋白结构域进行预测,预测结果表明在RSP3的N-端有一个Coil-coil结构域,中间部分为RSP3结构域,其余部分无明显结构域(图4C)。

图1 RSP3基因PCR 扩增电泳分析Fig.1 Agarose gel electrophoresis analysis of PCR products
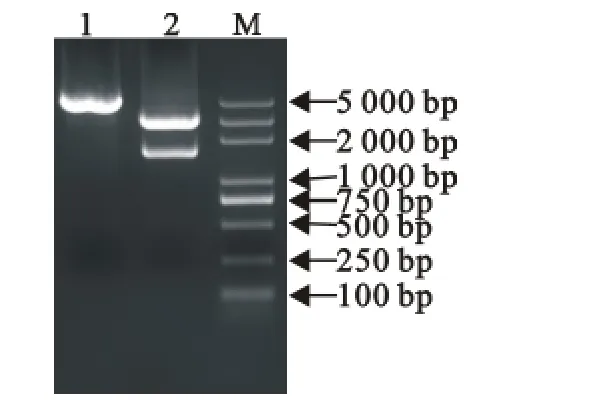
图2 重组质粒双酶切鉴定Fig.2 Restriction enzyme digestion of recombinant plasmid pGEM-T-RSP3

图3 重组质粒pCAG-RSP3-GFP酶切鉴定Fig.3 Restriction enzyme digestion analysis of pCAG-RSP3-GFP

图4 RSP3序列分析及蛋白结构预测Fig.4 Sequence analysis and domain prediction of mouse RSP3
2.3 RSP3在CHO 细胞中表达
小鼠RSP3是衣藻RSP3的同源基因,在衣藻中RSP3可与鞭毛微管结合,通过SMART 软件预测分析发现小鼠RSP3有一个RSP3结构域。为了研究哺乳动物RSP3 是否直接与微管结合,通过培养CHO 细胞,制作细胞爬片并转染pCAG-RSP3-GFP重组质粒。转染后24h用PFA 固定,用tubulin单克隆抗体标记微管,在荧光显微镜下可见在CHO 细胞中微管作为骨架分布于整个细胞,但RSP3-GFP并不与微管相结合,而是呈聚集状态分布于细胞内(图5F),GFP 对照组呈均匀弥散的分布状态(图5C)。进一步分析其分布特点发现,RSP3-GFP主要分布在细胞核的周围,聚集成有一定体积的颗粒。
2.4 RSP3在CHO 细胞中的分布特点
在CHO 细胞中RSP3并未与微管相结合,而其分布形态与细胞内膜系统相似,为了进一步研究RSP3在细胞中的亚定位,本试验通过不同的细胞器特异性标记抗体对RSP3进行亚细胞定位。pCAGRSP3-GFP重组质粒转染CHO 细胞后,用KDEL抗体对内质网进行标记,用GM130抗体对高尔基体进行标记,结合RSP3-GFP绿色荧光,在荧光显微镜下观察RSP3在CHO 细胞中的亚定位。在荧光显微镜下可观察到RSP3-GFP 绿色荧光信号并不与KDEL红色荧光信号重合,而是比KDEL 分布更集中更靠近细胞核(图6)。高尔基体特异性标记GM130与RSP3-GFP也不重合,而是呈现出一定的交错状态,即RSP3-GFP空隙处正好有GM130标记信号,而且GM130 信号分布在细胞核的一端,而RSP3-GFP环绕细胞核的周围都有分布(图7)。以上结果表明RSP3聚集分布于胞质中,而且不与内质网及高尔基体结合。

图5 小鼠RSP3重组蛋白在CHO 细胞中表达Fig.5 The expression of RSP3in CHO cells

图6 荧光双标RSP3和内质网Fig.6 Co-label of RSP3-GFP and endoplasmic reticulum

图7 RSP3与高尔基体共定位分析Fig.7 Co-label of RSP3-GFP and Golgi apparatus
3 讨论
RSP3于1989年首次在衣藻中被克隆,并被证明是一个鞭毛相关蛋白,参与鞭毛的组装,然而其在小鼠中的同源基因一直到2004年才被首次克隆出来[1,5]。在 衣 藻 中,RSP3 作 为 一 个AKAP 通 过 与PKA 全酶的RⅡ亚基的RⅡa区域结合而局域化调控PKA,调节纤毛和鞭毛的运动[4]。在进化过程中,高等植物基本上已经失去了纤毛和鞭毛结构,但哺乳动物却保留了纤毛。哺乳动物的纤毛分为可动纤毛和原始纤毛。可动纤毛主要分布于肺上皮、输卵管、室管膜及精子鞭毛,为“9+2”结构,主要与运动相关,而原始纤毛几乎存在于所有细胞,为“9+0”结构,主要与细胞感受外界环境及信号传递相关[9]。哺乳动物RSP3是否也是纤毛的结构蛋白,是否也参与纤毛运动的调控及相关信号转导,在进化过程中其功能发生了哪些变化,目前尚无相关研究。
通过氨基酸序列比对分析发现,小鼠RSP3 与衣藻RSP3在结构上有些不同,这可能是在进化过程中该基因的功能发生了改变。哺乳动物中RSP3的N-端比衣藻多出127个氨基酸,而其功能尚不清楚,也许是进化过程中对其功能的补充。蛋白结构预测结果表明,在RSP3的N-端有一个Coil-coil结构域,中间部分为RSP3结构域,其余部分无明显结构域。Coil-coil结构功能多样,在不同的蛋白中其功能往往不同,而RSP3结构域是一个可能与微管结合的结构域,由此可推测RSP3有可能与微管相结合。衣藻RSP3通过其N-端的RSP3结构域结合于放射辐上,这提示我们在哺乳动物细胞中RSP3 也可能与微管相结合。我们通过表达小鼠RSP3与微管共定位,发现其并不与微管结合,微管分布于整个细胞,构成网状结构的骨架,而RSP3聚集分布于细胞内。其绕核分布的特点提示我们,RSP3可能锚定于内质网或是高尔基体上。本研究通过内质网特异性Maker KDEL和高尔基体特异性Maker GM130,将RSP3与内质网或高尔基体共定位,结果表明RSP3并未锚定于内质网或是高尔基体上,而是以聚集状态分布于细胞质中。
在衣藻中的研究表明,RSP3能与多种蛋白相结合组成放射辐,从中心鞘向外周二联体微管传递信息调节鞭毛的运动,在衣藻RSP3的PKA 结合结构域突变体中,由于RSP3不能与PKA 结合而导致运动障碍[10-11]。在锥虫中的研究表明,RSP3还参与调节动力蛋白的运动从而调节细胞分裂过程,有学者通过酵母双杂交的方法证明RSP3能与ERK1/2结合,表明RSP3可能参与了细胞分裂的信号传递或是通过纤毛感觉外界环境的变化调节细胞分裂的过程[6,12]。纤毛或鞭毛运动的调节是通过动力蛋白的磷酸化和去磷酸化来调节的,而RSP3 作为一个AKAP,在动力蛋白磷酸化调节及纤毛运动过程中扮演者非常重要的角色[13]。衣藻RSP3有两个两亲结构域,形成一个同源二聚体,能与含有Dpy-30结构域的蛋白互作[14]。这些结果提示我们RSP3可能不仅仅是一个纤毛的组成结构,还可能参与了多种信号的传递和整合。
本研究首次通过在哺乳动物细胞中表达RSP3,研究其分布特点和可能的功能,结果表明,哺乳动物RSP3与衣藻相比存在着一些相同之处,也存在着很大的差异,这可能是在进化过程中其功能发生了一定的改变。在CHO 细胞中表达RSP3 后发现其聚集程度很高,可能为蛋白多聚体,而衣藻中RSP3只是形成二聚体,聚集程度相对很低。哺乳动物细胞更为复杂,功能更多样,哺乳动物RSP3 与衣藻RSP3蛋白结构的差异性和保守性可能决定了其功能的差异性与相似性。衣藻中RSP3与多种蛋白互作,那么在哺乳动物中相对应的同源基因间是否存在互作,哺乳动物大多数细胞保留了纤毛结构,RSP3是否也构成哺乳动物纤毛的结构成分,这些都还有待进一步研究。本研究通过构建RSP3表达载体,并在CHO 细胞中表达,探讨了哺乳动物RSP3的基本性质和在细胞中的表达及定位情况,为研究RSP3在进化过程中的功能演变提供了一定的线索,也为进一步深入研究其在哺乳动物细胞和机体内的功能奠定了基础。
[1] Wiliams B,Velleca M,Curry A,et al.Molecular cloning and sequence analysis of the chlamydomonas gene coding for radial spoke protein 3:flagellar mutation pf-14Is an ochre allele[J].J Cell Biol,1989,109:235-245.
[2] Diener D,Ang L H,Joel R.Assembly of flagellar radial spoke proteins in chlamydomonas:identification of the axoneme binding domain of radial spoke protein 3[J].J Cell Biol,1993,123(1):183-190.
[3] Gaillard A R,Fox L A,Rhea J M,et al.Disruption of the Akinase anchoring domain in flagellar radial spoke protein 3results in unregulated axonemal cAMP-dependent protein kinase activity and abnormal flagellar motility[J].Mol Biol Cell,2006,17:2626-2635.
[4] Gaillard A R,Diener D R,Rosenbaum J L,et al.Flagellar radial spoke protein 3is an A-kinase anchoring protein(AKAP)[J].J Cell Biol,2001,153(2):443-448.
[5] Koukoulasa I,Augustinea C,Sikernmeumer N,et al.Genomic organisation and nervous system expression of radial spoke protein 3[J].Gene,2004,34524:9-18.
[6] Jivan A,Earnest S,Juang Y C,et al.Radial spoke protein 3is a mammalian protein kinase A-anchoring protein that binds ERK1/2[J].J Biol Chem,2009,284(43):29437-29445.
[7] 曹木青,潘俊敏.纤毛及纤毛相关疾病研究进展[J].中国细胞生物学学报,2012,34(9):849-856.
[8] 潘俊敏.衣藻、纤毛与“纤毛相关疾病”[J].中国科学,2008,38(5):399-409.
[9] Green J A,Mykytyn K.Neuronal ciliary signaling in homeostasis and disease[J].Cell Mol Life Sci,2010,67:3287-3297.
[10] Nakano I,Kobayashi T,Yoshimura M,et al.Central-pairlinked regulation of microtubule sliding by calcium in flagellar axonemes[J].J Cell Sci,2003,116(8):1627-1636.
[11] Gaillard A R,Fox L A,Rhea J M,et al.Disruption of the Akinase anchoring domain in flagellar radial spoke protein 3pesults in unregulated axonemal cAMP-dependent protein kinase activity and abnormal flagellar motility[J].Mol Biol Cell,2006,17:2626-2635.
[12] Ralston K S,Lerner A G,Diener D R,et al.Flagellar motility contributes to cytokinesis in trypanosoma brucei and is modulated by an evolutionarily conserved dynein regulatory system[J].Eukaryotic Cell,2006,5(4):696-711.
[13] Wirschell M,Yamamoto R,Alford L,et al.Regulation of ciliary motility:Conserved protein kinases and phosphatases are targeted and anchored in the ciliary axoneme[J].Arch Biochem Biophys,2011,510:93-100.
[14] Sivadas P,Dienes J M,Maurice M S,et al.A flagellar A-kinase anchoring protein with two amphipathic helices forms a structural scaffold in the radial spoke complex[J].J Cell Biol,2012,199(4):639-651.