不同光照条件下氮浓度对衣藻生长及油脂积累的影响
陈余佳, 涂晓盟, 王永强, 王全喜, 许丽丽
(上海师范大学 生命科学学院 植物种质资源开发协同创新中心,上海 200234)
0 引 言
传统化工能源在生产过程中会产生含硫及含氮污染物,新能源的开发利用已成为一项迫切的任务[1].在生产过程中,生物质能源通过光合作用将空气中的二氧化碳转化成有机物储存,其在燃烧时又把二氧化碳再次释放到大气中,因此被认为是一种新型的低排放、低污染的清洁能源[2].藻类可以通过光合作用将二氧化碳和水转化为氧气、碳水化合物或者脂质形式的大分子有机物[3].在某些胁迫条件下,如高光或营养缺乏,一些藻类可积累大量脂质,如三酰甘油酯等[4-5].由于微藻生长速度快,脂质含量高,又被认为是生产生物柴油的理想材料[4-5].目前发现产油量高的藻类主要包括金藻(Chrysophytes)、定鞭藻(Haptophytes)、双鞭毛虫(Dinophytes)、黄藻(Xanthophyceae)、红藻(Rhodophytes)和莱茵衣藻(Chlamydomonasreinhardtii)等.它们在正常环境下生长时的平均油脂质量分数为干重的27.1%,处于环境胁迫条件下时则可上升到44.6%[4].相比其他藻类,莱茵衣藻(以下简称衣藻)是一种单细胞绿藻,其基因组已被完全测序,便于进行遗传研究,且生长快,培养成本低,在缺氮条件下能产生油脂,被认为是油脂生产研究的模式物种[6].与其他微藻类一样,衣藻在缺氮条件下的生长受到抑制,其生物量与油脂的积累及缺氮程度呈负相关[6-8],这导致其脂质生产效率及积累量均低于理论值.因此,探明衣藻油脂积累的最佳条件,是当前藻类产油的研究热点.本研究设置不同氮含量的培养基,在不同光照条件下进行衣藻产油诱导,并测定衣藻的生物量及油脂含量,以确定最适于衣藻油脂积累环境的氮含量.
1 材料与方法
1.1 实验材料与培养方法
选用的衣藻藻种为衣藻(C.reinhardtii)cc849,购自美国杜克大学藻种库,其正常培养条件为:温度 (25±1) ℃,水平摇床转速 120 r·min-1,光照强度 0~200 μE·m-2·s-1,培养基为Tris-Acetate-Phosphate(TAP) (pH=7.0),液体培养每5 d继代1次,接种量为1%;固体TAP培养基含1%(质量分数)的琼脂,藻种的纯化和保存是以藻液或单克隆通过划线方法接种在TAP琼脂平板上,每二周继代1次[9].用相等物质的量的氯化钠替换正常TAP培养基内的氯化铵来配制缺氮培养基(TAP-N)以培养衣藻产油[9-10].
1.2 衣藻的缺氮培养
当培养瓶中的衣藻细胞生长到对数期(约2~3 d)时,在25℃温度下,以3500 r·min-1转速离心5 min,弃上清,使用TAP-N培养基缓慢洗涤藻细胞3次,以彻底除去氮[8].用TAP-N培养基洗涤过的衣藻,按照体积分数1%接种量加入到容积为500 mL的培养瓶中.然后用TAP-N培养基及TAP培养基定容混合培养液400 mL,使得培养基中氮的质量浓度分别为100,200,300 mg·mL-1,轻轻晃动培养瓶中的样品,使藻类悬浮均匀.用TAP-N培养基及正常TAP培养基培养的衣藻样品作为实验对照组.最后将培养瓶分别置于光照强度为30,60,100,200 μE·m-2·s-1的光照条件下进行缺氮培养.
1.3 衣藻生长的测定
衣藻在750 nm处的吸光度(OD750)值与其细胞数正相关,因此可用分光光度计测定衣藻的OD750值来反映衣藻的生长情况[10].所用分光光度计为TU-1901双光束可见-紫外光分光光度计(北京普析通用有限责任公司).衣藻叶绿素含量的测定是用95%(体积分数)酒精萃取,测定OD665值(A665)和OD649值(A649),计算出衣藻中的叶绿素a(Chla)、叶绿素b(Chlb)及总叶绿素(Chl)的质量浓度(CChla,CChlb,CCh1)(单位为mg·L-1),计算公式[10]为:
CChl=CChla+CChlb= 6.10×A665+ 20.04×A649,
(1)
并进行3次生物学重复,取平均值.
1.4 衣藻油脂的测定
采用文献[11]的方法检测衣藻中的油脂含量,并进行3次生物学重复.提取400 mL藻细胞,以3500 r·min-1转速离心10 min,然后用新鲜的TAP-N培养基洗涤3次,之后将固体样品放入干燥的称量瓶中在温度80 ℃的烘箱中干燥24 h,直到质量不再减少为止.称取0.2 g的干细胞(质量记为W0),将其转移到离心管中,然后将5 mL的氯仿和甲醇的混合物(体积比为1∶1)加入到离心管中.将离心管中的细胞和混合物在振荡器上震荡30 min,然后以5000 r·min-1转速离心10 min,取上清液.重复以上步骤直到萃取的上清液为无色.收集所有上清液(质量记为W1),并转移至质量已知的干燥旋转蒸发仪中蒸发至干燥(质量记为W2).总脂含量(质量分数)
Ct= (W2-W1)/W0×100%.
(2)
1.5 数据分析
采用独立样本t检验,分析实验组和对照组的油脂产量的差异,显著性水平设定为p<0.05.显著性差异的结果用*标注在相应的图中.同时本文作者采用双因素方差分析探索了光照、氮,以及光照和氮的交互作用对油脂产量的影响.所有数据处理过程均在SPSS 19.0中完成.
2 结果与分析
2.1 氮浓度对衣藻生长的影响
以TAP-N培养基及正常TAP培养基作为实验对照组,对不同氮浓度胁迫下的衣藻在不同光照强度下的油脂产量进行检测,结果如图1所示.
当光照强度为30 μE·m-2·s-1,培养基中氮的质量浓度分别为0 (TAP-N),100,200,300和375 mg·L-1(TAP培养基)时,衣藻的OD750值随着培养时间增加逐渐增长,至第7 d时达到最大值,分别为0.08,1.61,1.61,1.62和1.75,如图1(a)所示;衣藻的叶绿素质量浓度也随着培养时间增加逐渐增长,最初为0.35 mg·mL-1,至第7 d时达到最大值,分别为0.04,7.08,17.87,26.01,27.84 mg·mL-1,如图1(b)所示.相对于TAP培养基中的衣藻,缺氮条件下衣藻的生长受到了抑制,尤其在完全缺氮(TAP-N)条件下,本研究结果显示:在第7 d,衣藻的生长受到明显的抑制,OD750值比TAP条件下的降低了97.3%,叶绿素质量浓度降低了99.8%.当培养基中氮的质量浓度为100,200,300 mg·L-1时,所培养衣藻的OD750值分别比TAP条件下的值降低了45.8%,45.8%和45.5%.叶绿素的质量浓度下降更为显著,分别比TAP条件下的值降低了74.6%、35.8%和6.6%.其他培养时间均有类似的趋势,但是抑制效果没有第7 d的明显.
同30 μE·m-2·s-1类似,当光照强度为60 μE·m-2·s-1和100 μE·m-2·s-1条件时,衣藻的OD750值和叶绿素质量浓度也随着培养时间增加逐渐增长,如图1(c)~1(f)所示.在完全缺氮条件下,在第7 d时分别达到最大值,OD750值分别为2.96和3.01,如图1(c),1(e)所示;叶绿素质量浓度最大值分别为29.26 mg·mL-1和28.88 mg·mL-1,如图1(d),1(f)所示.由结果可知,在光照强度为60 μE·m-2·s-1和100 μE·m-2·s-1时,缺氮后的衣藻生长都同样受到了影响,尤其是TAP-N条件下,衣藻的OD750值比对照组TAP条件下的值降低了92.9%~97.0%,叶绿素浓度降低了98.8%~99.4%.其他培养时间均有类似的趋势,但是抑制效果没有第7 d的明显.
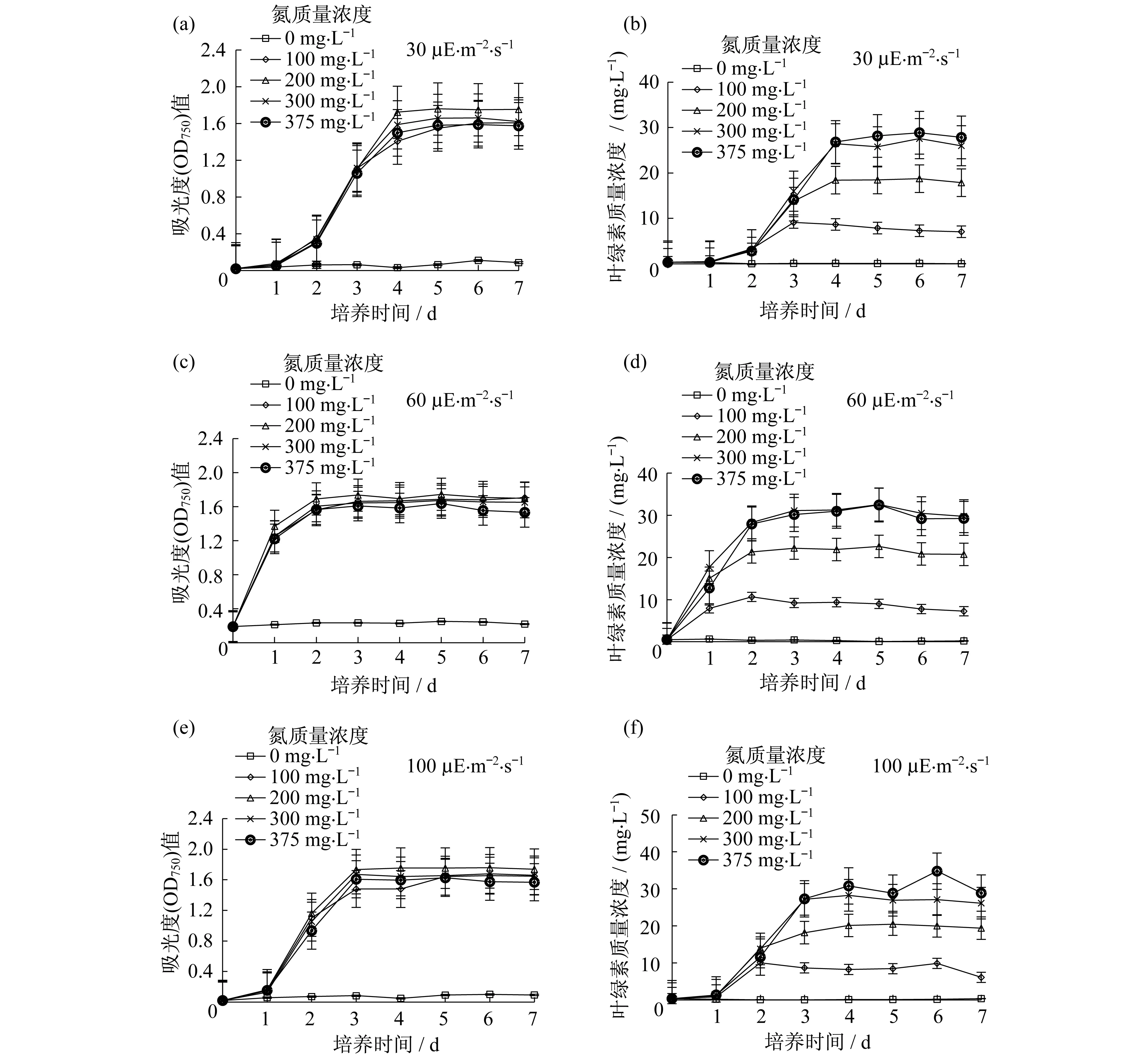
图1 不同氮质量浓度下,衣藻OD750值与叶绿素质量浓度随时间增长的变化.光照强度为(a),(b)30 μE·m-2·s-1;(c),(d) 60 μE·m-2·s-1;(e),(f) 100 μE·m-2·s-1
2.2 氮浓度对衣藻油脂积累的影响
由图1可知,尽管氮浓度及光照强度条件不同,但衣藻的生长在第2 d基本处于对数增长时期.因此,为了统一培养时间,本文作者检测了衣藻在不同光照强度及氮浓度条件下培养至第2 d的油脂含量,结果如图2,表1所示.由图2可知,缺氮胁迫可以促进衣藻体内油脂的积累,氮浓度越低衣藻的总脂含量越高,在3个光照强度下,完全缺氮条件(0 mg·L-1,TAP-N)下衣藻的总脂含量最大,显著高于氮质量浓度为100,200,300,375 mg·L-1时的(p<0.05).当光照强度为30 μE·m-2·s-1时,TAP-N培养基培养的衣藻的总脂含量(质量分数)为48.6%,大约是TAP培养条件下的3.2倍,其他氮浓度条件下衣藻的总脂含量大约分别是对照组TAP条件下的2.7,2.4和1.7倍.当光照强度为60 μE·m-2·s-1时,衣藻的油脂产量也随着氮浓度的增多逐渐降低,尤其是完全缺氮的情况下总脂含量(质量分数)最高为42.2%,大约是对照组TAP条件下的3.2倍,其他氮浓度条件下的总脂含量大约分别是对照组条件下的2.5,1.8和1.4倍.同样地,当光照强度为100 μE·m-2·s-1时,衣藻的总脂含量也随着氮浓度的增多逐渐降低,完全缺氮的情况下总脂含量(质量分数)最高为39.2%,大约是对照组TAP条件下的3.3倍,其他氮浓度条件下的总脂含量大约分别是对照组TAP条件下的3.0,2.9和1.9倍.通过独立样本t检验进行显著性差异分析可知,缺氮条件下培养的衣藻的总脂含量相比于TAP培养基中的衣藻的总脂含量均有显著性提高(p<0.05).

图2 不同光照强度及氮浓度条件下衣藻在第2 d的总脂含量.*表示通过独立样本t检验实验组与对照组具有显著性差异

表1 不同光照强度及氮浓度条件下衣藻在第2 d的总脂含量
2.3 衣藻油脂积累的影响因素分析
由图1和表2可知,光照强度和氮质量浓度都能对衣藻的油脂积累量产生影响.利用双因素方差分析了第2 d的数据.结果表明,光照强度、氮质量浓度及这2个因素的交互作用对总脂含量的影响都是显著的(p<0.05).光照强度与油脂积累量成负关联,油脂积累量随氮质量浓度增加而减小(图2,表1).这说明,光照强度为30 μE·m-2·s-1和低氮浓度条件下衣藻的总脂含量最优,在探究影响衣藻总脂含量时需同时考虑这两个因素的作用.
表2中,df表示自由度;F为检验的数值;p为相应的影响因素对总酯含量影响的显著性水平;R2为决定系数,表示双因素方差分析整体可信程度,R2越高,表示双因素方差分析的结果越可信.R2=0.98.
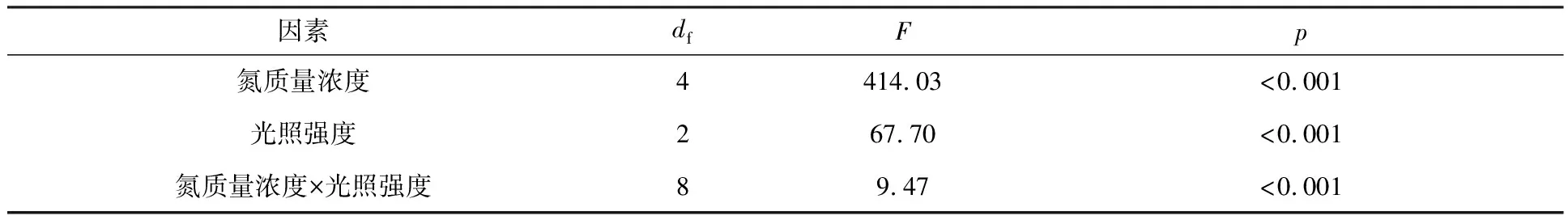
表2 光照强度和氮质量浓度对总脂含量影响的双因素方差分析结果
3 讨 论
自然条件下微藻体内的油脂含量相对比较低,但是在氮浓度不足的情况下,脂肪和碳水化合物产量会増加,因此大部分的微藻产油都是基于缺氮条件培养.SIAUT等[12]研究发现,衣藻的油脂积累量与其生物量有直接关系,同时也会受到光照强度、pH值等其他因素的影响[13].本研究设置了5个不同的氮浓度及3个不同的光照强度梯度以探究衣藻产油的适宜条件.实验结果表明:缺氮条件下衣藻的生长受到抑制,尤其是叶绿素含量相对于正常TAP培养基中的衣藻受到严重抑制,由于氮元素是叶绿素的主要组成部分,因此缺氮后衣藻的叶绿素合成受到较大影响,可以进一步通过检测衣藻的光系统二的活性来验证.KIM等[13]指出:光照强度过大,衣藻细胞容易受到光损伤,而较低的光照强度下衣藻细胞的光合作用较弱,也不利于其生物量的积累,因此很有必要寻找衣藻生物量积累的适宜光照强度.本研究利用双因素方差分析光照强度和氮浓度对衣藻油脂积累量的影响.结果发现,光照强度和氮浓度都对油脂积累具有重要作用.结合t检验对比分析结果发现,利于衣藻生物量积累的最佳光照强度为30 μE·m-2·s-1.同时,与HU等[14]和WANG等[15]的研究结果相同.本研究结果显示衣藻在完全缺氮(TAP-N)状态下的油脂含量增加最为显著.但是考虑到生物量因素,选取最佳氮质量浓度为100 mg·mL-1为宜.当光照强度30 μE·m-2·s-1,氮质量浓度为100 mg·mL-1时,衣藻的油脂积累量取得最优值,为39.79%(表1).此外,由于本研究中设置的初始衣藻细胞浓度过低(OD750仅为0.34),导致了完全缺氮条件下衣藻的生物量极低,而氮浓度设置梯度过大,这导致较低水平的氮含量培养的衣藻生物量偏差太大.因此在今后的研究中,应提高衣藻的初始细胞浓度,并缩小氮浓度梯度间隔.
4 结 论
检测了不同氮浓度下及光照强度下衣藻的油脂产量,结果显示,氮浓度和光照强度都对衣藻油脂积累量存在显著影响,利用衣藻产油时,需综合考虑这两个因素.本研究得出衣藻最佳积累油脂的氮质量浓度为100 mg·mL-1,光照强度为30 μE·m-2·s-1.

